桉叶抗氧化物分离纯化及其抗氧化活性的研究
陈运娇,李 伟,陈洪璋,王俊亮,曹 庸*
(1. 华南农业大学食品学院,广东 广州 510642;2.广东省天然活性物工程技术研究中心,广东 广州 510642)
桉叶抗氧化物分离纯化及其抗氧化活性的研究
陈运娇1,2,李 伟1,2,陈洪璋1,2,王俊亮1,2,曹 庸1,2*
(1. 华南农业大学食品学院,广东 广州 510642;2.广东省天然活性物工程技术研究中心,广东 广州 510642)
本文以DPPH自由基清除能力为指标,采用Diaion HP-20大孔吸附树脂、Toyopearl HW-40凝聚树脂柱层析、HPLC液相及核磁共振等技术对桉叶中抗氧化活性成分进行分离纯化及鉴定,得到1,2,3,6-四没食子酰葡萄糖和5-甲氧基糠醛,其中后者为首次在桉叶中分离得到。与抗氧化剂Trolox相比,两者具有更强的DPPH自由基清除能力,尤其是1,2,3,6-四没食子酰葡萄糖。
桉叶;DPPH自由基清除能力;1,2,3,6-四没食子酰葡萄糖
生物体内的活性氧(ROS)含量过高会引起氧化胁迫,而氧化胁迫被认为与致癌作用、衰老和其他退化性疾病相关[1]。抗氧化剂可以清除ROS,阻止一系列的慢性疾病的发生[2],因此抗氧化剂的研究越来越热门。然而,人工合成抗氧化剂如BHA和BHT的使用常因产生一些副作用而受到质疑[3]。因此,安全性更高的天然抗氧化剂的开发和利用成为研究热点,从植物中提取抗氧化活性物质受到越来越多的关注[4]。
桉树(Eucalyptus)是世界三大速生树种之一[5],投产后每年产生大量桉叶废弃物,研究发现桉叶具有抗氧化活性、抗肿瘤、抗菌、抗氧化和抑制HIV逆转录酶等多种活性功能[6]。在日本,桉叶提取物已被注册为天然的食品添加剂[7]。作者团队已从巨尾桉(E.grandis×E.urophylla)广林9号桉叶中提取到了9种具有抗氧化活性的化合物[8-9],但仍还有许多组分待分离鉴定。因此,本文以广林9号桉树叶为研究对象,运用抗氧化活性追踪方法,对其抗氧化活性成分继续进行分离纯化及鉴定,以期分离获得有效的抗氧化剂,为桉叶的综合利用提供指导。
1 材料与方法
1.1 试剂
提取、分离和纯化溶剂为:乙醇、石油醚、氯仿、乙酸乙酯、正丁醇和丙酮。抗氧化活性实验溶剂为:DPPH(Sigma-Aldrich)。制备高效液相色谱和抗氧化活性实验的溶剂均为分析纯。用于分析高效液相色谱法的溶剂为高效液相色谱级。
1.2 桉叶抗氧化物的提取、分离及纯化
广林九号桉叶采于广东省茂名市林业局,自然阴干后粉碎备用。将桉叶水洗干净,置于室内自然阴干。把干叶磨成粉末,过40-60目筛的桉叶粉末1 kg,加入20倍体积的70%乙醇溶剂,超声波提取两次,每次30min,减压抽滤,合并滤液,减压旋转蒸发溶剂后,用蒸馏水定容到1 L。
连续依次用石油醚、氯仿、乙酸乙酯、水饱和正丁醇和水等不同极性溶剂进行萃取,各种溶剂重复萃取5次。萃取物用减压旋转蒸发仪浓缩后冷冻干燥,冷藏备用。从本团队前期研究[10]可得知,乙酸乙酯萃取物显示出最强的清除能力,因此乙酸乙酯萃取物被用于进一步的分离。称取20 g乙酸乙酯萃取物溶解于用800mL蒸馏水中后上样,以不同浓度的水-乙醇混合液梯度洗脱,流速为1 B·h-1,每个梯度洗脱5 BV,分步收集,合并同一梯度洗脱液,真空浓缩,冷冻干燥,检测每个洗脱组分抗氧化活性。
1.3 高效液相色谱
1.3.1 分析液相分析方法
岛津HPLC仪(LC-10AT二元高压梯度仪,SPD-10A紫外检测仪);色谱柱为Diamonsil C18色谱柱(250mm×4.6mm,5 µm);检测波长270 nm,色谱洗脱条件0% ~ 90%甲醇(含有0.2%乙酸)梯度洗脱1 h,流速为1mL·min-1;进样量:20 µL。
1.3.2 分析样品准备
各分析样品溶解于甲醇中,上样前过滤(0.45 μm)。称取定量分析样品,加甲醇溶解,过0.45 μm微孔滤膜后。用微量进样器精密吸取20 μl进行分析测定。
1.3.3 制备液相条件
岛津HPLC仪(LC-8A HPLC二元高压梯度仪,SPD-10A紫外检测仪);色谱柱为岛津Shim-pack ODS型C18柱(250mm×20mm, 5 μm);检测波长270 nm,色谱洗脱条件根据分析液相分析的最佳分离条件,流速为12-15 1mL·min-1。
1.4 DPPH自由基清除能力的测定
参照Kumaran等[11]方法并做一定的修改。样品溶解于水或甲醇,稀释成将一系列浓度的溶液。将0.2mL溶液加入DPPH溶液(3.8mL,1×10-4mol·L-1)中摇匀,在室温下密闭静置30min,用纯溶剂作参比,于517 nm波长下测定吸光度A值。根据下列公式计算每种提取液对DPPH自由基的清除率:
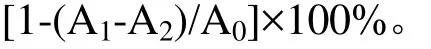
式中:A1为0.2mL提取液加入DPPH溶液的吸光度;A2为0.2mL提取液加入DPPH溶剂(甲醇)后的吸光度;A0为0.2mL DPPH溶剂(甲醇)+3.8mL DPPH溶液的吸光度。根据回归方程求出清除率达50%时的化合物浓度即半清除率浓度IC50。
1.5 核磁共振分析
核磁共振用美国Varian INOVA仪器进行。
1.6 数据分析
所有实验重复3次。所有结果表示为均值±误差(n=3)。数据用单向方差分析(P<0.05) (SPSS 13) 。
2 结果与分析
2.1 Diaion HP-20大孔吸附树脂分离组分清除DPPH·能力
从作者团队的前期研究[10]可得知,石油醚、氯仿、乙酸乙酯、水饱和正丁醇和水5种溶剂的桉叶萃取物中,乙酸乙酯萃取物显示出最强的DPPH自由基清除能力(半清除率浓度为97 μg·mL-1),因此乙酸乙酯萃取物被用于进一步的分离。称取20g乙酸乙酯萃取物用水最大浓度溶解上样,分别以水及10%、15%、20%、24%、30%、50%、70% 的乙醇对桉叶乙酸乙酯组分进行洗脱分离,每个浓度洗脱5个柱体积,并将洗脱液收集在一起,得到的组分依次命名为:P0、P10、P15、P20、P24、P30、P50和P70。接着采用分析液相方法对每个洗脱组分成分进行分析并检测其清除DPPH自由基能力,结果如图1和图3。由图3可知,Diaion HP-20大孔吸附树脂对桉叶抗氧化物有较好的分离效果。P0组分成分较简单,可对其进行制备分离后进行结构鉴定,P10-P30组分物质出峰时间主要在35min以前;P50和P70组分物质出峰时间主要在35 ~ 45min。各洗脱组分对DPPH自由基的清除能力强弱顺序为:P0>P24>P15>P10>P30>P20>P70>P50,因此前6个组分显示出较强的DPPH自由基清除能力。活性组分P0、P15 和P24分别纯化得到了没食子酸、槲皮素-3-O-葡萄糖醛酸苷和l,2,3,4,6-五没食子酰基葡萄糖[8]。因此本文对活性组分P10和P20继续进行分离纯化其他组分。
2.2 组分P10和P20的分离纯化
用Toyopearl HW-40凝胶树脂继续分离成分较复杂组分P10,并选用以甲醇、蒸馏水和丙酮按不同配比的混合溶剂(比值分别为1:9:0、3:7:0、5:5:0、 7:3:0、8:1:1、6:2:2)进行洗脱,收集各亚组分并命名为PH10、PH30、PH50、PH70、PH811、PH622。接着采用分析液相方法对每个洗脱组分成分进行分析,并检测其清除DPPH自由基能力,结果如图2和图4。Toyopearl HW-40凝胶树脂对P10组分有一定的分离效果,且分离后,所得各组分峰较少,所得组分成分相对比较简单。6个亚组分的DPPH自由基清除率大小顺序为:PH50>PH811>PH70>PH622>P10>VC>PH10。亚组分的PH50比分离前组分P10、维生素C及其他组分表现更高的清除能力。根据抗氧化活性强弱,亚组分PH50和组分P20用制备液相进一步分离纯化分别得到化合物A和化合物B。
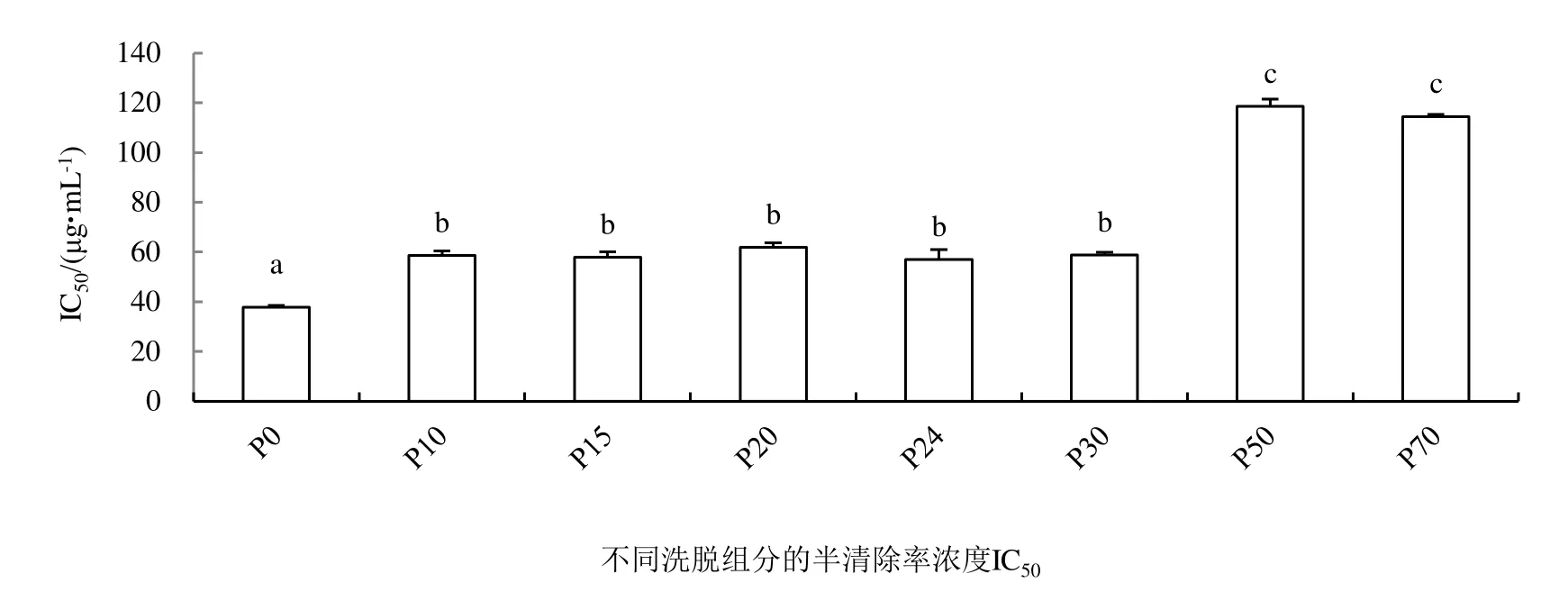
图1 乙酸乙酯萃取物不同洗脱组分的抗氧化能力以半清除率浓度IC50(μM)表示。
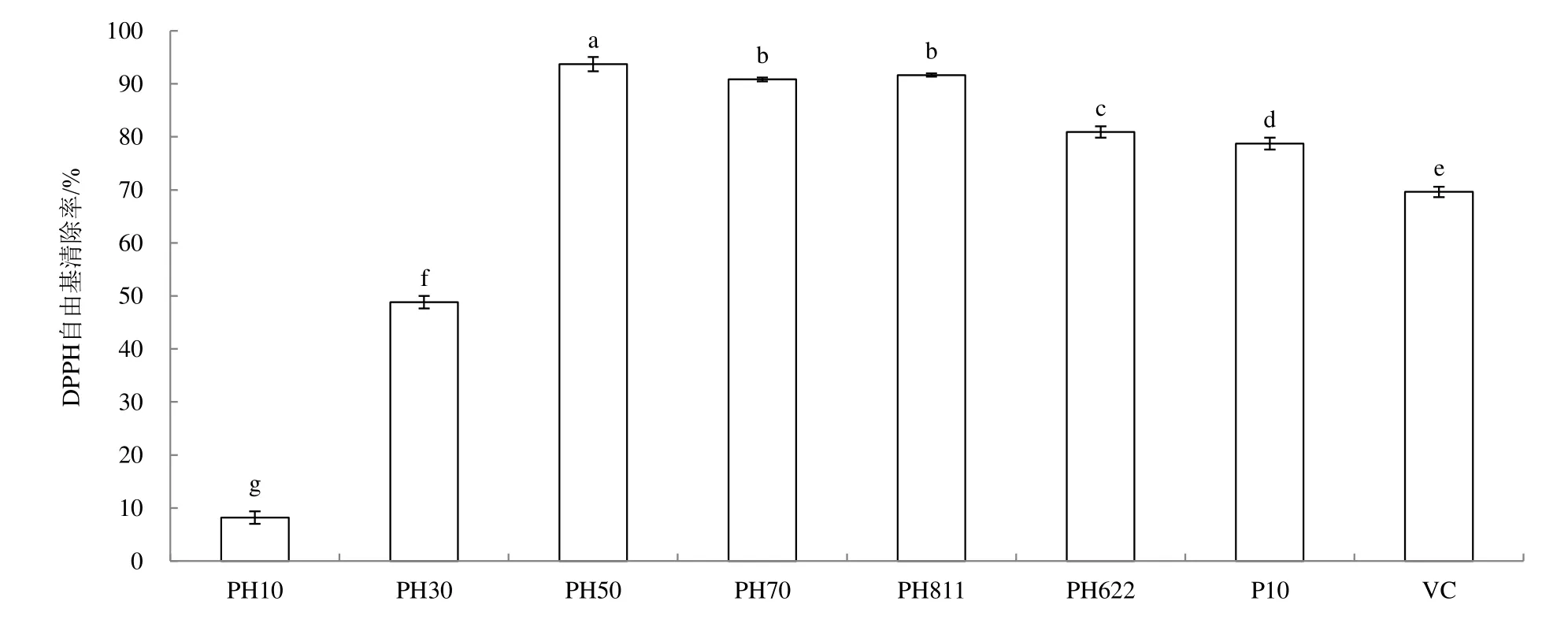
图2 活性组分P10洗脱亚组分的DPPH自由基清除率(0.1mg·mL-1)

图3 乙酸乙酯萃取物经Diaion HP-20大孔吸附树脂分离后的不同洗脱组分的液相图谱

图4 P10组分经Toyopearl HW-40凝胶树脂分离后的不同洗脱组分的液相图谱(270 nm)
2.3 化合物A 和B的结构鉴定
化合物A为红褐色油状物质。1H-NMR (600 MHz,CD3OD): δ 9.49 (1H, s, CHO), 7.49 (1H, d, J=3.6HZ, H-3), 6.65 (1H, d, J=3.6HZ, H-4), 4.64(3H, s, OCH3);13C-NMR (150 MHz,CD3OD):δ 180.8 (s, CHO), 163.0 (s, C-5), 153.2 (s, C-2), 111.6 (d, C-3), 101.2 (d, C-4), 57.3 (s, OCH3)。与文献[12]比较,化合物A被鉴定为5-甲氧基糠醛(图5),该化合物为首次从桉叶中分离得到。

图5 5-甲氧基糠醛的液相图谱和化学结构
化合物B为无定形黄色粉末。1H-NMR (600 MHz,CD3OD): δ 7.13, 7.04, 7.03, 6.94( each 2H, s, galloyl×4), 6.09 (1H, d, J=8.4HZ, glu-H-1), 5.45(1H, dd, J=8.4HZ, 9.6HZ, glu-H-2), 5.57(1H, dd, J=9.6HZ, 9.6HZ, glu-H-3), 3.97 (1H, dd, J=9.6HZ, 9.0HZ, glu-H-4), 4.01-4.04 (1H,m, glu-H-5), 4.61 (1H, dd, J=1.7HZ, 12.0HZ, glu-H-6’), 4.51 (1H, dd, J=4.2HZ, 12.0HZ, glu-H-6)。13C-NMR (150 MHz, CD3OD): δ 121.3, 121.0, 120.4, 119.8 [galloyl×4, C-1’], 110.7 (2×), 110.5 (2×), 110.4(2×), 110.2(2×) [ galloyl×4, c-2’, 6’], 146.6(2×), 146.5(2×), 146.4(2×), 146.3(2×) [galloyl×4, C-3’, 5’], 140.7, 140.2, 140.0, 139.9 [ galloyl×4, C-4’], 168.2, 167.8, 167.2, 166.4 [galloyl×4, -COO-], 93.9 (glu-C-1), 72.4 (glu-C-2), 76.5 (glu-C-3), 69.7 (glu-C-4), 76.6 (glu-C-5), 64.0 (glu-C-6)。通过对照核磁共振数据,该数据与1,2,3,6-四没食子酰葡萄糖数据基本一致(图6)[13]。
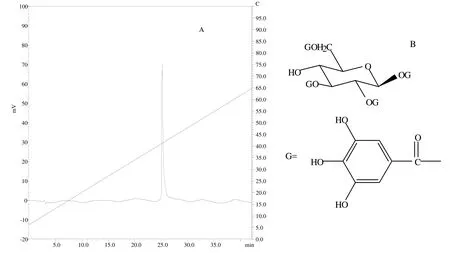
图6 1,2,3,6-四没食子酰葡萄糖液相图谱和化学结构
2.4 5-甲氧基糠醛和1,2,3,6-四没食子酰葡萄糖清除DPPH 自由基能力比较
5-甲氧基糠醛和1,2,3,6-四没食子酰葡萄糖在一定的质量浓度范围内,浓度越高,其清除率越高,抗氧化活性越强。两种化合物对DPPH自由基的半清除率浓度IC50见表1。半清除率浓度IC50越高,其抗氧化活性越低,因此5-甲氧基糠醛和1,2,3,6-四没食子酰葡萄糖两者的清除能力(IC50分别是451.9 μM)均高于对照组维生素E水溶性类似物Trolox(IC50=451.9 μM)的清除能力。与作者团队在桉叶中纯化到的化合物相比,1,2,3,6-四没食子酰葡萄糖比1,2,3,4,6-O-五没食子酰葡萄糖和特里马素Ⅱ的抗氧化活性弱,但比水杨梅丁素、特里马素Ⅰ和英国栎鞣花素的抗氧化活性强[7],因此1,2,3,6-四没食子酰葡萄糖是有较好发展前景的天然抗氧化剂。

表1 5-甲氧基糠醛和1,2,3,6-四没食子酰葡萄糖对DPPH自由基的IC50值
3 小结与讨论
(1) 刘延泽等[14]采用Dianion HP-20和Toyopearl HW-40等新型树脂反复柱层析从石榴皮中分离到安石榴林、安石榴苷、2,3-(S)-六羟基联苯二甲酰基-D-葡萄糖、石榴皮亭B和逆没食子酸五个化合物。吕洁丽等[15]报道Dianion HP-20和Toyopearl HW-40等新型树脂对鞣质及多元酚分离效果甚佳。从本研究可知,桉叶乙酸乙酯萃取物经Diaion HP-20大孔吸附树脂分离后,抗氧化活性有很大差异,从分析液相图谱可以看出,经大孔树脂分离后有很好的分离效果。而经大孔树脂分离后的组分经Toyopearl HW-40树脂分离后的组分抗氧化活性和组分成分也有很大差异,因此Dianion HP-20和Toyopearl HW-40等新型树脂对桉叶抗氧化活性物质具有很好的分离效果。对通过分离到的物质结构鉴定为鞣质及多元酚类,这也与这些树脂适合鞣质及多元酚的分离相符。
(2) 根据活性跟踪方法对桉叶抗氧化组分继续分离纯化,最终鉴定出2种抗氧化活性物质,即5-甲氧基糠醛和1,2,3,6-四没食子酰葡萄糖。其中5-甲氧基糠醛为首次从桉叶中分离得到。桉叶提取物含有丰富的抗氧化活性物质,Amakura等[16]研究了蓝桉(E.globulus)叶提取物中主要抗氧化活性物质,通过HPLC色谱比较了桉叶提取物与日本两种桉叶食品添加剂中的化学成分,确定乙酸乙酯萃取相与抗氧化食品添加剂成分相似,最后分离出18中活性单体,结构确定为多酚类,但并未分离到日本桉叶提取物添加剂的主要抗氧化成分β型二元黄酮类。Amakura等[17]从桉叶中提到分离到8种具有抗氧化活性的化合物。本团队从桉叶提取到的9种化合物均表现出抗氧化活性,特别是1,2,3,4,6-O-五没食子酰葡萄糖[8]。因此,桉叶富含大量总酚物质,可作为开发抗氧化物质的丰富和宝贵的资源。
(3) 目前,天然抗氧化剂已广泛应用于以下4个方面:①用作食品添加剂,主要的功能是防止或减慢食品发生氧化作用,提高食品的稳定性,延长货架期;②用于保健食品,主要功能是消除自由基或阻抑自由基的活动,从而起到防老抗衰、抑制肿瘤的发生、防止心脑血管疾病、增强免疫功能的作用;③用于化妆品,有防止皮肤衰老,美容养颜的作用;④用于新药品,治疗心脑血管病、抗癌等。过去由于天然抗氧化剂生产成本高,受价格低廉的合成抗氧化剂冲击,一直未商品化。随着时代的发展,人们意识到化学合成物对食品的污染,因而对天然产物的渴望越来越强烈。近十多年来,人们对茶多酚、迷迭香醚等提取工艺进行了深入的研究,相继开发出比合成抗氧化剂活性更强的天然产品。但目前能够实现工业化生产的天然抗氧化剂有天然VE、迷迭香提取物、茶多酚、甘草抗氧化物、磷脂等。在“崇尚绿色、回归自然”的21世纪,随着人们安全意识的增强,天然抗氧化剂的使用会日趋普遍。天然抗氧化剂具有很大的发展空间。本文从桉叶提取物中分离纯化鉴定出5-甲氧基糠醛和1,2,3,6-四没食子酰葡萄糖,其中1,2,3,6-四没食子酰葡萄糖比Trolox、水杨梅丁素、特里马素Ⅰ和英国栎鞣花素等抗氧化物的清除能力强,是有较好发展前景的天然抗氧化剂。因此,本文为桉叶资源的综合开发提供指导,为桉叶抗氧化物的工业化生产提取了理论基础。
[1] Lee B, Pan T. Dimerumic acid, a novel antioxidant identified from Monascus-fermented products exertschemoprotective effects: Mini review[J].Journal of Functional Foods,2013,5(1):2-9.
[2] Lai L,Chou S,Chao W.Studies on the antioxidative activities of Hsian-tsao (Mesona procumbens Hemsl) leaf gum[J]. Journal of Agricultural and Food Chemistry,2001, 49(2): 963-968.
[3] Ito N, Fukushima S,Tsuda H. Carcinogenicity andmodification of the carcinogenic response by BHA, BHT, and other antioxidants[J].CRC Critical Reviews in Toxicology,1985,15(2):109-150.
[4] Kang S,Heo S,Kim K,et al. Isolation and identification of new compound, 2, 7 ″-phloroglucinol-6, 6′-bieckol from brown algae, Ecklonia cava and its antioxidant effect[J]. Journal of Functional Foods,2012,4(1):158-166.
[5] Brooker M I H, Kleinig D A.Field guide to eucalypts (2Nd Ed.)[M]. Melbourne: bloomings books,2004.
[6] Sugimoto K, Nakagawa K, Hayashi S, et al. Hydrolyzable tannins as antioxidants in the leaf extract ofEucalyptus globuluspossessing tyrosinase and hyaluronidase inhibitory activities[J]. Food Science and Technology Research,2009,15(3):331-336.
[7] Amakura Y, Umino Y, Tsuji S, et al. Constituents and their antioxidative effects inEucalyptusleaf extract used as a natural food additive[J]. Food Chemistry, 2002, 77(1): 47-56.
[8] Chen Y, Wang J, Oua Y, et al. Cellular antioxidant activities of polyphenols isolated fromEucalyptusleaves(Eucalyptus grandis× Eucalyptus urophyllaGL9)[J]. Journal of Functional Food, 2014, 7: 737-745.
[9] Chen Y,Onken B, Chen H,et al. Mechanism of longevity extension of Caenorhabditis elegans induced by pentagalloyl glucose isolated fromEucalyptusleaves[J]. Journal of Agricultural and Food Chemistry,2014, 62(15): 3422-3431.
[10] 王俊亮,肖苏尧,陈运娇,等.广林9号桉叶多酚抗氧化活性研究[J].食品科学,2012,33(1):20-24.
[11] Kumaran A,Joel Karunakaran R. Antioxidant and free radical scavenging activity of an aqueous extract ofColeus aromaticus[J]. Food Chemistry,2006,97(1):109-114.
[12] Cui H H, Gao Y H,Cai H F,etal. Study on Chemical Constituents of Citrusmedica var.sarcodactylisfrom Sichuan Province (Ⅱ)(In Chinese)[J].Traditional Chinese Drug Research & Clinical Pharmacology,2009,20(4):344 -347.
[13] Amakura Y,Yoshimura M,Sugimoto N,et al. Marker constituents of the natural antioxidant Eucalyptus leaf extract for the evaluation of food additives[J]. Bioscience, Biotechnology, and Biochemistry,2009,73(5): 1060-1065.
[14] 刘延泽,李海霞. 石榴皮中的鞣质及多元酚类成分[J].中草药,2007, 38(4): 502-504.
[15] 吕洁丽,杨中汉,袁珂. 新型凝胶树脂及大孔吸附树脂在中草药成分分离纯化中的应用[J].中药材,2005,28(3): 239-242.
[16] Amakura Y,Yoshimura M,Sugimoto N,et al. Marker constituents of the natural antioxidant Eucalyptus leaf extract for the evaluation of food additives[J]. Bioscience, Biotechnology, and Biochemistry,2009,73(5):1060-1065.
[17] Amakura Y,Umino Y,Tsuji S,et al. Constituents and their antioxidative effects inEucalyptusleaf extract used as a natural food additive[J].Food Chemistry,2002,77(1):47-56..
The Isolation and Purification of Compounds fromEucalyptusLeaves and Their Antioxidant Activity
CHEN Yun-jiao1,2, LI Wei1,2, CHEN Hong-zhang1,2,WANG Jun-liang1,2, CAO Yong1,2
(1.College of Food Science,South China Agricultural University,Guangzhou510642,Guangdong,China; 2.Guangdong Province Engineering Research Center for Bioactive Natural Products,Guangzhou510642,Guangdong,China)
An activity-guided isolation process was conducted to identify the composition of extracts from leaves ofEucalyptusgrandis×E.urophyllaclone GL9. The compounds 5-methoxyfurfural and 1,2,3,6-tetra-O-galloyl-β-D-glucose (TGG) were isolated and identified by Diaion HP-20, Toyopearl HW-40 column chromatography, repeated preparative HPLC and NMR, and 5-methoxyfurfural was isolated fromEucalyptusleaves for the first time. Both compounds showed higher DPPH free radical scavenging ability than trolox, especially for TGG. The study has a very important theoretical role for guiding exploitation ofEucalyptusleaves as sources of valuable antioxidant compounds.
Eucalyptusleaves;DPPH free radical scavenging ability;1,2,3,6-tetra-O-galloyl-β-D-glucose
TS201
A
广东省自然科学基金博士启动项目(2015A030310118);广东省自然科学基金自由申请项目(2016A030313394);广东省教育厅科研项目(平台)(2013gjhz0003)
陈运娇(1984— ),女,讲师,主要从事天然活性物分离纯化与抗氧化、抗衰老活性及其机制研究.E-mail: yunjiaochen@scau.edu.cn
*通讯作者:曹庸(1966— ),男,博士,教授,主要从事天然活性物质提取、分离、鉴定及活性评价研究.E-mail: caoyong2181@scau.edu.cn

