花芸豆多肽提取工艺的研究
张 静,陈浩然,王笑颖,成毓凇,潘 磊,李 良
(东北农业大学食品学院,黑龙江哈尔滨 150030)
花芸豆多肽提取工艺的研究
张 静,陈浩然,王笑颖,成毓凇,潘 磊,李 良*
(东北农业大学食品学院,黑龙江哈尔滨 150030)
研究以花芸豆为原料,用碱性蛋白酶水解制备花芸豆多肽,在单因素实验的基础之上,通过正交实验对酶解温度、酶解时间、pH、加酶量等酶解条件进行优化。结果表明:制备花芸豆多肽的最佳工艺条件:酶解温度60 ℃、酶解时间4 h、加酶量2000 U/g、pH为7.5,此条件下花芸豆多肽浓度为0.915 mg/mL。本文提供了一种花芸豆多肽的提取方法,旨在为今后花芸豆多肽的深度开发利用奠定基础。
花芸豆,碱性蛋白酶,多肽浓度
花芸豆(PhaseolusVulgarisLinn. sp)属豆科菜豆属一年生草本植物,其生物学名叫菜豆。芸豆品种多,营养也较丰富,据测定,每百克芸豆含蛋白质23.1 g、脂肪1.3 g、碳水化合物56.9 g、钙76 mg及丰富的B族维生素,可作为粮豆配合开发新营养主食品种的原料[1-2]。芸豆中含有大量对人体有益的生物活性物质,其中多肽具有降血压、降血脂、活化细胞免疫机能、改善心血管功能和抗氧化等生理活性,是现代食品和医药领域最热门的研究方向和极具发展前景的功能因子[3-6]。目前对于大豆、花生、大麦、魔芋、核桃等原料多肽的制备工艺和功能性进行了研究研究较多,余勃[7]等人对微生物法生产大豆多肽的工艺进行了研究,确定了微生物法生产大豆多肽的工艺条件;赵珮[8]等人对大麦多肽的提取工艺及抗氧化活性进行了研究;王端[9]等人以核桃脱脂粉为原料,利用酶解法提取制备核桃多肽,确定了酶解法提取核桃多肽的最佳工艺条件;吕婧[10]等人研究了利用米曲霉和枯草芽孢杆菌共生发酵魔芋飞粉制备魔芋多肽的方法;周婷婷[11]等人筛选制备抗氧化大豆多肽的水解酶及水解条件,从而得到高效的抗氧化大豆多肽制品;刘英丽[12]等人研究确定了酶解花生粕制备抗氧化肽的最佳工艺参数。目前国内对于花芸豆的研究主要集中在花芸豆的开发应用,而对花芸豆中蛋白质的研究较少,特别是花芸豆多肽的研究仍处于空白阶段,故有很大的研究空间。本文建立了一种花芸豆多肽的提取方法,以花芸豆为原料,用碱性蛋白酶水解,研究酶解温度、酶解时间、pH、加酶量对花芸豆多肽提取影响,通过单因素实验和正交实验,确定了花芸豆多肽制备的最佳酶解工艺条件,旨在为花芸豆多肽制备提供实验依据,为花芸豆多肽的深度开发利用奠定基础。
1 材料与方法
1.1 材料与仪器
花芸豆 购自北大荒集团;盐酸 哈尔滨理工化学试剂有限公司;石油醚 天津市天力化学试剂有限公司;氢氧化钠 天津市天力化学试剂有限公司;CuSO4·5H2O 天津市天力化学试剂有限公司;三氯乙酸 天津市凯通化学试剂有限公司;碱性蛋白酶(180000 U/mL) 诺维信生物科技有限公司;Gly-Gly-Tyr-Arg Sigma公司。
上海万能粉碎机 浙江屹立工贸有限公司;TU-1800型紫外可见光光度计 北京普析通用仪器有限责任公司;高速离心机 北京恒奥生物科技有限公司;pH剂 上海仪电科学仪器股份有限公司;HH-4数显搅拌水浴锅 常州国华电器有限公司;漩涡混合仪 德国IKA公司;DHG-9240A型电热恒温鼓风干燥箱 上海一恒科技有限公司。
1.2 实验方法
1.2.1 标准曲线的绘制 取6个5 mL的容量瓶,用5%的TCA(三氯乙酸)依次配制0.0、0.2、0.4、0.6、0.8、1.0 mg/mL的 Gly-Gly-Tyr-Arg 四肽标准溶液,然后从容量瓶中分别取4.5 mL标准溶液,并加入3.0 mL双缩脲试剂,在漩涡混合仪上混合均匀,静止放置10 min,2000 r/min离心10 min,取上清液于540 nm下测定OD值(以第一管做空白对照)。以肽的浓度为横坐标X(mg/mL),OD值为纵坐标Y,制作标准曲线[13]。
1.2.2 原料预处理 芸豆用粉碎机进行充分碾磨,然后将磨好的芸豆粉末过40目筛,过筛后的芸豆再经过30~60 ℃石油醚脱脂过程,将脱脂后的芸豆干燥密封保存。
1.2.3 蛋白酶解液的制取 取脱脂后的芸豆粉,将芸豆粉与水1∶1比例用组织匀浆机匀浆1 min,配成质量分数10%的芸豆悬浮液,在温度50 ℃、pH8.0、加酶量2000 U/g的条件下酶解2 h,酶解完毕后90 ℃水浴灭酶10 min,4000 r/min离心15 min,去除芸豆渣与悬浮物即为酶解液。
1.2.4 芸豆蛋白沉淀工艺 取2.5 mL酶解液,加入2.5 mL 10%(W/V)的三氯乙酸(TCA)水溶液,于漩涡混合仪上混合均匀,静止放置10 min,然后在4000 r/min下离心15 min,将上清液全部转移到50 mL容量瓶中,并用5%的TCA定容至刻度,摇匀。
1.2.5 多肽含量的测定 取经过稀释到适宜浓度的上清液2.5 mL,加入同样体积的10%的TCA试剂(称取10 g的三氯乙酸,用适宜的蒸馏水溶解后定容到100 mL),静置10 min后,4000 r/min离心15 min,取1 mL上清液,并加入4 mL的双缩脲试剂(称取1.5 g硫酸铜、6.0 g酒石酸钠和1.0 g碘化钾溶于适量的蒸馏水中,并一边搅拌一边加入300 mL氢氧化钠溶液,最后用蒸馏水定容到1000 mL),混匀后静置10 min,2000 r/min离心10 min,540 nm测定溶液的吸光值,根据Gly-Gly-Tyr-Arg四肽标准曲线与实时在540 nm下测量的吸光度值,对照标准曲线求得样品溶液中的多肽浓度C(mg/mL)[13]。
1.2.6 酶解反应影响多肽含量测定的单因素实验
1.2.6.1 酶解时间 取6支试管,于每一支试管中均加入4.0 mL上述芸豆悬浮液,将1~5号试管分别于室温下放置1、2、3、4、5 h,0号试管设置为0 h,作为空白对照,相同pH下加相同酶量,重复上述实验步骤,依次按标准程序测定OD值,平行测定一次。
1.2.6.2 酶解温度 取6支试管,于每一支试管中均加入4.0 mL上述芸豆悬浮液,将1~5号试管pH相同情况下分别于30、40、50、60、70 ℃下进行加热处理,0号试管不进行加热处理,在相同的时间下加相同酶量,重复上述实验步骤,依次按标准程序测定OD值,平行测定一次。
1.2.6.3 酶解pH 取6支试管,于每一支试管中均加入4.0 mL上述芸豆悬浮液,将1~5号试管分别于室温下pH按7、7.5、8、8.5、9配制,0号试管不进行处理,在相同时间下加相同酶量,重复上述实验步骤,依次按标准程序测定OD值,平行测定一次。
1.2.6.4 加酶量 取6支试管,于每一支试管中均加入4.0 mL上述芸豆悬浮液,将1~5号试管于室温下加入酶量分别为1000、2000、3000、4000、5000 U/g,0号试管不加酶,pH相同的条件下加相同酶量,重复上述实验步骤,依次按标准程序测定OD值,平行测定一次。
1.2.7 正交实验 正交实验方案及酶解时间、酶解温度、pH、加酶量对花芸豆多肽提取的影响见表1。
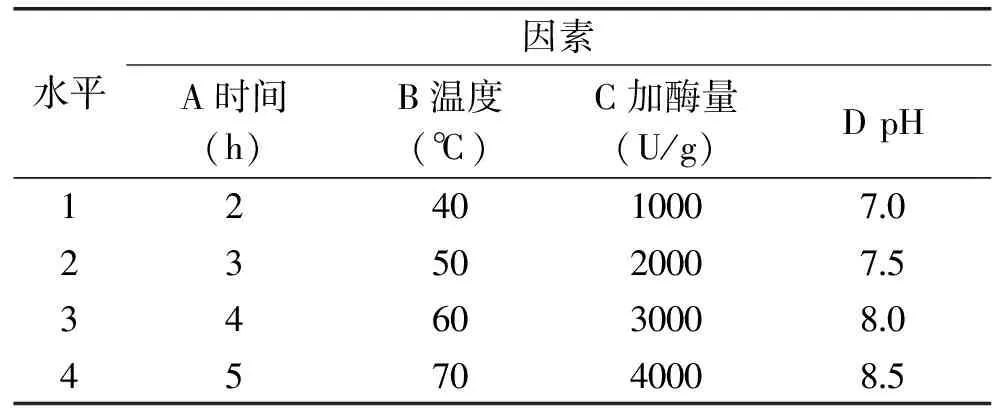
表1 L16(44)正交实验因素水平表
1.3 数据处理
利用OriginPro 9.1软件进行数据处理。
2 结果与讨论
2.1 Gly-Gly-Tyr-Arg四肽标准曲线
以 Gly-Gly-Tyr-Arg四肽的浓度作为横坐标X(mg/mL),OD值作为纵坐标Y,制作标准曲线。从而得到回归方程y=0.1277x-0.0015,R2=0.9979。
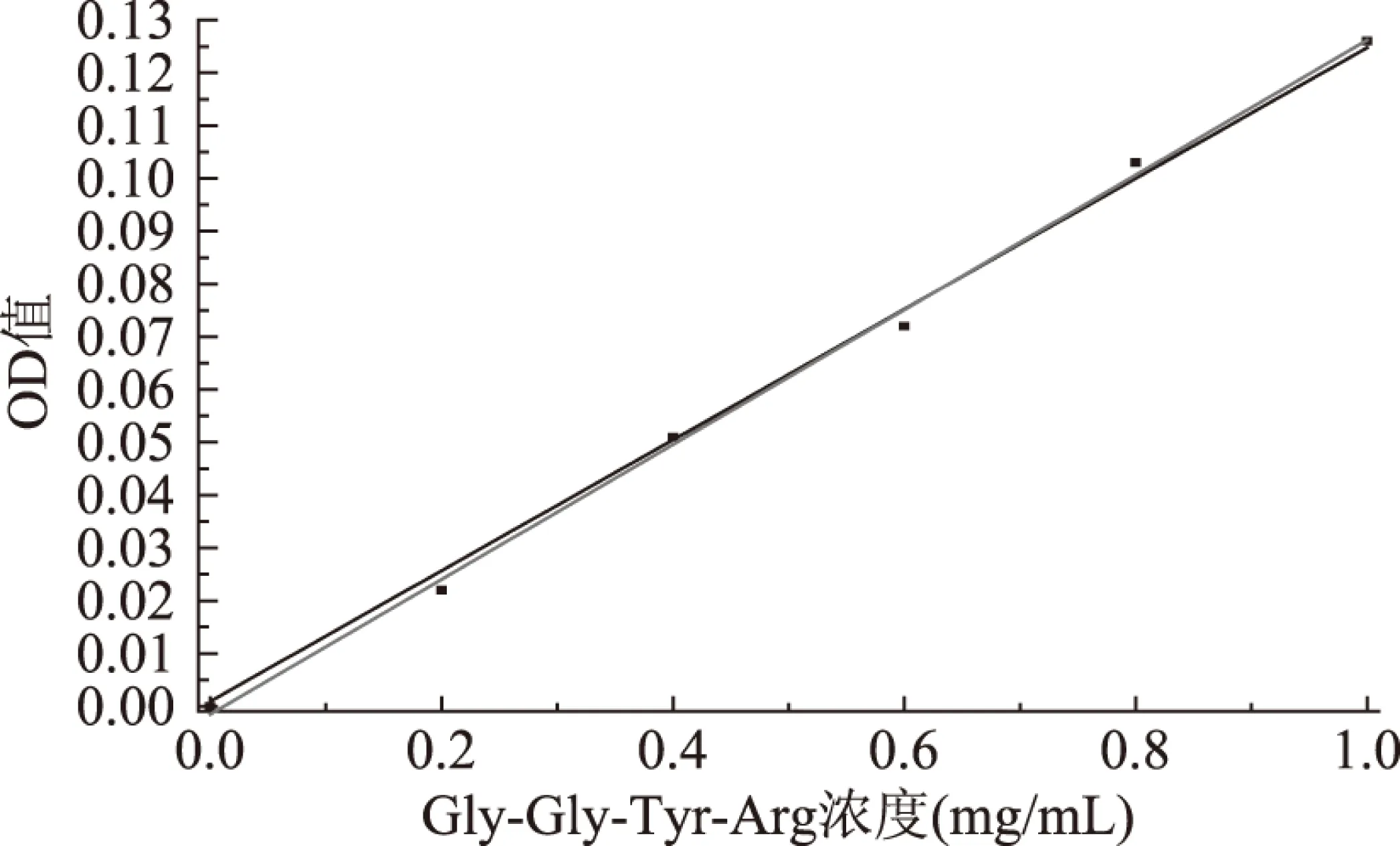
图1 Gly-Gly-Tyr-Arg四肽标准曲线Fig.1 The standard curve of Gly-Gly-Tyr-Arg
2.2 酶解反应因素对多肽含量测定的影响
2.2.1 酶解时间对花芸豆多肽含量测定的影响 由图2可知,酶解时间在1~4 h内,随着酶解时间的增加,花芸豆多肽的提取率逐步增加,这是由于在反应的初始阶段底物浓度大,碱性蛋白酶的活力最强,能够充分结合底物蛋白,酶的作用位点多,所以随着酶解时间的增加,花芸豆多肽的浓度逐步增加[14];当酶解时间超过4 h时,可能是随着酶解时间的延长,蛋白底物的浓度逐渐下降,酶和底物的结合位点也随之减少,同时酶活力也随之降低,反应越来越慢[15],而且由于水解时间过长,制备的多肽开始被碱性蛋白酶酶解成单个的氨基酸,造成多肽含量有所下降[16]。所以在其他因素不变的条件下,酶解时间在4 h时提取效果最佳。

图2 酶解时间对花芸豆多肽含量的影响Fig.2 Effect of Enzymolysis Time on peptide yield of Phaseolus vulgaris Linn
2.2.2 酶解温度对花芸豆多肽含量测定的影响 由图3可知,酶解温度在30~40 ℃时,由于温度过低,碱性蛋白酶活性受到抑制,酶解速率较慢,多肽生成曲线较缓;当温度继续升高,温度逐渐接近碱性蛋白酶作用的最适温度,所以酶解速率加快,多肽的提取率也逐渐升高;酶解温度在60 ℃时,体系温度达到碱性蛋白酶的最适温度,蛋白质的酶解率达到最大值;60 ℃之后随着温度的升高,多肽的提取率逐渐下降,这是因为较高的酶解温度破坏了维持酶分子结构的次级键,使蛋白酶结构发生改变,导致酶变性,从而使蛋白酶的活性减弱或丧失,使多肽的提取率降低[17-18]。所以在其他因素不变的条件下,温度在60 ℃时提取效果最佳。

图3 酶解温度对花芸豆多肽含量的影响Fig.3 Effect of Enzymolysis Temperature on peptide yield of Phaseolus vulgaris Linn
2.2.3 酶解pH对花芸豆多肽含量测定的影响 由图4可知,在pH在7.0~8.0内,随着pH的递增,花芸豆多肽的提取率不断增加,这是由于在初始阶段,随着pH的增大,体系pH越来越接近蛋白质酶的最适pH,所以多肽浓度不断增大;当酶解pH达到8.0时,体系pH达到碱性蛋白酶的最适pH,蛋白质的酶解率达到最大值;随着pH继续增加,蛋白质的酶解程度逐渐下降,这是由于pH会影响酶与底物的结合情况,pH较高时会影响酶蛋白的构象和酶分子的解离状态,使蛋白酶的活性降低,从而影响蛋白酶的催化效果,造成花芸豆多肽的提取率不断下降[19-20]。所以在其他因素不变的条件下,pH为8.0时提取效果最佳。

图4 酶解pH对花芸豆多肽含量的影响Fig.4 Effect of pH on peptide yield of Phaseolus vulgaris Linn
2.2.4 加酶量对花芸豆多肽含量测定的影响 由图5可知,体系加酶量在1000~2000 U/g内,在随着加酶量的递增,蛋白质酶解率增大,这是因为反应初始阶段酶浓度较低,底物过量,酶与底物完全结合,随着加酶量的增大,反应速率随之加快,水解程度增大[14];当加酶量达到2000 U/g时,蛋白质的酶解率达到最大值;随着酶量的继续增加,蛋白质的酶解程度逐渐下降。这是因为当酶浓度较高时,蛋白质相对浓度较低,底物分子能与酶分子完全结合,酶分子处于过饱和状态,有一部分没机会与蛋白质结合,因而继续增加蛋白酶的用量也不会加快水解速率[21]。所以水解程度变化不大。所以在其他因素不变的条件下,加酶量为2000 U/g时提取效果最佳。

图5 加酶量对花芸豆多肽含量的影响Fig.5 Effect of Alcalase dosage on peptide yield of Phaseolus vulgaris Linn
2.3 正交实验
正交实验结果见表2和表3。
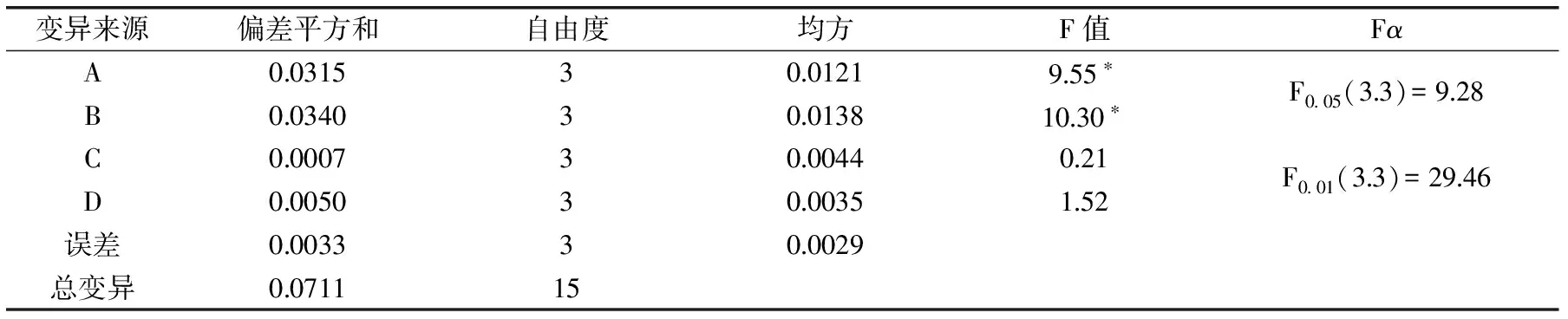
表3 正交实验结果方差分析
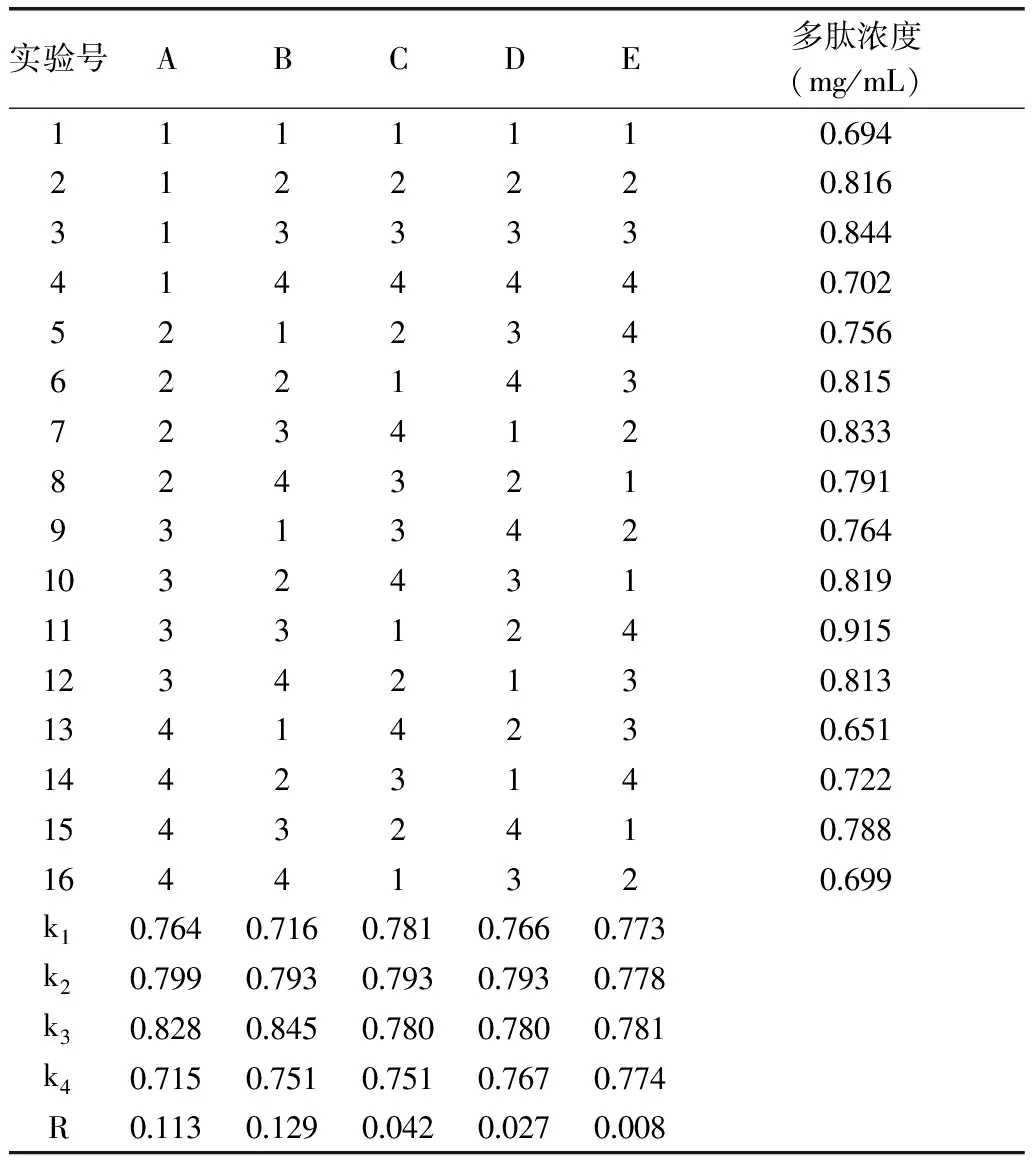
表2 L16(44)正交实验设计和结果极差分析
由表2、表3可以看出酶解时间和酶解温度对花芸豆多肽提取的影响达到显著水平(p<0.05),各因素对多肽提取量的影响主次顺序为酶解温度>酶解时间>加酶量>pH,最佳组合为A3B3C2D2,按A3B3C2D2条件进行3次平行实验,花芸豆多肽浓度平均值为0.954 mg/mL,高于表2中的正交实验最优结果,故A3B3C2D2为最佳提取条件。即酶解时间为4 h,酶解温度为60 ℃,加酶量为2000 U/g,pH7.5,多肽含量为0.915 mg/mL。
3 结论
本文研究了酶解温度、酶解时间、pH和加酶量对花芸豆提取多肽的影响。通过显著性实验,各因素的影响顺序为:酶解温度>酶解时间>加酶量>pH。通过单因素实验及正交实验优化确定花芸豆多肽的最佳提取条件为:酶解温度60 ℃、酶解时间4 h、加酶量为2000 U/g、酶解pH7.5。在此条件下酶解蛋白质的效果最好,产生的多肽量最多,多肽浓度为0.915 mg/mL。本文提供了一种花芸豆多肽的提取方法,旨在为花芸豆多肽制备提供实验依据,为花芸豆多肽的深度开发利用奠定基础。
[1]何照范. 粮油籽粒品质及其分析[M]. 北京:中国农业出版社,1985.
[2]张根旺,孙芸. 食用豆类资源的开发利用[J]. 中国商办工业,2001(1):5-13.
[3]孔令明,李芳,陶永霞,等. 多肽的功能活性与研究进展[J]. 中国食品添加剂,2009,71(03):71-73.
[4]王树华,王树祥,王均. 抓紧发展生物活性肽[J]. 化工管理,2004(5):25-27.
[5]Byun HG,Kim SK. Purification and characterization of angiotensin I converting enzyme(ACE)inhibitory peptides from Alaska pollack(Theragra chalcogramma)skin[J]. Process Biochemistry,2001(36):1155-1162.
[6]Nooshin AP,Eunice CY,Li Chan. Comparison of protein surface hydrophobicity measured at various pH values us-ing three different fluorescent probes[J]. Journal of Agricultural and Food Chemistry,2000(48):328-334.
[7]余勃,陆兆新. 发酵豆粕生产大豆多肽研究[J]. 食品科学,2007,28(2):189-192.
[8]赵珮,赵宁,何佳洋,等. 大麦多肽的提取工艺优化及其抗氧化活性初探[J].食品工业科技,2014,35(15):215-219.
[9]王端,周鸿翔,王晓丹,等. 响应面法优化酶解核桃多肽提取工艺[J]. 2015,36(15):19-22.
[10]吕婧,毛跟年,张轲易,等. 发酵法制备魔芋多肽工艺研究[J]. 2014,35(11):118-121.
[11]周婷婷,李燕,宋斐. 抗氧化大豆多肽制备的研究[J].食品工艺科技,2010,31(03):281-284.
[12]刘英丽,张慧娟,王静,等. 酶解花生粕制备抗氧化肽工艺研究[J]. 中国食品学报,2014,14(8):62-67.
[13]鲁伟,任国谱,宋俊梅. 蛋白水解液中多肽含量的测定方法[J]. 食品科学,2005,26(7):169-171.
[14]喻峰,熊华,吕培蕾,等. 核桃粕酶解工艺研究[J]. 食品与发酵工业,2006,32(5):89-91.
[15]范三红,胡雅喃,何亚. 响应面法优化菊芋渣酶解制备抗氧化肽工艺[J]. 食品科学,2015,36(8):49-53.
[16]王永刚,任海伟,马建忠,等. 芸豆蛋白酶解工艺的研究[J]. 食品工业科技,2010,31(4):283-285.
[17]訾艳,王常青,陈晓萌,等. 具有α-淀粉酶抑制活性的白芸豆多肽的制备及其热稳定性研究[J]. 食品科学,2015,36(13):190-195.
[18]梁永飞,余玲,余青,等. 棉籽多肽的制备及其自由基清除能力研究[J]. 中国油脂. 2014,39(2):24-27
[19]张强,阚国仕,陈红漫,等. 酶解玉米蛋白粉制备抗氧化肽[J]. 食品工业科技,2005,26(6):109-111.
[20]姜锡瑞. 酶制剂应用手册[M]. 北京:中国轻工业出版社,1999:232-241.
[21]孟欢,罗儒显. 木瓜蛋白酶水解明胶制备多肽的工艺研究[J]. 广东化工,2010,37(1):36-38.
Study on extraction technology of Polypeptide fromPhaseolusVulgaris
ZHANG Jing,CHEN Hao-ran,WANG Xiao-ying,CHENG Yu-song,PAN Lei,LI Liang*
(College of Food Science,Northeast Agricultural University,Harbin 150030,China)
In this paper,takingPhaseolusVulgarisas row material,alkaline protease hydrolysis was used to prepare coloured kidney bean polypeptide. Enzymolysis conditions such as enzymolysis temperature,enzymolysis time,pH value and enzyme dosage were optimized by means of designing orthogonal experiments. The results showed that the optimum conditions are as follows:temperature 60 ℃,enzymolysis time 4 h,pH7.5,enzyme dosage 2000 U/g. Under this condition,the concentration of polypeptides inPhaseolusVulgariswas 0.915 mg/mL. This paper proposes a method for extracting polypeptides fromPhaseolusVulgaris,and aims to lay a foundation for further exploration and utilization of polypeptides fromPhaseolusVulgarisin future.
PhaseolusVulgaris;alkaline protease;concentration of polypeptides
2016-05-24
张静(1995-),女,本科生,研究方向:粮食工程,E-mail:1318767115@qq.com。
*通讯作者:李良(1981-),男,博士,副教授,研究方向:农产品精深加工,E-mail:liliangneau@163.com。
东北农业大学大学生SIPT创新训练资助项目(2015)。
TS201.2
A
1002-0306(2016)24-0000-00
10.13386/j.issn1002-0306.2016.24.000

