15种青藏高原植物提取物对几种常见微生物的抑制作用研究
张 忠,李科玮,毕 阳,王 毅,任亚琳
(甘肃农业大学食品科学与工程学院,甘肃兰州 730070)
15种青藏高原植物提取物对几种常见微生物的抑制作用研究
张 忠,李科玮,毕 阳*,王 毅,任亚琳
(甘肃农业大学食品科学与工程学院,甘肃兰州 730070)
为研究青藏高原植物提取物对几种常见微生物的抑制效果,本文采用琼脂孔扩散法和96孔培养板对倍稀释法研究了15种高原植物提取物对4种真菌和4种细菌的体外抑菌率和最低抑菌浓度。结果显示:各种植物提取物具有不同的抑菌谱和最小抑制浓度,其中黄腺香青、刺柏、塞北紫芹、龙胆花、苔草的提取物至少对4种供试菌有抑制作用;苔草的三种提取物对金黄色葡萄球菌、大肠杆菌与荧光假单孢菌的最低抑菌浓度为0.05 g/mL;大部分提取物对细菌的抑制效果优于对真菌的抑制效果。结果表明生长于青藏高原独特生态条件下的许多植物,其代谢物在体外具有较强的抑菌活性和较广的抑菌谱。
青藏高原植物,琼脂孔扩散法,最小抑制浓度,食源性致病菌
化学合成杀菌剂的使用是目前用于防止疾病传播,食品防腐和果蔬采后病害控制的首要措施[1]。病原菌对现有杀菌剂的抗性,环境污染以及因消费不安全食品而造成的健康问题和消费者对食品品质安全性要求的日益提高,使人们开始寻找现有控制措施的互补或替代措施[2-8]。天然抗菌物质既能延长食品的可利用时间,同时又能避免因腐败微生物的酶系或代谢所产生的营养健康与品质安全等方面产生的问题[9]。许多具有抗菌活性的植物提取物如植物精油和多酚类引起了相关研究学者的兴趣[10-12]。在寻找新的天然活性物质时,一些独特生态体系的植物被关注[13];已有研究从一些欠探索的生态体系中发掘出有价值的活性物质,生长于独特生态环境中的生物资源将成为研究和寻找天然活性物质的热点[14-17]。本研究用石油醚、氯仿、乙酸乙酯、丙酮和甲醇5种溶剂逐级分别提取15种高原植物中的抑菌物质,并测定各种提取物对4种果蔬采后致病真菌与4种常见食源性致病菌的体外抑制效果,以为天然植物源抑菌剂的开发提供理论依据。
1 材料与方法
1.1 材料与仪器
供试植物 15种供试植物(表1)均采自青海省化隆县,由本校林学院植物分类学孙学刚教授鉴定后阴干、粉碎后用PE袋(17 cm×12 cm)包装4 ℃保存,供试植物的选择基于两点:生长在较高的海拔区域,在当地民间有抑菌消炎的用途;供试金黄色葡萄球菌(Staphylococcusaureus),大肠杆菌(Escherichiacoli),枯草芽孢杆菌(Bacillussubtilis),荧光假单孢菌(Pseudomonasfluorescence),扩展青霉(Penicilliumexpansum)由广东微生物研究所购得并在本院采后生物学实验室保藏。互格交链孢菌(Alternariaalternate),半裸镰刀菌(Fusariumsemitectum),粉红单端孢菌(Trichotheciumroseum) 由本院采后生物学实验室从发病果实分离保藏;所用石油醚、氯仿、乙酸乙酯、丙酮、甲醇、二甲亚砜(DMSO) 均为上海化学试剂有限公司所产,分析纯级。
索氏抽提仪 临沂正衡化玻仪器有限公司;96孔培养板 美国BD公司;PYX-DHS 600-BS-11型恒温培养箱 上海龙跃仪器设备有限公司。

表1 供试高原植物及分类信息
1.2 实验方法
1.2.1 样品提取液制备 采用吴文君[18]索氏抽提连续法进行活性成分提取,各供试植物样称取50 g粉末,用滤纸包好装入索氏抽提仪依次用石油醚、氯仿、乙酸乙酯、丙酮、甲醇进行连续提取,提取液分别标记为PE、CE、EE、AE和ME,各提取液过滤,并在35~45 ℃温度范围内减压浓缩至50 mL,制备成1 g/mL的原液,放置4 ℃冰箱内备用。
1.2.2 菌悬浮液制备 真菌悬浮液制备参照Bi的方法[19],取25 ℃下培养10 d的带菌马铃薯琼脂培养基(PDA)平皿一个,加入含0.05% Tween 20的无菌水约10 mL,用玻璃棒刮下平板上的病原菌孢子,然后转入50 mL三角瓶中,在WYX-A微型旋涡混合器上振荡15 s,再用双层纱布过滤,滤液用血球计数板计数算出孢子悬浮液的浓度后,最后稀释至106CFU/mL。细菌菌悬液的制备采用平板菌落计数法[20],将供试细菌用接种环接入到50 mL无菌水中,充分振荡30 min后二倍稀释菌悬液,吸取标记10-4、10-5、10-6菌悬液各200 μL,对号放入无菌平皿中并用涂布器来回涂匀后转入37 ℃恒温培养箱中培养48 h,选择最合适平皿计数,并根据公式(1)计算出每毫升菌悬液中菌落的形成单位。
每毫升中菌落形成单位(CFU/mL)=菌落数×稀释倍数×5
式(1)
1.2.3 琼脂孔扩散法抑菌活性测定 参照Cakir的方法[21]并修改。将高压灭菌的琼脂培养基(细菌用牛肉膏蛋白胨培养基,霉菌用PDA培养基)趁液态倒入干燥灭菌的直径9 cm培养皿内,厚度约为2 mm,待培养基冷凝后,加入0.1 mL菌悬液并加入少量DMSO,均匀涂布平板,然后用无菌金属打孔器(d=6 mm)打成深2 mm的小孔1个,用无菌牙签除去孔内琼脂,并用移液枪吸取一滴琼脂溶液封底。分别吸取不同的溶剂提取物0.2 mL加入孔内,并用各自的提取溶剂作空白对照。以上操作均在无菌条件下进行。然后将培养皿置于恒温培养箱中培养(细菌置于37 ℃恒温培养箱中培养24~48 h,霉菌置于28 ℃的恒温培养箱中培养48~96 h)。后用十字交叉法测量抑菌圈直径,以平均值代表菌落的大小,根据公式2计算抑菌率。
抑菌率(%)=(处理抑菌圈直径-CK直径)/处理抑菌圈直径×100
式(2)
1.2.4 最低抑菌浓度测定(MIC) 采用Eloff法[22]并略做修改,采用5%(v/v)DMSO对各提取原液进行系列二倍稀释,96孔培养板紫外照射10 min后每孔加入100 μL查氏培养基(真菌)和牛肉膏蛋白胨培养基(细菌),再加入100 μL的系列稀释液和20 μL的菌悬液,各浓度设3个平行,最后一列作为对照加入5%(v/v)DMSO。各孔加入0.5 mg/mL的MTT 20 μL作为指示剂,盖好培养板并在28 ℃(细菌37 ℃)温度下培养24~48 h,观察指示剂颜色变化并记录最低抑菌浓度。
1.2.5 数据处理 每个实验重复3次,全部实验数据用DPS 7.55数据处理系统进行处理求平均值。
2 结果与讨论
2.1 抑菌活性
供试15种高原植物不同提取物对4种真菌和4种细菌的抑菌谱和抑菌活性强弱表现出很大差异(表2),在分类上同科的两种植物其抑菌谱和抑菌活性也无相似性。
在15种供试植物的75(15×5)种提取物对8种供试菌的琼脂孔扩散入法抑菌率测定实验中,互格交链孢对6种提取物敏感,其中香薷的甲醇提取物和铁棒锤的甲醇提取物在实验条件下对其有57%的抑菌率。粉红单端孢在整体上对各种提取物具有较强的抗性,其中仅有3种提取物对粉红单端孢具有抑菌活性;砂珍棘豆的乙酸乙酯提取物在实验条件对其有60%的抑菌率。有11种提取物对扩展青霉有抑制效果,刺柏的乙酸乙酯提取物对其有68%的抑制率。有20种提取物对半裸镰刀菌有抑制效果,其中有三种提取物的抑菌率达67%。有18种提取物对金黄色葡萄糖球菌有抑制效果,苔草的甲醇提取物对其的抑制率为71%。大肠杆菌对8种提取物敏感,其中黄腺香青的石油醚提取物对其的抑制率高达73%。有12种提取物对枯草芽孢杆菌有抑制效果,黄腺香青的石油醚提取物对其的抑制率也高达71%。而荧光假单孢对各种提取物的敏感性最强,有54种提取物对其有不同强度的抑制效果。其中抑菌率最高的为刺柏的乙酸乙酯提取物,在实验条件下达到73%的抑菌率。整体上各种提取物对细菌的抑菌效果强于对真菌的抑菌效果。从植物提取物的抑菌谱方面来分析,苔草、黄腺香青和刺柏的提取物各对5种菌具有抑制效果。唐古特乌头与铁棒锤同属毛莨科,同科植物间提取物的抑菌谱没有相似性。
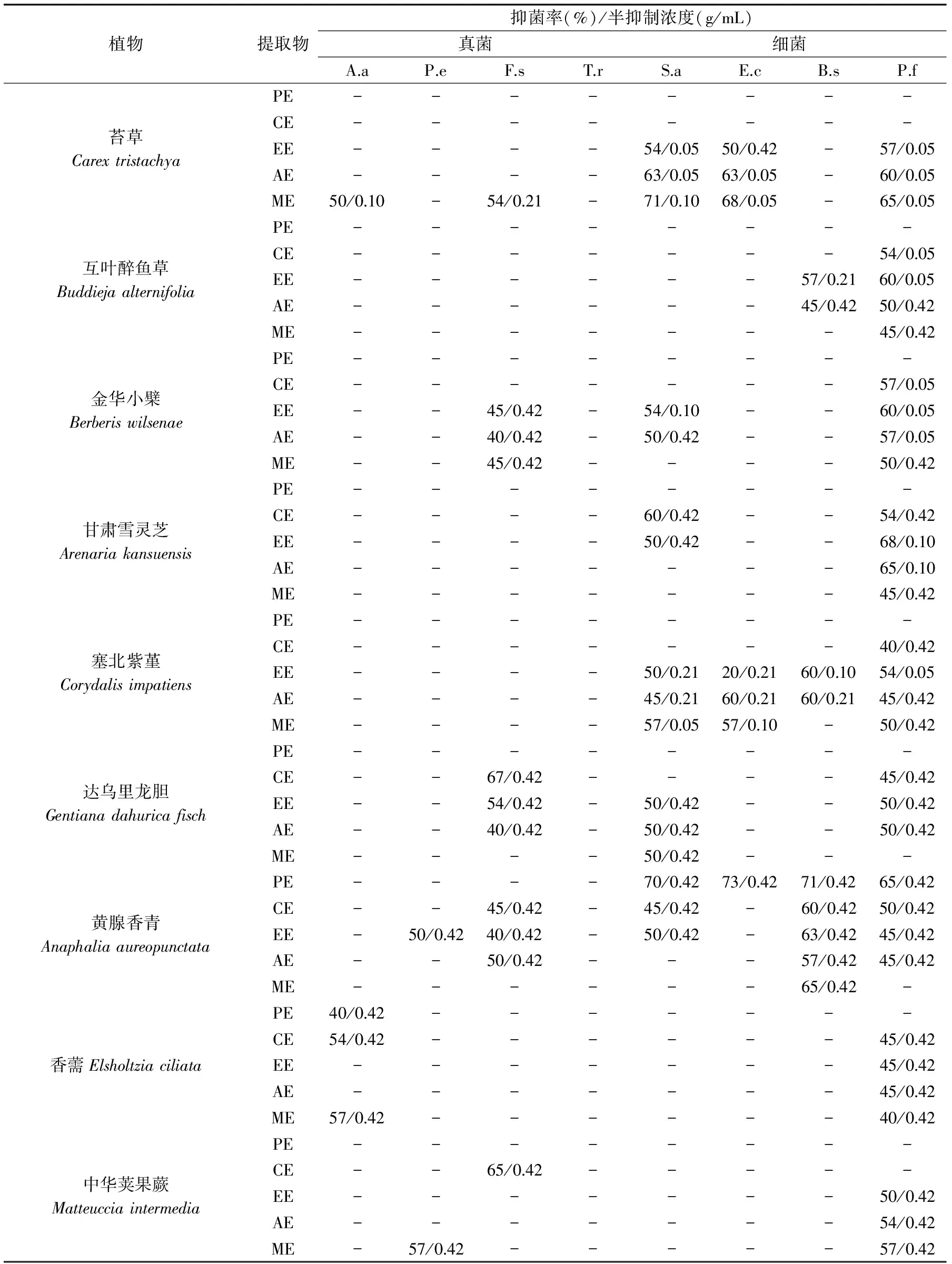
表2 各种提取物对不同菌的抑菌率和最低抑菌浓度

续表
注:表中提取物代号PE为石油迷提取物,CE为氯仿提取物,EE为乙酸乙酯提取物,AE为丙酮提取物,ME为甲醇提取物;菌种代号A.a为互格交链孢,P.e为扩展青霉,F.s为半裸镰刀菌,T.r为粉红单端孢,S.a为金黄色葡萄糖球菌,E.c为大肠杆菌,B.s为枯草芽孢杆菌,P.f为荧光假单孢;表中“-”表示无活性。
2.2 最低抑菌浓度
最低抑菌浓度(MIC)定量地反映了不同提取物对不同供试菌的生长抑制最低作用浓度。分析表2可知,苔草的提取物EE、AE和ME对金黄色葡萄糖球菌、大肠杆菌、荧光假单孢的MIC最小值达0.05 g/mL,因此能在较低的浓度下抑制这些菌的生长。另外从供试菌的角度来分析,苔草的EE、AE和ME、互叶醉鱼草的CE和EE、金华小檗的CE、EE和AE、龙胆花的EE对荧光假单孢的MIC为0.05 g/mL,表现出多种提取物在较低浓度下该对菌有抑制效果。
在筛选的15种高原植物中,每种植物至少有一种提取物对某些供试菌有不同程度的抑制能力。对于这些体外具有较强抑菌活性的提取物质其体内抑菌活性和进一步分离纯化有待进行。这些天然活性提取物如果经过纯化和合理的配方,将可以用于食品腐败菌的控制,另外也可作为合成新的抑菌剂的分子模板。多种供试植物提取物具有较好的抑菌谱,其中黄腺香青、刺柏、塞北紫芹、龙胆花、苔草的提取物至少对4种供试菌有抑制作用,且抑菌率较高。尤其苔草甲醇提取物对A.alternata、F.semitectum、E.coli、S.aureus、P.fluorescence的MIC值在0.05~0.21 g/mL之间。绝大多数供试植物提取物对荧光假单孢有明显的抑制效果。总体来看,各提取物对细菌的抑制效果强于真菌,细菌的最高抑制率达到71%,而真菌最高抑制率均不超过68%;细菌MIC值同样低于真菌,真菌只有苔草甲醇提取物对A.alternata和F.sulphureum的MIC值分别达到0.1 g/mL和0.21 g/mL,而对E.coli和P.fluorescence的MIC值低至0.05 g/mL。同时我们发现提取物抑菌圈大小与其相应的MIC值不一定成负相关性,这与左国营[23]的研究结果相一致,初步分析可能是由于提取液含有多种成分而各成分的活性强度各不相同所致。虽然我们对15种植物样用不同极性溶剂提取,但还是会出现漏筛现象,比如鲍敏[24]对甘肃雪灵芝乙醇提取物对金黄色葡萄球菌和枯草芽孢杆菌都有抑制效果,而我们的实验结果显示甘肃雪灵芝各提取物对枯草芽孢杆菌没有抑制效果。许多因素会影响实验结果,其中包括提取物的制备方法(如有效成分的挥发),活性成分在植物不同器官的分布(如全株与部分器官的差异)和有效组分的富集程度等。
3 结论
15种高原植物四种不同提取物对8种常见微生物分别具有不同的抑菌谱和最小抑制浓度,其中黄腺香青、刺柏、塞北紫芹、龙胆花、苔草的提取物至少对4种供试菌有抑制作用;苔草的三种提取物对金黄色葡萄球菌、大肠杆菌与荧光假单孢菌的最低抑菌浓度为0.05 g/mL;大部分提取物对细菌的抑制效果优于对真菌的抑制效果。本研究结果表明生长于青藏高原独特生态条件下的许多植物,其代谢物在体外具有较强的抑菌活性和较广的抑菌谱;进一步研究这些代谢物的抑菌作用与机理将为新型抑菌剂的研发提供参考,也可为绿色保鲜技术的研发开辟新的途径。
[1]Tripathi P,Dubey N K. Exploitation of natural products as an alternative strategy to control postharvest fungal rotting of fruit and vegetables[J]. Postharvest Biology and Technology,2004,32(3):235-245.
[2]Ippolito A,Schena L,Pentimone I,et al. Control of postharvest rots of sweet cherries by pre-and postharvest applications of Aureobasidium pullulans,in combination with calcium chloride or sodium bicarbonate[J]. Postharvest Biology and Technology,2005,36(3):245-252.
[3]Smilanick J L,Mansour M F,Gabler F M,et al. Control of citrus postharvest green mold and sour rot by potassium sorbate combined with heat and fungicides[J]. Postharvest Biology and Technology,2008,47(2):226-238.
[4]Droby S,Wisniewski M,Macarisin D,et al. Twenty years of postharvest biocontrol research:Is it time for a new paradigm?[J]. Postharvest Biology and Technology,2009,52(2):137-145.
[5]Sanzani S M,Nigro F,Mari M,et al. Innovations in the control of postharvest diseases of fresh fruit and vegetables[J]. Arab Journal of Plant Protection,2009(2):240-244.
[6]Sharma R R,Singh D,Singh R. Biological control of postharvest diseases of fruits and vegetables by microbial antagonists:A review[J]. Biological Control,2009,50(3):205-221.
[7]Casals C,Teixidó N,Vias I,et al. Combination of hot water,Bacillussubtilis,CPA-8 and sodium bicarbonate treatments to control postharvest brown rot on peaches and nectarines[J]. European Journal of Plant Pathology,2010,128(1):51-63.
[8]Prusky D,Gullino M L. Postharvest Pathology[M]. The Netherlands:Springer,2010:119-135.
[9]Wu F,Zheng X. Essential oils to controlAlternariaalternatainvitro,andinvivo[J]. Food Control,2007,18(9):1126-1130.
[10]Lee S H,Chang K S,Su M S,et al. Effects of some Chinese medicinal plant extracts on five different fungi[J]. Food Control,2007,18(12):1547-1554.
[11]ángeles Verástegui,Verde J,García S,et al. Species of,Agave with antimicrobial activity against selected pathogenic bacteria and fungi[J]. World Journal of Microbiology and Biotechnology,2008,24(24):1249-1252.
[12]Santas J,Almajano M P,Carbó R. Antimicrobial and antioxidant activity of crude onion(Alliumcepa,L.)extracts[J]. International Journal of Food Science and Technology,2010,45(2):403-409.
[13]Rodríguez D J D,García R R,Castillo F D H,et al.Invitroantifungal activity of extracts of Mexican Chihuahuan Desert plants against postharvest fruit fungi[J]. Industrial Crops and Products,2011,34(1):960-966.
[14]Kasanah N,Triyanto,Seto D S,et al. Review antibacterial compounds from red sea weeds(Rhodophyta)[J]. Indonesian Journal of Chemistry,2015,15(2):201-209.
[15]Mohammadipanah F,Wink J. Actinobacteria from arid and desert habitats:diversity and biological activity[J]. Frontiers in Microbiology,2016,8(1):1-10.
[16]Sengupta S,Pramanik A,Ghosh A,Bhattacharyya M. Antimicrobial activities of actinomycetes isolated from unexplored regions of Sundarbans mangrove ecosystem[J]. BMC microbiology,2015,15(1):1-16.
[17]Giddings L A,Newman D J. Bioactive compounds from terrestrial extremophiles. In Bioactive Compounds from Terrestrial Extremophiles[M]. Springer International Publishing,2015:1-75.
[18]吴文君,刘惠霞,朱靖博,等.天然产物杀虫剂—原理·方法·实践[M]. 西安:陕西科学技术出版社,1998
[19]Bi Y,Tian S P,Guo Y R,et al. Sodium silicate reduces postharvest decay on Hami melons:induced resistance and fungistatic effects.[J]. Plant Disease,2006,90(3):279-283.
[20]沈萍,范秀容,李光武. 微生物学实验[M]. 第三版. 北京:高等教育出版社,1999.
[21]Cakir A,Kordali S,Zengin H,et al. Composition and antifungal activity of essential oils isolated fromHypericumhyssopifolium,andHypericumheterophyllum[J]. Flavour and Fragrance Journal,2004,19(1):62-68.
[22]Eloff J N. A Sensitive and Quick Microplate Method to Determine the Minimal Inhibitory Concentration of Plant Extracts for Bacteria[J]. Planta Medica,1998,64(8):711-713.
[23]左国营,韩峻,余巍. 47种中草药提取物的体外抗菌活性筛选研究[J]. 中国药房,2005(16):798-799.
[24]鲍敏,米琴,曾阳. 藏药雪灵芝不同提取物的体外抑菌作用实验研究[J]. 青海师范大学学报,2005(4):87-89.
Inhibition effects of extracts from 15 kinds Tibetan plateau plants against several common microorganisms
ZHANG Zhong,LI Ke-wei,BI Yang*,WANG Yi,REN Ya-lin
(College of Food Science and Engineering,Gansu Agricultural University,Lanzhou 730070,China)
To investigate the antimicrobial activity of some Tibetan Plateau plant extracts,agar-diffusion method and 96-well plate double dilution method were used to evaluate the inhibition effects and minimum inhibitory concentration(MIC)of different extracts from 15 kinds of Tibetan plateau plant samples. The results showed that extracts from different plateau plants had different antimicrobial spectrum and MICs. Extracts fromAnaphaliaaureopunctata,Juniperusformosara,Corydalisimpatiens,Gentianasino-ornataandCarextristachyacan inhibited at least 4 tested microorganisms,the MIC of three extracts fromCarextristachyaagainstStaphylococcusaureus,EscherichiacoliandBacillussubtiliswas 0.05 g·mL-1. Most of extracts showed more effective inhibition against bacteria than fungi. It concluded that several kinds extract from plateau plants had wide antimicrobial range and strong inhibition activity against common microorganisms.
Tibetan plateau plants;agar-diffusion method;minimum inhibitory concentration;common microorganisms
2016-05-20
张忠(1977-),男,在读博士,副教授,主要从事天然抗菌活性物质方面的研究,E-mail:zhangzhong@gsau.edu.cn。
*通讯作者:毕阳(1962-),男,博士,教授,研究方向:采后生物学与技术;食品风味,E-mail:beyang62@163.com。
国家自然科学地区基金项目(31360416);甘肃省中药材产业科技攻关项目(甘肃大宗道地中药材安全防蛀防霉技术研究);甘肃省农业科技创新项目(GNCX-2012-42)。
TS201.2
A
1002-0306(2016)24-0000-00
10.13386/j.issn1002-0306.2016.24.000

