唾液酸在动脉粥样硬化中的作用研究进展▲
周方元 综述 李 艳 审校
(武汉大学人民医院检验科,武汉市 430060,E-mail:z184546159@icloud.com)
综 述
唾液酸在动脉粥样硬化中的作用研究进展▲
周方元 综述 李 艳 审校
(武汉大学人民医院检验科,武汉市 430060,E-mail:z184546159@icloud.com)
血清唾液酸的浓度与炎症的状态密切相关,而动脉粥样硬化(AS)现被认为是一种慢性炎症性病变,二者的关系已受到广泛关注。唾液酸具有包括细胞间信息传递在内的多种作用,并从不同方面影响AS进程。本文就唾液酸在AS中的作用研究进展进行综述,以期为唾液酸与AS的关系研究提供参考。
动脉粥样硬化;唾液酸;综述
唾液酸是酸性糖复合物末端的九碳单糖,于20世纪70年代在病毒感染的成纤维细胞中被发现[1]。唾液酸在细胞表面的相互作用中起着重要作用[2],保护细胞膜不被蛋白水解酶水解[3],促进细胞黏附[4]。动脉粥样硬化(atherosclerosis,AS)是一种慢性炎症性病变,炎症反应和细胞凋亡可增加AS斑块形成的速度和不稳定性[5-6]。有关唾液酸在AS中的作用研究越来越广泛,本文对其研究进展综述如下。
1 唾液酸的生物学特征
1.1 唾液酸的结构特点 目前的研究已确定唾液酸共有50种以上的天然衍生物,其核心结构总共有4种:酮基-脱氧壬酮糖酸、N-羟乙酰神经氨酸(N-glycolylneuraminic acid,Neu5Gc)、神经氨酸和N-乙酰神经氨酸(N-acetylneuraminic acid,Neu5Ac),见图1。在人体内唾液酸以Neu5Ac的结构为主,而正常组织中一般不存在Neu5Gc[7],当体内Neu5Gc水平达到一定量时,则表明机体可能处于炎症[8]或肿瘤[9]等病理状态。唾液酸在体内主要是以游离唾液酸、聚唾液酸、唾液酸衍生物和唾液酸同系物存在,通常是位于糖蛋白、糖脂等糖缀合物的非还原末端;根据其与次末端的其他唾液酸、半乳糖或者N-乙酰半乳糖胺(N-acetylgalactosamine,GalNAc)的位置关系,可以将唾液酸的连接方式,亦即唾液酸化作用的方式分为α-2,3、α-2,6和α-2,8[10],见图2。不同的唾液酸化状态分布的特点不同,对糖蛋白或糖脂的功能影响也不同。
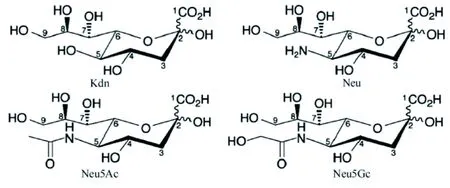
图1 唾液酸的4种核心结构
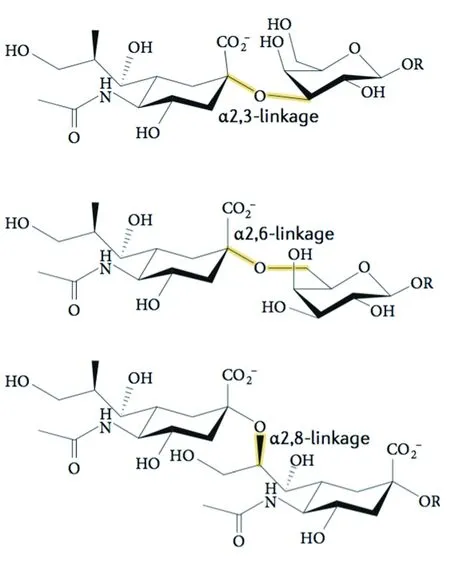
图2 3种唾液酸化方式
注:唾液酸通过不同的糖苷键连接到糖蛋白或糖脂的糖链上,其中最常见的类型为与半乳糖残基的α-2,3连接方式(上)、与部分半乳糖或GalNAc的α-2,6连接方式(中)以及与其他唾液酸的α-2,8连接方式(下)。
1.2 唾液酸的表达特性 唾液酸作为各种糖蛋白、糖脂的非还原性末端,广泛存在于各种细胞的表面和组织中。细胞表面适量的唾液酸,对于维护细胞表面功能有着重要作用[11-12]。位于内皮细胞膜上的唾液酸,不但可以用于细胞间的信息传递,还可以作为某些物质的受体被识别。例如整合素αvβ3,当其被精氨酸-甘氨酸-天冬氨酸(arginine-glycine-aspartic acid,RGD)重复序列识别后,其自身所含的唾液酸可以协助调节整合素诱发的细胞黏附,并激活下游通路粘着斑激酶和细胞外信号调节激酶1/2,促进内皮细胞增殖、迁移和再生,去除整合素上的唾液酸后,这些作用都将被显著抑制[13]。位于红细胞表面的唾液酸,不仅可以阻止红细胞聚集,其对于红细胞的生存也具有重要意义。随着人年龄的增加,循环中的红细胞表面唾液酸含量将不断下降。研究表明,经过唾液酸重塑的老化红细胞,可以重新恢复至年轻人红细胞的功能状态,并且可以延长红细胞的寿命[14]。其他各种细胞表面的唾液酸,对于细胞自身或细胞与其他细胞、蛋白质等的相互作用也有重要影响。
2 唾液酸诊断AS相关疾病的初步探讨
AS是冠心病(coronary heart disease,CHD)等疾病的病理基础,AS斑块的发展程度直接影响缺血性心脏病的严重程度。2014年调查显示,中国缺血性心脏病的死亡率高居全球第二[15]。由于城市化后居民肥胖水平增高、寿命延长等因素,预计到2025年将会有80%~90%的心血管疾病发生在低收入和中等收入国家[16]。目前CHD的明确诊断主要依靠有创的冠状动脉造影,对CHD的早期诊断仍然缺乏有效的方法和指标。研究表明急性心肌梗死患者的血清总唾液酸(total sialic acid,TSA)和脂质结合唾液酸水平较正常人显著升高,并且在梗死后3 d内,血清TSA和脂质结合唾液酸水平呈上升趋势[17]。因而早期联合检测血清唾液酸或可用于诊断CHD,以及评估CHD的严重程度。
3 唾液酸在AS中的主要作用
3.1 唾液酸在组织碎片清除中的作用 沉积在AS斑块内的唾液酸能够促进胶原蛋白诱导的血小板聚集、三磷酸腺苷分泌和血小板黏附在固定胶原蛋白上的过程,这一作用主要是通过唾液酸对胶原蛋白连接整合素α2β1的影响而实现[18]。此外,唾液酸对其他蛋白质的相关功能也有影响,例如乳凝集素作为桥梁分子可以提高巨噬细胞吞噬凋亡细胞的能力,其一方面结合凋亡细胞上的磷脂酰丝氨酸位点[18-20],另一方面通过其RGD重复序列结合巨噬细胞膜上的整合素,以自身为桥梁促进巨噬细胞吞噬凋亡细胞。在这一过程中,不仅整合素上的唾液酸参与RGD重复序列结合整合素后下游信号的触发[13],而且乳凝集素自身的唾液酸,对于乳凝集素的功能状态也有重要影响。在AS斑块的形成过程中,组织碎片的积累是主要因素,一方面游离的唾液酸自身是促进AS斑块形成的一个重要因素,另一方面糖蛋白上的唾液酸残基在乳凝集素这类分子发挥促凋亡细胞清除功能中起到重要的协同作用。
3.2 唾液酸与炎症的关系 血清TSA水平与肿瘤坏死因子(tumor necrosis factor-α,TNF-α)、白介素-6等炎性因子的水平呈正相关[21-22],这说明血清TSA与机体的炎症状态密切相关。机体在发生损伤或炎症时,白细胞会聚集在炎症部位,吞噬细菌后的白细胞破裂崩解,其表面的大量唾液酸将释放入血,这是感染时机体血清TSA升高的一个重要原因,而这又对正常组织造成损害,从而引起某些慢性炎症。AS自身也是一个慢性炎症过程,AS斑块促发的炎症反应可以进一步促进白介素-6和TNF-α等促炎因子的产生,刺激肝脏大量合成和分泌富含唾液酸的糖蛋白,加速AS进程。这提示血清TSA可作为AS促发的炎症反应的一个持续性标志物。
3.3 唾液酸与血管再生 AS的始动因素来源于血管内皮损伤。血管再生不仅对延缓AS斑块的形成具有重要,也是治疗AS相关疾病,特别是急性心肌梗死的新途径。唾液酸可以通过协助某些整合素,促进内皮细胞再生[13],这是血管再生的基础。另有研究表明,在抗血管内皮生长因子治疗敏感的肿瘤细胞表面,表现出高水平的α-2,6形式的唾液酸化,这有助于防止促肿瘤血管生成因子半乳糖凝集素的结合,从而发挥抗血管生成作用,并且去除表面α-2,6形式的唾液酸后,会消除抗血管内皮生长因子作用[23]。这提示细胞表面α-2,6形式的唾液酸对于血管的生成有着抑制作用。可见,不同部位的唾液酸对于血管再生表现出不同的作用。
3.4 唾液酸对血管平滑肌细胞的作用 机体处于高唾液酸水平时,体内的唾液酸酶的活性和含量也会相应提高。研究发现,人质膜型唾液酸酶3可能参与了血管内膜增厚[24],而血管内膜增厚是AS发展的早期阶段。研究还发现,人质膜型唾液酸酶3基因的过表达,会抑制TNF-α诱导的平滑肌细胞表达基质金属蛋白酶9,并且抑制TNF-α诱导的基质金属蛋白酶9启动子活性[24],而基质金属蛋白酶9不仅对血管中膜平滑细胞的迁移、增殖和凋亡有着重要作用,而且对于AS斑块处的血管重建、斑块不稳定性等都有着重要作用[25]。
4 展 望
唾液酸作为乳凝集素等糖蛋白的非还原末端,在人体组织内广泛表达,在AS发生发展的不同阶段中发挥着重要作用。唾液酸可在体外检测,方法便捷、微创,耗时短,血清TSA水平升高对与AS相关疾病的诊断和预后评估具有一定的潜在价值。但目前仍缺乏多中心大样本的研究,对于唾液酸与CHD相关的各种病理生理过程的关系和机制尚未完全明确,随着研究的深入,唾液酸的实验室监测和临床应用等能得到进一步拓展。
[1] Julien S,Delannoy P.Sialic acid and cancer[M]//Taniguchi N,Endo T,Seeberger PH,et al.Glycoscience:Biology and Medicine.Tokyo:Springer Japan,2015:1 419-1 424.
[2] Paulson JC.Glycoproteins:what are the sugar chains for?[J].Trends Biochem Sci,1989,14(7):272-276.
[3] Görög P,Pearson JD.Sialic acid moieties on surface glycoproteins protect endothelial cells from proteolytic damage[J].J Pathol,1985,146(3):205-212.
[4] Bork K,Horstkorte R,Weidemann W.Increasing the sialylation of therapeutic glycoproteins:the potential of the sialic acid biosynthetic pathway[J].J Pharm Sci,2009,98(10):3 499-3 508.
[5] Ding D.Evaluation of plaque stability in extracranial carotid atherosclerotic disease:Role of vascular inflammation[J].J Neurol Sci,2015,349(1/2):262-263.
[6] Clarke M,Bennett M.The emerging role of vascular smooth muscle cell apoptosis in atherosclerosis and plaque stability[J].Am J Nephrol,2006,26(6):531-535.
[7] Cohen M,Varki A.The sialome--far more than the sum of its parts[J].OMICS,2010,14(4):455-464.
[8] Wickramasinghe S,Medrano JF.Primer on genes encoding enzymes in sialic acid metabolism in mammals[J].Biochimie,2011,93(10):1 641-1 646.
[9] Varki NM,Varki A.Diversity in cell surface sialic acid presentations:implications for biology and disease[J].Lab Invest,2007,87(9):851-857.
[10]Bi S,Baum LG.Sialic acids in T cell development and function[J].Biochim Biophys Acta,2009,1 790(12):1 599-1 610.
[11]Inoue S,Sato C,Kitajima K.Extensive enrichment of N-glycolylneuraminic acid in extracellular sialoglycoproteins abundantly synthesized and secreted by human cancer cells[J].Glycobiology,2010,20(6):752-762.
[12]Inoue S,Lin SL,Chang T,et al.Identification of free deaminated sialic acid(2-keto-3-deoxy-D-glycero-D-galacto-nononic acid) in human red blood cells and its elevated expression in fetal cord red blood cells and ovarian cancer cells[J].J Biol Chem,1998,273(42):27 199-27 204.
[13]Chiodelli P,Urbinati C,Mitola S,et al.Sialic acid associated with αvβ3 integrin mediates HIV-1 Tat protein interaction and endothelial cell proangiogenic activation[J].J Biol Chem,2012,287(24):20 456-20 466.
[14]Huang YX,Tuo WW,Wang D,et al.Restoring the youth of aged red blood cells and extending their lifespan in circulation by remodelling membrane sialic acid[J].J Cell Mol Med,2016,20(2):294-301.
[15]Nowbar AN,Howard JP,Finegold JA,et al.2014 global geographic analysis of mortality from ischaemic heart disease by country,age and income:statistics from World Health Organisation and United Nations[J].Int J Cardiol,2014,174(2):293-298.
[16]Yusuf S,Ounpuu S,Anand S.The global epidemic of atherosclerotic cardiovascular disease[J].Med Princ Pract,2002,11(Suppl 2):3-8.
[17]Gökmen SS,Kiliçli G,Ozçelik F,et al.Serum total and lipid-bound sialic acid levels following acute myocardial infarction[J].Clin Chem Lab Med,2000,38(12):1 249-1 255.
[18]Wen FQ,Jabbar AA,Patel DA,et al.Atherosclerotic aortic gangliosides enhance integrin-mediated platelet adhesion to collagen[J].Arterioscler Thromb Vasc Biol,1999,19(3):519-524.
[19]Brissette MJ,Lepage S,Lamonde AS,et al.MFG-E8 released by apoptotic endothelial cells triggers anti-inflammatory macrophage reprogramming[J].PLoS One,2012,7(4):e36 368.
[20]Cheyuo C,Jacob A,Wu R,et al.Recombinant human MFG-E8 attenuates cerebral ischemic injury:its role in anti-inflammation and anti-apoptosis[J].Neuropharmacology,2012,62(2):890-900.
[21]Mendall MA,Patel P,Asante M,et al.Relation of serum cytokine concentrations to cardiovascular risk factors and coronary heart disease[J].Heart,1997,78(3):273-277.
[23]Croci DO,Cerliani JP,Dalotto-Moreno T,et al.Glycosylation-dependent lectin-receptor interactions preserve angiogenesis in anti-VEGF refractory tumors[J].Cell,2014,156(4):744-758.
[24]Moon SK,Cho SH,Kim KW,et al.Overexpression of membrane sialic acid-specific sialidase Neu3 inhibits matrix metalloproteinase-9 expression in vascular smooth muscle cells[J].Biochem Biophys Res Commun,2007,356(3):542-547.
[25]Saneipour M,Ghatreh-Samani K,Heydarian E,et al.Adiponectin inhibits oxidized low density lipoprotein-induced increase in matrix metalloproteinase 9 expression in vascular smooth muscle cells[J].ARYA Atheroscler,2015,11(3):191-195.
国家自然科学基金(81572069)
周方元(1989~),男,博士,研究方向:冠心病的诊断与发病机制。
李艳(1961~),女,博士,教授,研究方向:冠心病的诊断与发病机制,E-mail:yanlitf1120@163.com。
R 541.4
A
0253-4304(2016)09-1272-03
10.11675/j.issn.0253-4304.2016.09.23
2016-05-19
2016-07-28)

