基质金属蛋白酶-9及金属蛋白酶组织抑制剂-1在孕鼠胎盘形成中期的表达模式
魏孟梅, 吴曙光, 赵海*
(1. 贵阳中医学院药学院,贵阳550002; 2. 贵阳中医学院实验动物研究所,贵阳550002)
基质金属蛋白酶-9及金属蛋白酶组织抑制剂-1在孕鼠胎盘形成中期的表达模式
魏孟梅1, 吴曙光2, 赵海2*
(1. 贵阳中医学院药学院,贵阳550002; 2. 贵阳中医学院实验动物研究所,贵阳550002)
目的 探讨基质金属蛋白酶-9(MMP-9)及金属蛋白酶组织抑制剂-1(TIMP-1)在孕鼠胎盘形成中期的表达模式。方法 HE染色观察孕鼠第9天至第14天(D9~D14)胎盘形态结构的变化,同时免疫组织化学法检测相应天数胎盘中MMP-9和TIMP-1的表达情况。结果 HE染色结果显示孕鼠D11时胎盘的3层结构开始形成,包括蜕膜区(Dec)、海绵滋养细胞层(Sp)和迷路区(Lab);随着妊娠天数的增加,Dec区域逐渐缩小,Sp和Lab区域增大;免疫组化表明,MMP-9和TIMP-1均表达于细胞浆和细胞核中,MMP-9强表达于D9和D10胎盘的外胎盘锥中,D10~D13的Dec、Sp和D11~D13的滋养巨细胞中。MMP-9在D11的Lab,D12的Dec和Lab,D13的Dec、Sp、Lab区域中的阳性细胞的积分光密度值与D14胎盘中对应值比较,差异有统计学意义(P<0.05);TIMP-1在D9~D12的Dec区域中的阳性细胞的积分光密度值与D14胎盘中对应值比较,差异有统计学意义(P<0.05);MMP-9/TIMP-1在D9、D11的Dec及D12的Lab区域中的比值与D14胎盘中对应值比较,差异有统计学意义(P<0.05),在D10、D12的Dec和D13的Lab区域中的比值与D14胎盘中对应值比较,差异有高度统计学意义(P<0.01)。结论 MMP-9和TIMP-1在孕鼠胎盘中的协同表达可能参与调节胎盘的形成。
金属蛋白酶; 金属蛋白酶组织抑制剂; 胎盘; 外胎盘锥
哺乳动物囊胚植入需经过定位、黏附、穿透3个精密过程(马芳,2004)。小鼠囊胚中靠近内细胞团(inner cell mass)的滋养层细胞向子宫内膜侵袭分化为具有侵袭能力的外胎盘锥(ecto-placental cone,Epc),随后入侵子宫内膜,逐步发育形成由蜕膜区(decidua basalis,Dec)、海绵滋养细胞层(spongiotrophoblast,Sp)和迷路区(labyrinth,Lab)构成的胎盘(Hu & Cross,2010;Laguetal.,2010)。近年的研究表明,表皮生长因子(epidermal augmentum factor)、血管内皮生长因子(vascular endothelial growth factor)、基质金属蛋白酶(matrix metalloproteinases,MMPs)及其抑制剂(tissue inhibitor of metalloproteinases,TIMPs)、硫酸软骨素蛋白聚糖4(CSPG4)和微小RNA(miRNA)等重要激素与整合素、细胞因子、生长因子、酶类等参与子宫内膜重建、囊胚种植及滋养层浸润等过程(张博等,2005;张省等,2014)。
MMPs是一类活性依赖于锌离子和钙离子的蛋白水解酶,是降解细胞外基质(extracellular matrix)的主要成分,TIMPs是一组抑制MMPs活性的低分子量蛋白,目前已确定有4个成员(TIMP-1,TIMP-2,TIMP-3,TIMP-4)。研究表明MMPs/TIMPs比值增高可促进甲状腺癌、膀胱癌、胃肠道癌、肺癌、结肠癌、乳腺癌、恶性表型和侵袭转移表型肿瘤的增殖、迁移和侵袭(华特波等,2011;张彪,陈仙,2011;端传友,2012;黄榕权等,2014;李霞斌等,2014)。最近也发现MMPs/TIMPs在宫颈癌、卵巢上皮性肿瘤、葡萄胎、胎膜早破等产科疾病中也有相应的表达(陈春莹等,2012;赵娟等,2012;常雅丽等,2014)。正常情况下,MMPs和TIMPs相互作用,处于协调的平衡关系,这个平衡关系一旦被打破,各种疾病就会出现(余薇,周鹏程,2012)。Morgan(2010)发现人类滋养层细胞分泌的MMP-9有很强的入侵能力。MMP-9/TIMP-1,3在分泌期子宫内膜的高表达可以增加子宫内膜的容受性,有利于胚胎着床(孙光娟,周惠芳,2013)。由此可见,在胎盘的形成过程中,MMP-9在滋养层细胞的侵袭调控中的作用尤为重要,然而有关MMP-9/TIMP-1在胎盘形成中期表达及分子机制研究的文献较少,因此本实验通过免疫组化进一步观察MMP-9和TIMP-1蛋白在孕鼠胎盘形成中期的表达情况,初步探索MMP-9和TIMP-1在胎盘形成进程中的表达模式,为研究孕鼠胎盘形成的分子机制奠定一定的理论基础。
1 材料和方法
1.1 实验动物与试剂
清洁级KM雌鼠,6~8周龄,体质量20.0~25.0 g,由重庆医科大学实验动物中心提供[实验动物生产许可证号:SCXK(渝)2012-0001,实验动物使用许可证号:SYXK(渝)2012-0001]。雄鼠与动情期雌鼠1∶2合笼,次日09∶00观察到阴栓者记为妊娠第1天(D1),收集D9~D14的胎盘组织,经4%多聚甲醛固定24 h后,制作石蜡切片(5 μm)。
山羊源性MMP-9(sc-6840)多克隆抗体和兔源性TIMP-1(sc-5538)多克隆抗体均购自Santa cruz公司;SP kit兔源试剂盒(SP9001)、SP kit山羊源试剂盒(PV-9003)、辣根酶标记抗山羊IgG(ZB2306)及DAB显色试剂盒(ZLI-9017)均购自北京中杉金桥生物技术有限公司;伊红染液(D019-1)和苏木素染液(D005-2)均购自南京建成生物工程研究所。
1.2 方法
1.2.1 孕鼠胎盘的收集 取孕鼠D9~D14植入位点,采用预冷的磷酸盐缓冲液(PBS)洗2遍,4%多聚甲醛固定24 h后,经梯度酒精脱水、常规石蜡包埋和切片。随后用伊红染液和苏木素染液常规HE染色,显微镜下观察胎盘的组织形态学结构。
1.2.2 免疫组化 免疫组化按北京中杉金桥生物技术有限公司生产的SP免疫组化染色试剂盒说明书进行。孕鼠D9~D14植入位点石蜡切片(5 μm),切片进行脱蜡,复水,枸橼酸溶液抗原修复,山羊血清封闭,加入山羊源性MMP-9(1∶400稀释)和兔源性TIMP-1(1∶300稀释)的多克隆抗体,4 ℃孵育过夜(16~18 h),次日分别加入兔抗山羊和山羊抗兔的二抗,滴加辣根酶标记链酶卵白素工作液(S-A/HRP),室温孵育30 min,DAB显色,苏木精复染,封片,显微镜下观察MMP-9和TIMP-1在孕鼠D9~D14胎盘中的表达情况。
2 结果
2.1 孕鼠D9~D14植入位点HE染色情况
HE染色结果显示,D9和D10时胎盘的3层结构尚未形成,此时Dec区域比较大,Epc似锥形,形态明显,绒毛膜板和Epc紧密相连;D11时胎盘的3层结构开始形成,包括Dec、Sp和Lab,Dec区域仍较大,Sp和Lab区域很小;D11~D14,胎盘整体面积逐渐增大,Dec区域逐渐缩小,Sp和Lab区域逐渐增大;D13时胎盘的完整形态结构基本形成,且和D14的形态结构基本一致(图1)。
2.2 MMP-9在孕鼠D9~D14胎盘中的表达情况
免疫组化结果显示MMP-9在孕鼠D9~D14胎盘中都有相应的表达,主要表达于细胞浆和细胞核中,强表达于D9和D10的Epc,D10~D13的Dec和Sp中,在D11~D13的滋养巨细胞(trophoblast giant cell, TGC)和D13的Lab区域中也有较强的表达,MMP-9弱表达于D14胎盘的3层结构中(图2)。Image Pro Plus图像分析显示,MMP-9蛋白在孕鼠D11胎盘的Lab、D12的Dec和Lab、D13的Dec、Sp、Lab区域中阳性细胞的IOD值均显著高于D14的Dec、Sp、Lab区域的IOD值(P<0.05),D10和D11的Dec区域阳性细胞的IOD值均极显著高于D14的Dec区域的IOD值(P<0.01)(表1)。
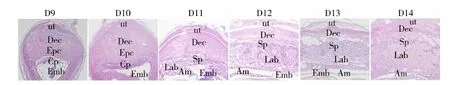
图1 孕鼠D9~D14植入位点的HE染色情况(40×)Fig.1 HE staining of implantation sites from day 9 to 14 of pregnant mice (40×)
ut. 子宫基膜, Dec. 蜕膜区, Epc. 外胎盘锥, Cp. 绒毛膜板, Emb. 胚胎, Am. 羊膜, Sp. 海绵滋养细胞层, Lab. 迷路区。
ut. uterine basal membrane, Dec.decidua basalis, Epc. ectoplacental cone, Cp. chorionic plate, Emb. embryo, Am. amnion, Sp. spongiotrophoblast, Lab. labyrinth.
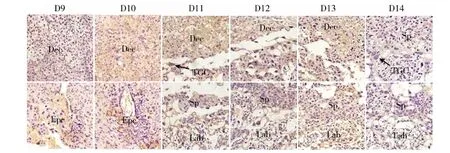
图 2 MMP-9在孕鼠D9~D14胎盘组织中的表达情况(400×)Fig.2 The expression of metalloproteinase-9 in placenta from day 9 to 14 of pregnant mice (400×)
Dec.蜕膜区, Epc. 外胎盘锥, TGC. 滋养巨细胞, Sp. 海绵滋养细胞层, Lab. 迷路区。
Dec. decidua basalis, Epc. ectoplacental cone, TGC. trophoblast giant cell, Sp. spongiotrophoblast, Lab. labyrinth.
表1 MMP-9在孕鼠D9~D14胎盘组织中阳性细胞的积分光密度值变化±s)Table 1 The changes of integrated optical density of MMP-9 in placenta from day 9 to 14 of pregnant mice ±s)
注: Dec. 蜕膜区, Epc. 外胎盘锥, Sp. 海绵滋养细胞层, Lab. 迷路区; 与D14比较,*P<0.05,**P<0.01; 下表同。
Notes: Dec. decidua basalis, Epc. ectoplacental cone, Sp. spongiotrophoblast, Lab. labyrinth; compared with day 14 of pregnancy,*P<0.05,**P<0.01; the same below.
2.3 TIMP-1在孕鼠D9~D14胎盘中的表达情况
免疫组化结果显示,TIMP-1主要表达于细胞浆和细胞核中,在孕鼠D9和D10胎盘的Epc,D13和D14的Dec中有少量的表达,其他时间在胎盘的Dec、Sp、Lab及TGC中几乎均没有表达(图3)。Image Pro Plus图像分析显示,TIMP-1在孕鼠D9~D12胎盘的Dec区域中阳性细胞的IOD值均显著低于D14的Dec区域IOD值(P<0.05),D13胎盘的Dec与D14胎盘的Dec区域中TIMP-1阳性细胞的IOD值比较无差异(表2)。
2.4 MMP-9/TIMP-1在孕鼠D9~D14胎盘中的变化
实验结果显示MMP-9/TIMP-1比值高表达于D9~D12胎盘中的Dec及D12、D13的Lab区域中,与D14胎盘中各区域MMP-9/TIMP-1比值相比,D9、D11胎盘中的Dec及D12的Lab区域中比值差异有统计学意义(P<0.05),D10、D12胎盘中的Dec
和D13的Lab区域中比值差异具有高度统计学意义(P<0.01)(表3)。
3 讨论
胎盘不仅是母胎气体营养物质交换和胎儿代谢物排泄的场所,同时也是一个重要的内分泌器官。有研究表明各种转录因子、激素、生长因子和细胞因子等通过旁分泌和自分泌方式参与了滋养层细胞的增殖、分化、侵袭及母体血管重建等胎盘的形成过程(Maltepeetal.,2010;Kentetal.,2012;Luoetal.,2013)。 滋养层细胞的侵入行为与肿瘤浸润转移具有相似的生物行为学特性,MMPs及TIMPs与正常妊娠及异常妊娠的关系越来越受到重视(赵红彩等,2010)。近年来研究表明,MMPs/TIMPs的比值在绒癌、妊高征、多囊卵巢综合征、子宫内膜异位症等产科疾病的发病机制中起重要作用(李燕,张庆文,2013;武军等,2013;胡亚涛等,2014)。MMP-2、MMP-8、MMP-11、MMP-16、MMP-19的高表达和TIMP-1、PAI-1表达下调可参与绒癌侵袭和转移的调节(苏晓华,庞战军,2015)。孕早期绒毛组织中IL-6和MMP-2的正常表达对维持早期胚胎发育起到一定作用(崔世红等,2014),MMP-9能促进肺癌、胃癌、侧裂区脑胶质瘤、膀胱癌、涎腺肿瘤的增殖、侵袭、转移和血管生成等过程(李晨等,2013;高放等,2014;姚益群等,2014;张贺军,朱军,2014;代婧,雷志敏,2015;张诚,刘艳辉,2015)。胎膜早破与MMP-9/TIMP-1比值和MMP-9/TIMP-2比值的调控密切相关(郭琦等,2014)。MMPs和TIMPs家族参与了囊胚植入、胎盘形成的过程,但具体的分子机制目前还在不断的探索研究中。
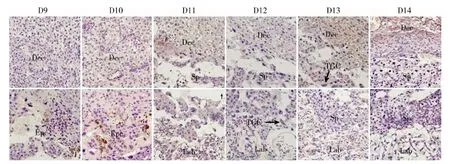
图 3 TIMP-1在孕鼠D9~D14胎盘组织中的表达情况(400×)
Fig.3 The expression of TIMP-1 in placentas from day 9 to 14 of pregnant mice (400×)
Dec.蜕膜区, Epc. 外胎盘锥, TGC. 滋养巨细胞, Sp. 海绵滋养细胞层, Lab. 迷路区。
Dec. decidua basalis, Epc. ectoplacental cone, TGC. trophoblast giant cells, Sp. spongiotrophoblast, Lab. labyrinth.
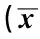
表2 TIMP-1在孕鼠D9~D14胎盘组织中阳性细胞的积分光密度值变化±s)Table 2 The changes of integrated optical density of TIMP-1 in placenta from day 9 to 14 of pregnant mice ±s)
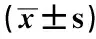
表3 MMP-9/TIMP-1在孕鼠D9~D14胎盘组织中的变化Table 3 The changes of MMP-9/TIMP-1 in placenta from day 9 to 14 of pregnant mice ±s)
研究发现正常早孕绒毛组织中MMP-9蛋白表达水平同样随妊娠周数增加而逐渐升高,并在孕8~10周达到最高峰,而后逐渐降低,MMP-9 mRNA强表达于孕早、中期,TIMP-1 mRNA强表达于孕晚期,MMP-9及TIMP-1协同表达可能在滋养层细胞侵袭、受精卵着床、血管重建过程中发挥一定的作用(杨中玫等,2013)。研究表明MMP-2、MMP-9和TIMP-1、TIMP-2在妊娠胚胎植入、滋养层细胞侵袭、胎盘形成和各种肿瘤的生长、侵袭、转移中的作用是非常关键的(Chen & Li,2011)。本实验通过对孕鼠D9~D14胎盘形态学变化的观察及MMP-9、TIMP-1蛋白在相应天数中表达的检测,结果显示孕鼠D9和D10时Dec较大,Epc形态明显,D11时胎盘的形态结构开始形成,随着妊娠天数的增加,Dec区域缩小,Sp和Lab区域逐渐增大,D13时胎盘形态基本完全形成,MMP-9强表达于D9和D10胎盘的Epc、D10~D13的Dec、Sp及D11~D13的TGC,弱表达于D14的胎盘中,TIMP-1弱表达于D9和D10的Epc,D13和D14的Dec。进一步分析发现MMP-9/TIMP-1比值高表达于D9~D12胎盘中的Dec及D12、D13的Lab区域中,低表达于D14的胎盘中,统计分析结果显示与D14胎盘中各区域MMP-9/TIMP-1比值进行比较,D9、D11胎盘中的Dec及D12的Lab区域中比值差异具有统计学意义(P<0.05),D10、D12胎盘中的Dec和D13的Lab区域中MMP-9/TIMP-1比值差异具有高度统计学意义(P<0.01)。在MMP-9强表达的区域中TIMP-1只有在D9和D10胎盘的Epc区域中微弱表达,当MMP-9弱表达时,TIMP-1有较强的表达,由此我们可以推测在孕鼠胎盘的形成中期,MMP-9和TIMP-1可能共同参与了对胎盘滋养层细胞侵袭能力的调节,在胎盘尚未完全形成之前,MMP-9的高表达和TIMP-1的弱表达可能参与促进滋养层细胞的侵袭和胎盘形成,当胎盘3层结构基本形成之后,TIMP-1的高表达可以明显抑制MMP-9的功能,从而阻止胎盘形成的异常,在孕鼠胎盘形成的过程中,MMP-9/TIMP-1动态表达能够有效调控胚胎植入和胎盘形成,两者处于一个动态的平衡过程。TIMP-1拮抗MMP-9对细胞外基质的降解作用,避免滋养层细胞对子宫内膜的过度侵袭,二者的动态平衡有利于囊胚植入,使妊娠顺利进行。
常雅丽, 田瑛, 赵志茹, 等. 2014. CD147与MMP-2在葡萄胎组织中的表达及其意义[J]. 中国妇幼保健, 29(3): 431-434.
陈春莹, 李丽, 黄海玉, 等. 2012. Ets-1和MMP-9在胎膜早破中的表达和意义[J]. 中国妇幼保健, 27(24): 3796-3798.
崔世红, 赵岚岚, 蔡一鸣, 等. 2014. 白介素-6、基质金属蛋白酶-2在早期胚胎发育中的作用[J]. 实用医学杂志, 30(6): 905-908.
代婧, 雷志敏. 2015. MMP-9在涎腺肿瘤和炎症中的表达及意义[J]. 临床口腔医学杂志, 31(7): 410-412.
端传友. 2012. MMP-2、MMP-9及VEGF在结肠癌中的表达及其与肿瘤转移的相关性[J]. 中国医药导报, 9(21): 44-45, 48.
高放, 张凤梅, 李胜水, 等. 2014. 膀胱良、恶性上皮肿瘤中MMP-9的表达及临床意义[J]. 现代肿瘤医学, 22(1): 134-136.
郭琦, 李巧云, 童嘉宁. 2014. 胎膜中MMP-9、TIMP-1、TIMP-2、TGF-β1表达与胎膜早破的关系[J]. 广东医学, 35(8): 1197-1200.
胡亚涛, 刘绍晨, 许倩, 等. 2014. TGF-β1对绒毛膜癌JEG-3细胞基质金属蛋白酶-9基质金属蛋白酶抑制剂-1蛋白表达的影响[J]. 河北医学, 20(2): 177-180.
华特波, 孟宪瑛, 张强, 等. 2011. COX-2、MMP-9、VEGF在甲状腺肿瘤中的表达[J]. 中国老年学杂志, 31(9): 1520-1522.
黄榕权, 谢燕清, 张雅洁. 2014. MMP-2、MMP-9和VEGF-D在乳腺癌中的表达及其与肿瘤淋巴管新生的关系[J]. 广东医学, 35(13): 2072-2074.
李晨, 王继英, 侯广道. 2013. TIMPS和MMPS与肺癌相关性的最新研究进展[J]. 中国医药指南, 11(10): 63-64.
李霞斌, 李世宁, 孙兴旺. 2014. MMPs与结直肠癌的研究进展[J]. 现代临床医学, 40(5): 323-325, 327.
李燕, 张庆文. 2013. MMPs-TIMPs参与多囊卵巢综合征发病机制的研究进展[J]. 中国医疗前沿, 8(5): 13-14.
马芳. 2004. 胚胎植入过程中滋养细胞侵入行为机制的研究进展[J]. 国外医学(计划生育分册), 32(2): 108-112.
苏晓华, 庞战军. 2015. F10基因过表达及沉默对绒癌细胞系JAR侵袭相关蛋白酶表达的影响[J]. 医学研究生学报, 28(4): 350-354.
孙光娟, 周惠芳. 2013. 基质金属蛋白酶-9及其抑制因子在胚泡着床中的作用及中医药研究进展[J]. 吉林中医药, 33(1): 100-102.
武军, 孙丽君, 姬明杰, 等. 2013. 基质金属蛋白酶-9在妊娠高血压疾病中的作用[J]. 疑难病杂志, 12(2): 146-147.
杨中玫, 罗欣, 白冰, 等. 2013. KLF8在人早孕绒毛组织中的表达及其意义[J]. 重庆医科大学学报, 38(10): 1133-1137.
姚益群, 刘莉萍, 傅丹, 等. 2014. 胶质瘤患者肿瘤组织和血浆中MMP-9的表达及意义[J]. 中华神经外科疾病研究杂志, 13(4): 322-325.
余薇, 周鹏程. 2012. MMP-2、TIMP-2与子宫腺肌病相关性研究的进展[J]. 求医问药(下半月), 10(3): 383.
张彪, 陈仙. 2011. MMPs、TIMPs与膀胱癌侵袭和转移的研究进展[J]. 社区医学杂志, 9(4): 33-35.
张博, 石娇, 胡建民. 2005. MMPs及其在胚胎着床中作用的研究进展[J]. 上海畜牧兽医通讯, 20(6): 4-5.
张诚, 刘艳辉. 2015. 侧裂区低级别脑胶质瘤中MMP家族水平的检测及其与预后情况分析[J]. 医学综述, 21(17): 3210-3212.
张贺军, 朱军. 2014. CXCR7和MMPs与胶质瘤关系研究进展[J]. 河北联合大学学报(医学版), 16(2): 188-190.
张省, 叶彬, 丁之德. 2014. 哺乳动物胚胎植入分子机制的研究进展[J]. 国际生殖健康/计划生育杂志, 33(5): 396-400.
赵红彩, 钟慧芳, 刘燕飞, 等. 2010. 早期妊娠的丢失与MMP-2、MMP-9及TIMP-1、TIMP-2的研究进展[J]. 中国优生与遗传杂志, 18(10): 118-119.
赵娟, 陈隈陟, 马唯, 等. 2012. MMP-9及C-erbB-2蛋白在卵巢上皮性肿瘤中的表达及其意义[J]. 中国妇产科临床杂志, 13(6): 461-462.
Chen SP, Li HX. 2011. The extra cellular regulated kinase 1/2 is involved in the inhibition of matrix metalloproteinase-9 by transforming grouth factor-β1in trophoblast cells[J]. Chinese Journal of Cell Biology, 33(6): 658-666.
Hu D, Cross JC. 2010. Development and function of trophoblast giant cells in the rodent placenta[J]. International Journal of Developmental Biology, 54(2-3): 341-354.Kent LN, Ohboshi S, Soares MJ. 2012. Akt1 and insulin-like growth factor 2 (Igf2) regulate placentation and fetal/postnatal development[J]. International Journal of Developmental Biology, 56(4): 255-261.
Lagu MN, Detmar J, Paquet M,etal. 2010. Decidual PTEN expression is required for trophoblast invasion in the mouse[J]. AJP Endocrinology & Metabolism, 299(6): E936-946.
Luo W, Liu Z, Tan D,etal. 2013. Gamma-amino butyric acid and the a-type receptor suppress decidualization of mouse uterine stromal cells by down-regulating cyclin D3[J]. Molecular Reproduction & Development, 80(1): 59-69.
Maltepe E, Bakardjiev AI, Fisher SJ. 2010. The placenta: transcriptional, epigenetic, and physiological integration during development[J]. Key Engineering Materials, 120(4): 1016-1025.
Morgan J, Rouche A, Bausero P,etal. 2010. MMP-9 overexpression improves myogenic cell migration and engraftment[J]. Musde & Nerve, 42(4): 584-595.
The Expression Pattern of Matrix Metalloproteinase-9 and Tissue Inhibitor of Metalloproteinase-1 in Placentation of Pregnant Mice
WEI Mengmei1, WU Shuguang2, ZHAO Hai2*
(1. The Pharmacy College, Guiyang College of Traditional Chinese, Guiyang 550002, China;2. Institute of Laboratory Animal, Guiyang College of Traditional Chinese, Guiyang 550002, China)
Objective To study the expression pattern of matrix metalloproteinase-9 (MMP-9) and tissue inhibitor of metalloproteinase-1 (TIMP-1) in placentation of pregnant mice. Methods HE staining was used to check the morphological structure of placentas during pregnancy (day 9~day 14). Besides, the expression levels of MMP-9 and TIMP-1 in placentation were detected by using immunohistochemistry. Results The morphological structure of placenta began to form on day 11, which was constituted of decidua basalis (Dec), spongiotrophoblast (Sp), and labyrinth (Lab) of pregnant mice; the area of Dec was decreased, whereas the area of Sp and Lab were increased with the increasing of pregnancy days; the expression of MMP-9 and TIMP-1 were mainly distributed in cytoplasm and cell nucleus, which was strong expressed in ecto-placental cone of placenta on day 9 and day 10, the Dec, Sp from day 10 to 13 and trophoblast giant cells from day 11 to 13. The integrated optical density (IOD) of MMP-9 in Lab of day 11, in Dec and Lab of day 12, and in placenta of day 13 were significantly higher than that of day 14 (P<0.05); IOD of TIMP-1 in Dec during day 9 to 12 was significantly lower than that of day 14 (P<0.05); the ratio of MMP-9/TIMP-1 in Dec on days 9 and 11 and in Lab on day 12 were significantly higher than that of day 14 (P<0.05); the ratio of MMP-9/TIMP-1 in Dec on days 10 and 12 and in Lab on day 13 were also very significantly higher than that of day 14 (P<0.01). Conclusion MMP-9 and TIMP-1 may play an important role in regulating the formation of the placenta by collaborative expression.
matrix metalloproteinases; tissue inhibitor of metalloproteinases; placenta; ectoplacental cone
2016-04-03 接受日期:2016-07-05
魏孟梅, 硕士研究生, 从事药物毒理研究, E-mail:1432016508@qq.com
*通信作者Corresponding author, 硕士, 助理实验师, 从事胎盘形成研究, E-mail:344947218@qq.com
10.11984/j.issn.1000-7083.20160072
Q954
A
1000-7083(2016)05-0703-06

