大肠侧向发育型肿瘤的诊断与内镜治疗进展
林良兜 卢杰夫 李超芹
(1 广西中医药大学,南宁市 530001;2 广西中医药大学第一附属医院,南宁市 530023;3 南方医科大学珠江医院,广州市 510280)
·综 述·
大肠侧向发育型肿瘤的诊断与内镜治疗进展
林良兜1卢杰夫2*李超芹3
(1 广西中医药大学,南宁市 530001;2 广西中医药大学第一附属医院,南宁市 530023;3 南方医科大学珠江医院,广州市 510280)
大肠侧向发育型肿瘤是一种新类型大肠肿瘤,因病变形态及发生、发展上存在一定的特殊性,与一般的腺瘤不同, 癌变率较高,与大肠癌发生密切相关,其发生率并不低,近年来对其研究增多。本文根据国内外相关文献报道,就其诊断与内镜治疗等方面的研究进展作一综述。
大肠侧向发育型肿瘤;内镜治疗;组织病理;综述
大肠侧向发育型肿瘤(laterally spreading tumor,LST)是指直径超过10 mm且发生在大肠黏膜表面的平坦或隆起病变,这种病变主要沿着大肠黏膜表面侧向生长,很少垂直侵犯大肠壁的深层。由于这类肿瘤的病变形态、发生发展有特殊性,故目前单独进行研究较多。LST与大肠癌的发生关系密切,由于其自身特点,普通内镜下易发生漏诊,必须结合其病变组织形态及病理亚型多样化特征。因此,医务人员应充分重视该病的诊治。
1 大肠侧向发育型肿瘤的概念
大肠侧向发育型肿瘤(laterally spreading tumor,LST)于1993年由日本医学家工藤英进首先提出[1],该病最初概念比较混乱,对其有多种不同命名,对病症的描述也很不准确。起初称大肠黏膜的颗粒集簇样病变,亦名为葡行性肿瘤、表浅扩张型肿瘤、花瓣样病损、毯样病损等[1]。这类疾病发病特点主要沿黏膜面侧向表浅生长,极少向肠壁深层垂直生长。近年来随着研究的不断深入,还发现有非颗粒型病变存在,包括扁平隆起型及假凹陷型,这两类病变无颗粒分布,且表面平坦,然而具备LST的其他特点。因此,1998年Kudo等[2]重新定义LST为:直径10 mm以上的、呈侧向扩展而非垂直生长的一类表浅型病变,包括颗粒集簇样病变及非颗粒型病变。这一定义存在三个含义:①病变直径必须>10 mm;②生长方式为侧向扩展而非垂直生长;③形态特征包括颗粒型及非颗粒型。依其定义看来,这是个形态学概念,病变存在有良、恶性之分。除此外,定义中并未限定病变部位,其实LST易发生在直肠及升结肠、回盲部,也可发生于消化道其他部位,如胃、食管等处。
2 大肠侧向发育型肿瘤内镜下分型
LST在内镜下观察,可分为两种类型:非颗粒型LST(LST-NG)及颗粒型LST(LST-G )[3],前者分为扁平隆起型(LST-F)和假凹陷型(LST-P)[4],后者分为颗粒均一型和结节混合型。非颗粒型呈扁平样改变,表面无颗粒,周边常呈伪足样向四周突出,其整体外观类似于花瓣状;假凹陷型呈扁平状外观,其中央部分也可见轻度凹陷改变,为最少见类型,由于其黏膜病变轻微,内镜下识别困难,故极易漏诊。内镜下颗粒均一型表面颗粒均一,大小形态基本一致,直径一般<3 mm;结节混合型表面亦呈颗粒状,但颗粒大小不一,病变周边或中央混杂有较大的结节样颗粒,其最大直径常>3 mm。为了进一步证明LST假凹陷型与凹陷型是否为同一类型肿瘤,Ohno等[5]比较两者后的结果表明,假凹陷型肿瘤比凹陷型直径更大,黏膜下浸润、血管浸润、淋巴结转移更少,边缘呈替代生长,更倾向水平生长,故可作为一种独立、新类型肿瘤。朱浩等[6]报道124个LST病变中颗粒均一型44个(35.5%),结节混合型48个(38.7%),平坦隆起型23个(18.5%),假凹陷型9个(7.3%),颗粒型LST发病率高,与早先南方医院和日本学者的报道以颗粒型为多[7]基本一致。
3 大肠侧向发育型肿瘤的组织病理学
目前通常采用Morson的组织学分类法,结肠息肉的组织病理可分为腺瘤性肿瘤、癌变、炎症性和增生性,其中腺瘤性肿瘤又可分为管状、绒毛状、管状绒毛状和锯齿状。对于腺瘤的分型,采用1979年Shinya的标准:以占绒毛成分多少界定,25%以下者为管状腺瘤,25%~75%为混合状腺瘤,75%者为绒毛状腺瘤;而锯齿状腺瘤则定义为一定程度的锯齿状腺体,腺体有异型增生,存在有未成熟的杯状细胞。
在组织病理上,LST主要表现为黏膜癌、腺瘤,而腺瘤包括管状、绒毛状腺瘤及管状绒毛状腺瘤,部分病变内有高级别上皮内瘤变[1],故LST存在良恶性之分。经动态观察发现,即使是良性的LST病变,3年之内也有可能演变为进展期大肠癌[8],而且不同类型的LST,其恶变几率也不同。Teixeira等[9]研究指出,LST-NG与隆起型腺瘤、LST-G相比,恶性潜能更高,但与病变大小无关,这在大肠癌的发生中具有指导意义。尽管LST-G直径大,与隆起型腺瘤相比,却并未表现出更高的恶性潜能。与其他类型的LST及隆起型腺瘤相比,结节混合型与假凹陷型的LST存在更高的恶性潜能,可能存在特殊发生机制,有待进一步研究。工藤进英[10]对428例大肠侧向发育型肿瘤黏膜下癌进行发生率总结,颗粒均一型癌占0.7%,结节混合型如果病变超过2 cm时,发生率明显增高,超过20%;扁平隆起型癌占6.3%,而假凹陷型当病变大于2 cm时,癌发生率达46%。LST发生腺瘤的类型多表现为绒毛管状腺瘤伴不同程度不典型增生或者癌变[11]。朱浩等[6]也发现了结节混合型病变直径超过20 mm时高的癌变率(5/30),以及假凹陷型病变直径超过20 mm时高的癌变率(2/5),病理类型多以绒毛管状腺瘤(50%)及绒毛状腺瘤(26.6%)为主,同时病变直径越大,重度不典型增生者所占的比重大。
4 大肠侧向发育型肿瘤的内镜诊断
LST为直径≥10mm、生长方式为侧向扩展而非垂直生长为其特点。该病内镜下主要表现为黏膜局限性色泽变化,如淡红、褪色、局部易出血、局部血管透见像消失、局部变形等。如内镜下发现上述病变,可行黏膜抬举实验、空气变形实验、染色放大内镜检查及超声内镜检查等进一步了解LST的病变浸润程度。
4.1 黏膜抬举实验 当发现病变时,可行黏膜下注射生理盐水,黏膜与黏膜下层能充分分离为阳性,反之则为阴性。
4.2 空气变形实验 当发现病变时,与肠腔进行充气及吸气,观察在这过程中是否存在吸气变形,一般良性病变在吸气过程中病变周围正常黏膜表现为抬高及凹陷部更明显,但如果病变明显累及黏膜下层,使受累组织固定、变硬,吸气变形则消失。
4.3 染色放大内镜技术的应用 据LST的生长特点,有时普通内镜诊断比较困难,必须联合应用染色及放大内镜技术,对帮助选择治疗策略至关重要。黏膜染色一般采用0.4%靛胭脂,对可疑病变表面进行喷洒,以使微小平坦、凹陷型病变容易观察。这种染料的优点是不被黏膜吸收,染色后可清楚将病变范围形态显示。当病变范围视野模糊不清或染色质量不佳时,可重新冲洗病灶,再次染色,可获得更好视野及染色效果。对染色后的黏膜行大体观察后,可利用放大肠镜对大肠腺管开口形态进行进一步观察,通过腺管开口可大致了解病变是否为肿瘤性及病变浸润深度如何。腺管开口则按工藤分类法[15],分为以下六型。见表1。
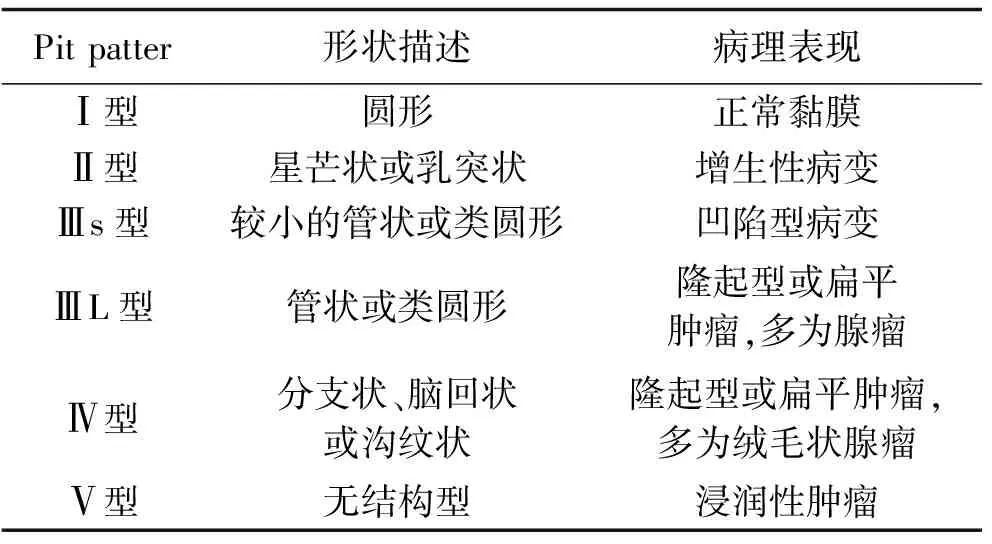
表1 腺管开口分型
由表1可见,不同的腺管开口,其开口形状及发病的病理类型存在差别。医务人员可根据腺管开口的情况初步判断大肠侧向发育型肿瘤的良恶性。因此,染色和放大内镜对肿瘤的早期诊断有很大帮助,对如何治疗肿瘤提供参考依据[16]。
4.4 超声内镜检查 虽然根据腺管开口类型可初步判断腺瘤或癌,但超声内镜检查可在普通内镜观察病变基础上,了解消化道管壁各层次的组织学影像特征和周围邻近脏器的超声影像,同时也更清楚了解癌浸润范围、层次与深度,对指导肿瘤的进一步治疗具有重要作用。
5 大肠侧向发育型肿瘤的内镜治疗
大肠侧向发育型肿瘤与其他结直肠肿瘤的生长方式不同,主要呈侧向发展非垂直生长,早期发现、早期治疗,效果明显。目前国内外治疗LST的首选方法是内镜下治疗,包括EMR、ESD等[17]。
5.1 内镜下黏膜切除术(endoscopic mucosal resection,EMR) EMR是一项结合了内镜息肉切除术和内镜黏膜注射术的内镜操作技术,其基本技巧是:在预备切除的病灶黏膜下方的黏膜下层注射生理水,使黏膜与其下层分离,即抬举征阳性,使切除范围变小而且避免损伤肌层,利用高频电切,切除黏膜层病灶,要求完整保留固有肌层,残基基底为裸露的固有肌层。常见的方法有标准EMR、分片黏膜切除术(Piecemeal EMR,EPMR)、透明帽辅助法EMR等。徐宏伟等[17]报道了18例LST患者中行EMR术10例,病变均完整切除,无1例复发;行EPMR术的6例中5例病变完全切除,1例失败,其中1例复发;行REMR(内镜翻转黏膜切除术)2例,病变完整切除,无复发。陈红莉等[18]报道了30例LST患者中,有21例行EMR术,另外9例行EPMR术,术中无1例发生穿孔,4例术中渗血,予钛夹及APC处理后停止出血;27例术后6个月复查,内镜提示创面愈合良好,均未见肿瘤复发。许秋泳等[19]报道的26例LST患者中有22个病灶行EMR治疗,行EPMR 治疗有9个病灶,有残留的6个病灶通过氩气烧灼辅助治疗,所有病例无严重出血及穿孔发生,术后1~3个月复查内镜,19例创面愈合良好,无肿瘤复发。
EMR治疗LST是一种有效安全的微创技术。术中遇到肿瘤体积较大时,特别是对于良性病变,EMR未能将整块病灶切除,可使用亚离子凝固术对其边缘的残留病变进行凝固治疗。对于术后的病人,随访过程中如果发现病变残留,直径在5 mm以下可用高频电凝固处理,而直径在6 mm可能要考虑再次使用EMR治疗。
5.2 内镜黏膜下剥离术(endoscopic submucosal dissection,ESD) ESD是指利用内镜技术完整地切除消化道黏膜及黏膜下病变的内镜治疗方法。其主要步骤包括标记、黏膜下注射、环形切开及黏膜下剥离等。内镜黏膜下剥离术能够把较大面积、形态不规则的肿瘤完整地从固有肌层剥离下来,明显减少了肿瘤的残留及复发风险。何辉等[22]报道25例LST患者行ESD术,肿瘤均被完整剥离,病灶直径2.5~6.0 cm,平均4.0 cm;ESD手术时间30~150 min,平均 75 mim。术中发生穿孔1例,经钛夹缝合;1例因钛夹脱落迟发性出血再次行内镜下治疗成功。术后平均随访期9.5个月(3~12个月),创面完整愈合,无1例出现残留或复发。付兰英等[23]报道41例 LST行ESD治疗,手术操作时间10.0~115.0(63.2±24.3)min,病灶直径为1.2~12.0(4.0±2.7)cm,整切38例(92.3%),术中穿孔1例(2.40%),术后穿孔1例(2.4%),术后出血2例(4.8%),术后直肠狭窄1例(2.4%)。随访时间1~34(12.0±9.7) 个月,残余灶1例,复发2例(4.9%),治愈40例(97.6%)。
6 切除标本的处理
LST术后,对于病理标本要做好远近端的标记,其表面黏液要用10%盐水冲洗,然后使用丁嗅东莨菪碱浸泡标本1~2 min,最后将其完整固定在薄泡沫板上,再用4%甲醛浸泡固定及水洗后,将其用0.2%甲酚紫染色后判断大肠黏膜腺管开口,并且与放大内镜结果做比较。根据比较结果,选取高度可疑癌变部位进行组织病理分析[24]。
7 并发症的处理
对LST进行内镜手术,一般首选EMR和ESD,其主要并发症都会出现穿孔、出血及感染。其中最严重的并发症为穿孔,ESD相对EMR来讲,穿孔发生率会大些。术中出血一般出血量都比较少,能在可控制范围内,而感染则因EMR和ESD切除的创面比较大,机会相对较高。所以EMR和ESD术后要严密观察患者生命体征、精神意识、大便等情况,注意控制饮食,术后可考虑预防性使用止血药及抗生素[25]。
8 前景与展望
LST是一种新类型特殊肿瘤,该病变特殊的是侧向生长方式而非垂直生长,结合其形态特点,临床诊断有一定难度。因LST与大肠癌的关系密切,临床诊断难度高,提高其诊断技术,将有助于提高大肠癌整体的诊断水平。大部分LST可直接在内镜下微创治疗,这也是LST有别于其他表面生长性肿瘤的一大特点。消化内镜治疗大体积的LST时,如何分离、切除病灶,术中如何止血,这些都是新挑战。随着临床实践的深入及内镜技术的创新与发展,LST的诊断与治疗将会更上一个新台阶,使更多的患者及家属受益。
[1] Kusaka T,Fukui H,Sano Y,et al.Analysis of K-ras codon 12 mutations and p53 overexpression in colorectal nodule-aggregating tumors[J].J Gastroenterol Hepatol,2000,15(10):1151-1157.
[2] Kudo S.About laterally spreading tumor[J].Early Colorectal Cancer,1998,2(5):477-481.
[3] Kuroda K,Kudo S,Kusaka N,et al.A case of a nongranular type of laterally spreading tumor with a pseudo-depressed area[J].Early Colorcctal Cancer,1998,2(5):571-574.
[4] Kudo S,Yamano Y,Tamura T,et al.Laterally spreading tumors[J].Ito Cho(Stomach Intestine),1996,31(6):167-178.
[5] Ohno Y,Terai T,Ogihara T,et al.Laterally spreading tumor: clinicopathological study in comparison with the depressed type of colorectal tumor[J].J Gastroenterol Hepatol,2001,16(7):770-776.
[6] 朱 浩,孙明军.大肠侧向发育型肿瘤内镜下的诊断与治疗[J].临床消化病杂志,2011,23(6):343-346.
[7] 姜 泊,刘思德,智发朝,等.大肠侧向发育型肿瘤25例诊治报告[J].第一军医大学学报,2002,22(2):189-191.
[8] Okamoto T,Tanaka S,Haruma K,et al.Clinicopathologic evaluation on colorectal laterallyspreading tumor(LST)[J].Nihon Shokakibyo Gakkai Zasshi.,1996,93(2):83-89.
[9] Teixeira CR,Tanaka S,Haruma K,et al.Flat-elevated colorectal neoplasms exhibit a high malignant potential[J].Oncology,1996,53(2):89-93.
[10]工藤进英.侧方发育型肿瘤(latcrally spreading tumor,LST)[J].早期大肠癌,1998,2(5):477.
[11]Kusaka T,Fukui H,Sano Y,et al.Analysis or k-ras codon 12 mutations and p53 oyerexprcssion in colorectal nodule-aggregating tumors[J].J Gastroenterol Hepatol,2002,15(10):1151-1157.
[12]贾国法,单 红,朱良松,等.大肠侧向发育型肿瘤的内镜诊治41例分析[J].中华消化内镜杂志,2012,29(2):107-108.
[13]闫振坤,李 颖,张金萍,等.大肠侧向发育型肿瘤患者疾病特征及内镜诊断和治疗价值[J].中国老年学杂志,2014,34(17):4983-4985.
[14]龚 伟,刘思德,智发朝,等.内镜黏膜下剥离术治疗大肠侧向发育型肿瘤的探讨[J].中华消化内镜杂志,2012,29(5):255-258.
[15]Kudo S,Early colorectal cancer-detection of depressed type of colorectal carcinoma[M].Yokyo:igaku-shoin medical publisher,1996:50-51.
[16]姜 泊,智发朝,刘思德,等.采用腺管开口分型和内镜黏膜切除术诊治大肠肿瘤[J].中华医学杂志,2003,83(4):35-38.
[17]徐宏伟,李 岩,陆喜荣.内镜下治疗在大肠侧向发育型肿瘤中的应用[J].胃肠病学和肝病学杂志,2013,22(11):1138-1140.
[18]陈红莉,唐建光.内镜下诊断与治疗大肠侧向发育型肿瘤[J].四川医学,2014(1):129-131.
[19]许秋泳,许向农,陈俊杰,等.大肠侧向发育型肿瘤内镜下的诊断及治疗[J].中国消化内镜,2009,3(4):5-9.
[20]张志坚,徐明符,詹磊磊,等.ESD联合EMR治疗较大大肠侧向发育型肿瘤9例诊治体会[J].现代消化及介入诊疗,2013,18(2):99-101.
[21]彭 学,樊超强,于 劲,等.大肠侧向发育型肿瘤的内镜下分型与术后病理的相关性分析[J].第三军医大学学报,2014,36(24):2489-2491.
[22]何 辉,沈 磊.内镜黏膜下剥离术治疗大肠侧向发育型息肉25例[J].临床消化病杂志,2011,23(6):347-348.
[23]付兰英,王 雷,杨小军,等.内镜黏膜剥离术治疗41例大肠侧向发育型肿瘤的疗效分析[J].第三军医大学学报,2012,34(21):2200-2203.
[24]林 吟.大肠侧向发育型肿瘤(LST)临床病理及内镜治疗的回顾性研究[D].福州:福建医科大学,2012.
[25]李秀梅,李宝玉,刘 明,等.内镜黏膜下剥离术治疗直肠巨大扁平病变的护理体会[J].中国内镜杂志,2013,19(3):298-301.
[26]龚 伟,黄应龙,苏秉忠,等.结直肠侧向发育型肿瘤的临床病理特征[J].现代消化及介入诊疗,2014,19(4):230-233.
[27]袁 珂,吴俊超.内镜反转黏膜切除术治疗超低位直肠大型侧向发育型肿瘤[J].华西医学,2013,28(3):327-330.
[28]王艳红.内镜和腹腔镜联合应用在治疗较大大肠侧向发育型肿瘤中的临床价值[J].世界华人消化杂志,2014,22(33):5193-5197.
[29]张 晨,徐美东,姚礼庆,等.内镜黏膜下剥离术治疗直肠侧向发育型肿瘤的临床价值(附视频)[J].中华结直肠疾病电子杂志,2014,3(6):447-452.
[30]李尚日,李艳霞,沈 磊,等.内镜智能分光比色技术定位下EMR及ESD治疗大肠侧向发育型肿瘤的疗效比较[J].临床消化病杂志,2014,26(2):87-90.
[31]王晓天,单 红,张 迪,等.内镜分片黏膜切除术治疗巨大结直肠平坦型病变的临床评价及复发率随访[J].胃肠病学和肝病学杂志,2014,23(8):970-973.
林良兜(1982~),男,在读全日制研究生,主治医师,研究方向:消化系统疾病的内镜诊断与介入治疗。
R 735.34
A
1673-6575(2016)03-0367-04
10.11864/j.issn.1673.2016.03.18
2016-03-12
2016-05-11)
*通讯作者

