苦杏仁苷对HSC-T6细胞分泌作用的影响
骆欢欢,赵昉,张奉学,刘妮
广州中医药大学,广东 广州 510006
苦杏仁苷对HSC-T6细胞分泌作用的影响
骆欢欢,赵昉,张奉学,刘妮
广州中医药大学,广东 广州 510006
目的:观察苦杏仁苷对肝星状细胞(HSC)-T6细胞Ⅰ型胶原mRNA、Ⅲ型胶原mRNA活化,以及Ⅰ型胶原、透明质酸等分泌的影响。方法:将HSC-T6细胞系分为以下4组,每组细胞均置于6孔板中。4组分别为:正常组,苦杏仁苷高剂量(10-3mol/L)组,苦杏仁苷中剂量(10-4mol/L)组和苦杏仁苷低剂量(10-5mol/L)组。RT-PCR检测Ⅰ型胶原mRNA、Ⅲ型胶原mRNA,酶联免疫法检测HSC-T6Ⅰ型胶原的分泌,放射免疫法检测透明质酸的含量。结果:各苦杏仁苷组对Ⅰ型胶原基因表达均有明显的抑制作用,与正常组比较,差异均有统计学意义(P<0.05)。以苦杏仁苷中剂量组最为明显,苦杏仁苷高剂量组次之,苦杏仁苷低剂量组再次之。提示苦杏仁苷对HSC-T6细胞Ⅰ型胶原mRNA表达有明显的抑制作用,但这种抑制作用或并不与剂量成正比。各苦杏仁苷组对Ⅲ型胶原基因表达均有明显的抑制作用,与正常组比较,差异均有统计学意义(P<0.05)。以苦杏仁苷高、中剂量组明显,苦杏仁苷低剂量组次之。24 h时,Ⅰ型胶原的OD450值苦杏仁苷各组与正常组比较,差异均无统计学意义(P> 0.05)。72 h时,苦杏仁苷各组与正常组比较,差异均有统计学意义(P<0.05),但苦杏仁苷各组组间比较,差异无统计学意义(P>0.05)。正常组透明质酸分泌曲线与苦杏仁苷低剂量组稍有重叠,位置较苦杏仁苷高、中剂量组分泌曲线高。但24 h、72 h时,4组透明质酸含量比较,差异均无统计学意义(P>0.05)。96 h时,苦杏仁苷高、中剂量组比较,差异有统计学意义(P< 0.05),其余组间比较,差异仍无统计学意义(P>0.05)。结论:苦杏仁苷对HSC-T6细胞活化后的细胞外基质(ECM)分泌功能有明显的抑制作用,此可能是其抗肝纤维化的主要机制之一。
肝纤维化;肝星状细胞(HSC);苦杏仁苷;分泌
肝纤维化的发展是细胞外基质(ECM)合成增加且同时降解减少的结果。肝星状细胞(HSC)的活化是肝纤维化发生的中心环节,HSC的分泌作用导致ECM大量合成。本实验观察苦杏仁苷对HSC-T6细胞Ⅰ型胶原mRNA、Ⅲ型胶原mRNA活化,以及Ⅰ型胶原、透明质酸等分泌的影响。报道如下。
1 实验材料
1.1 实验细胞 HSC-T6细胞株,由广州中医药大学热带医学研究所病毒室冻存复苏。
1.2 实验药物 苦杏仁苷购自中国药品生物制品检定所,每支约20 mg,分子量457.4,编号:110820-200403。在实验前对苦杏仁苷水溶物进行低温间歇灭菌,-20℃保存备用。临时配成所需的药物溶度,且用5%血清的高糖DMEM培养液稀释。即用DMEM培养基溶解药物为20 mmol/L母液浓度后,以微孔滤膜过滤除菌,-20℃保存备用。
1.3 主要试剂 高糖DMEM培养液HEPEPS购自美国GIBCO公司;胎牛血清购自杭州四季清生物制品公司;L-谷氨酰胺、二甲基亚砜(DMSO)和胰蛋白酶均购自Sigma公司;EDTA购自上海生物工程公司,由Amresco进口分装;青霉素、链霉素购自华北制药有限公司。TIANGEN RNA提取试剂盒、反转录试剂盒、dNTP、RNA酶抑制剂、Oligo-dt均为TIANGEN公司产品。DNA Marker、PCR试剂盒、优化PCR试剂盒为天为时代生物技术公司产品。透明质酸放射免疫试剂盒购自北京北方生物技术研究所(批号:20091020)。Ⅰ型胶原ELISA试剂盒购自Bioscience Laboratories,R&D公司分装(批号:E0900951)。
1.4 主要仪器 YJ-875型净化工作台,苏州净化设备公司;细胞培养瓶、细胞培养板,Corning美国公司;细胞计数板、微孔滤膜(0.45 μm、0.2 μm),上海半岛实业有限公司;Leica荧光生物显微镜,倒置显微镜(Olympus BX600);-86℃超低温冰箱,美国Revco;美国SHELDON2300-2E型电热恒温二氧化碳培养箱;美国宝特ELX800型全自动酶标仪;美国UNO的PCR仪;上海原子核所日环仪器TSN-695B型放射免疫γ测量仪。
1.5 引物及序列 Ⅰ、Ⅲ型胶原引物由INVITROGEN公司合成。引物序列如下:Ⅰ型胶原引物:上游:5'-CAT AAA GGG TCA TCG TGG CTT C-3',下游:5'-GTG ATA GGT GAT GTT CTG GGA G-3';Ⅲ型胶原引物:上游:5'-CGA GGT AAC AGA GGTGAA AGA-3',下游:5'-AAC CCA GTATTC TCC AGT CTT-3'。β-actin引物:上游:5'-TGG TGG GTA TGG GTC AGA AGG ACT C-3',下游:5'-CAT GGC TGG GGTGTTGAAGGTCTCA-3'。
2 实验方法与统计学方法
2.1 细胞分组 HSC-T6细胞系是由大鼠HSC经过SV40病毒转染后形成的永生细胞系,具有无限传代的特性。本研究将HSC-T6细胞系分为以下4组,每组细胞均置于6孔板中。4组分别为:正常组,苦杏仁苷高剂量(10-3mol/L)组,苦杏仁苷中剂量(10-4mol/L)组和苦杏仁苷低剂量(10-5mol/L)组。
2.2 RNA的提取 在6孔板中接种1×106HSC-T6细胞,用含有5%胎牛血清的DMEM培养基,使细胞贴壁生长,至铺满50%面积后更换培养液。同时按前述分组剂量加入干预药物。每个药物浓度做6个复孔,同时做不加药物的正常组。细胞经药物作用48 h后,进行消化、收集,采用TIANGEN总RNA提取试剂盒,参照试剂盒说明书提取细胞总RNA。取细胞加1 mL裂解液,混匀后静置5 min,加入200 μL三氯甲烷,剧烈震荡 30 s,静置 10 min,4℃12000 rpm离心10 min。取上清加1/2体积无水乙醇,静置2 min,后转入离心柱中,4℃12000 rpm离心30 s。然后加入0.5 mL去蛋白液,静置2 min后4℃离心30 s,加入漂洗液0.7 mL,静置2 min,4℃离心30 s,再加入0.5 mL的漂洗液,同上。转收集管后空离心柱4℃12000 rpm离心2 min后,干燥RNA 10 min。加入无RNA酶水50 μL,静置2 min,4℃12000 rpm离心,收集离心液-70℃保存备用。
2.3 RT-PCR检测 反应体系为20 μL,内含cDNA 4 μL,10×buffer 2 μL,dNTP(10 mol/L)0.4 μL,上、下游引物各0.2 μL,Taq酶 0.5 U,用水补至20 μL。用 PCR仪扩增。PCR反应的条件为:94℃预变性2 min,94℃变性30 s,58℃退火30 s,72℃延伸45 s,30个循环后,72℃延伸10 min,4℃保温。PCR产物在3%琼脂糖凝胶上电泳后,采用凝胶成像分析仪进行扫描,观察条带的灰度强弱。
2.4 酶联免疫(ELISA)法检测 细胞按1×105接种于48孔板中,每孔0.3 mL,代细胞汇合达60%后弃上清,加入经过2%DMEM稀释的含药培养基0.3 mL。每个浓度接种8个复孔。加药24 h后吸取上清(每个浓度吸4个复孔),72 h后吸取另4个复孔。按试剂盒说明书操作检测HSC-T6细胞Ⅰ型胶原的分泌。
2.5 放射免疫法检测 细胞培养上清液每24 h收集1次,以放射免疫法检测上清液中透明质酸的含量。
3 实验结果
3.1 4组RT-PCR检测Ⅰ型胶原mRNA表达比较 见图1、表1。各苦杏仁苷组对Ⅰ型胶原基因表达均有明显的抑制作用,与正常组比较,差异均有统计学意义(P<0.05)。以苦杏仁苷中剂量组最为明显,苦杏仁苷高剂量组次之,苦杏仁苷低剂量组再次之。提示苦杏仁苷对HSC-T6细胞Ⅰ型胶原mRNA表达有明显的抑制作用,但这种抑制作用或并不与剂量成正比。
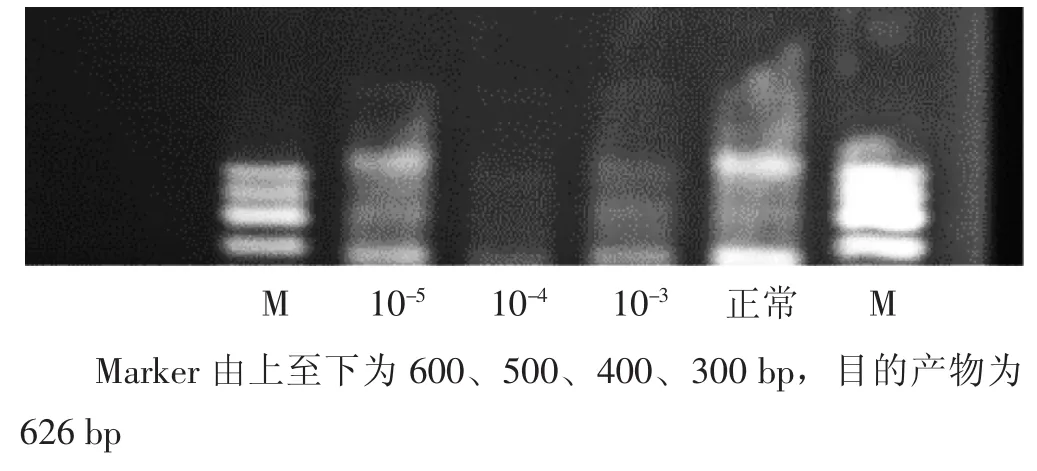
图1 各组Ⅰ型胶原mRNA电泳结果图
表1 4组RT-PCR检测Ⅰ型胶原mRNA表达比较()
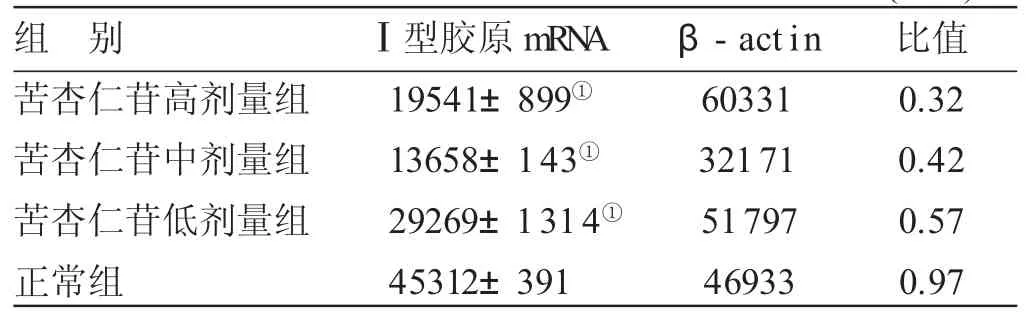
表1 4组RT-PCR检测Ⅰ型胶原mRNA表达比较()
与正常组比较,①P<0.05
组别苦杏仁苷高剂量组苦杏仁苷中剂量组苦杏仁苷低剂量组正常组Ⅰ型胶原m R N A 1 9 5 4 1 ± 8 9 9①1 3 6 5 8 ± 1 4 3①2 9 2 6 9 ± 1 3 1 4①4 5 3 1 2 ± 3 9 1 β -a c t i n 6 0 3 3 1 3 2 1 7 1 5 1 7 9 7 4 6 9 3 3比值0 . 3 2 0 . 4 2 0 . 5 7 0 . 9 7
3.2 4组RT-PCR检测Ⅲ型胶原mRNA表达比较 见图2、表2。各苦杏仁苷组对Ⅲ型胶原基因表达均有明显的抑制作用,与正常组比较,差异均有统计学意义(P<0.05)。以苦杏仁苷高、中剂量组明显,苦杏仁苷低剂量组次之。提示苦杏仁苷对HSC-T6细胞Ⅲ型胶原mRNA表达有明显的抑制作用,但这种抑制作用也不与剂量明显成正比。
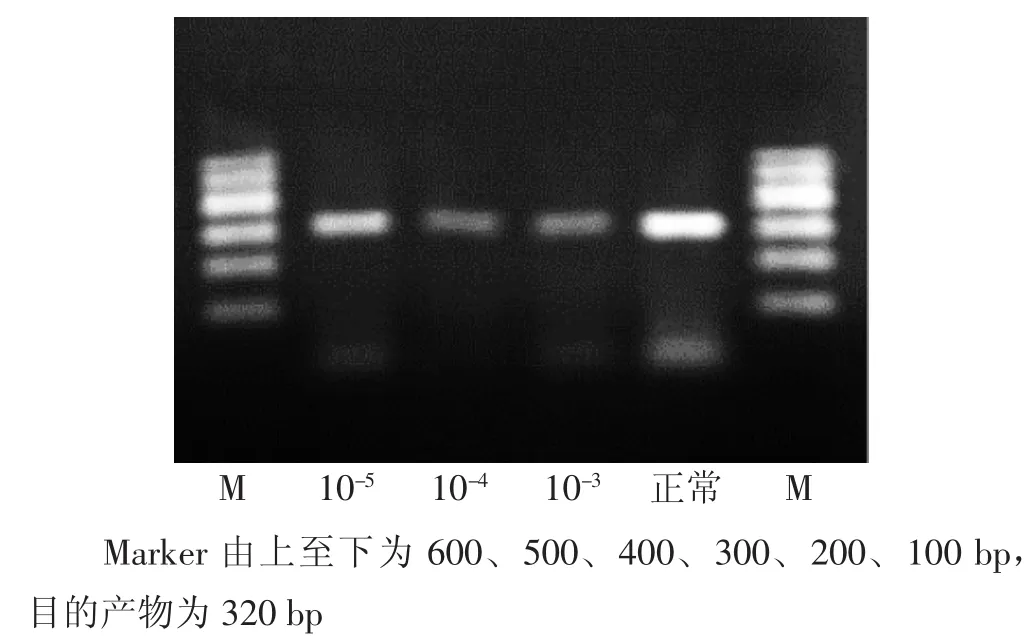
图2 各组Ⅲ型胶原mRNA电泳结果图
表2 4组RT-PCR检测Ⅲ型胶原mRNA表达比较()

表2 4组RT-PCR检测Ⅲ型胶原mRNA表达比较()
与正常组比较,①P<0.05
组别苦杏仁苷高剂量组苦杏仁苷中剂量组苦杏仁苷低剂量组正常组Ⅲ型胶原m R N A 1 8 4 3 2 ± 6 7 7①1 7 0 6 7 ± 3 9 1①2 8 4 1 6 ± 1 1 1 6①4 0 7 0 4 ± 2 5 6 β -a c t i n 6 0 3 3 1 3 2 1 7 1 5 1 7 9 7 4 6 9 3 3比值0 . 3 1 0 . 5 3 0 . 5 5 0 . 8 7
3.3 4组ELISA法检测Ⅰ型胶原比较 见表3。24 h时,Ⅰ型胶原的OD450值苦杏仁苷各组与正常组比较,差异均无统计学意义(P>0.05)。72 h时,苦杏仁苷各组与正常组比较,差异均有统计学意义(P<0.05),但苦杏仁苷各组组间比较,差异无统计学意义(P>0.05)。提示苦杏仁苷作用72 h后对Ⅰ型胶原的分泌有明显抑制作用,这一作用不呈现剂量依赖。
表3 4组ELISA法检测Ⅰ型胶原比较()
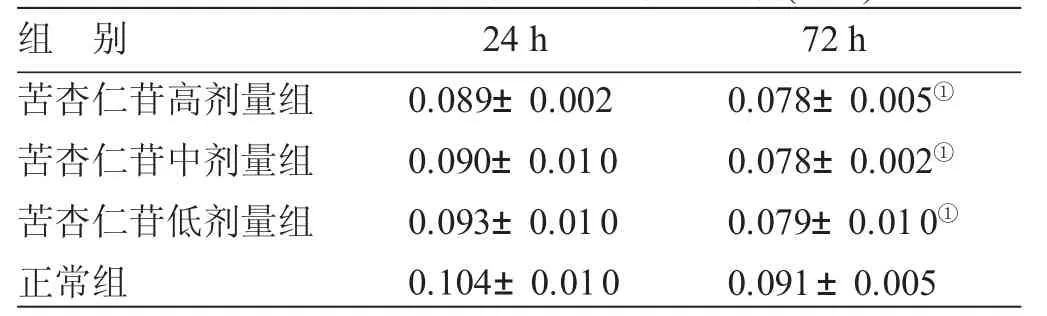
表3 4组ELISA法检测Ⅰ型胶原比较()
与正常组比较,①P<0.05
组别苦杏仁苷高剂量组苦杏仁苷中剂量组苦杏仁苷低剂量组正常组2 4 h 0 . 0 8 9 ± 0 . 0 0 2 0 . 0 9 0 ± 0 . 0 1 0 0 . 0 9 3 ± 0 . 0 1 0 0 . 1 0 4 ± 0 . 0 1 0 7 2 h 0 . 0 7 8 ± 0 . 0 0 5①0 . 0 7 8 ± 0 . 0 0 2①0 . 0 7 9 ± 0 . 0 1 0①0 . 0 9 1 ± 0 . 0 0 5
3.4 4组放射免疫法检测透明质酸含量比较 见表4、图3。24 h的苦杏仁苷高剂量组、苦杏仁苷中剂量组各有1孔因处理不当干竭,其值被剔除。正常组分泌曲线与苦杏仁苷低剂量组稍有重叠,位置较苦杏仁苷高、中剂量组分泌曲线高,提示苦杏仁苷高、中剂量组均有抑制透明质酸分泌的趋势。但24 h、72 h时,4组透明质酸含量比较,差异均无统计学意义(P>0.05)。96 h时,苦杏仁苷高、中剂量组比较,差异有统计学意义(P<0.05),其余组间比较,差异仍无统计学意义(P>0.05)。提示苦杏仁苷对透明质酸分泌可能有一定的抑制作用,但效果并不显著,也不呈现明显的剂量依赖。
表4 4组放射免疫法检测透明质酸含量比较() ng/mL
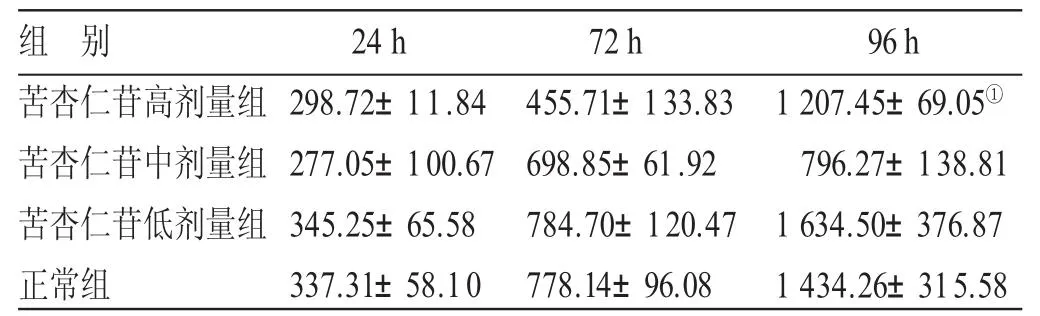
表4 4组放射免疫法检测透明质酸含量比较() ng/mL
与苦杏仁苷中剂量组同期比较,①P<0.05
组别苦杏仁苷高剂量组苦杏仁苷中剂量组苦杏仁苷低剂量组正常组2 4 h 2 9 8 . 7 2 ± 1 1 . 8 4 2 7 7 . 0 5 ± 1 0 0 . 6 7 3 4 5 . 2 5 ± 6 5 . 5 8 3 3 7 . 3 1 ± 5 8 . 1 0 7 2 h 4 5 5 . 7 1 ± 1 3 3 . 8 3 6 9 8 . 8 5 ± 6 1 . 9 2 7 8 4 . 7 0 ± 1 2 0 . 4 7 7 7 8 . 1 4 ± 9 6 . 0 8 9 6 h 1 2 0 7 . 4 5 ± 6 9 . 0 5①7 9 6 . 2 7 ± 1 3 8 . 8 1 1 6 3 4 . 5 0 ± 3 7 6 . 8 7 1 4 3 4 . 2 6 ± 3 1 5 . 5 8
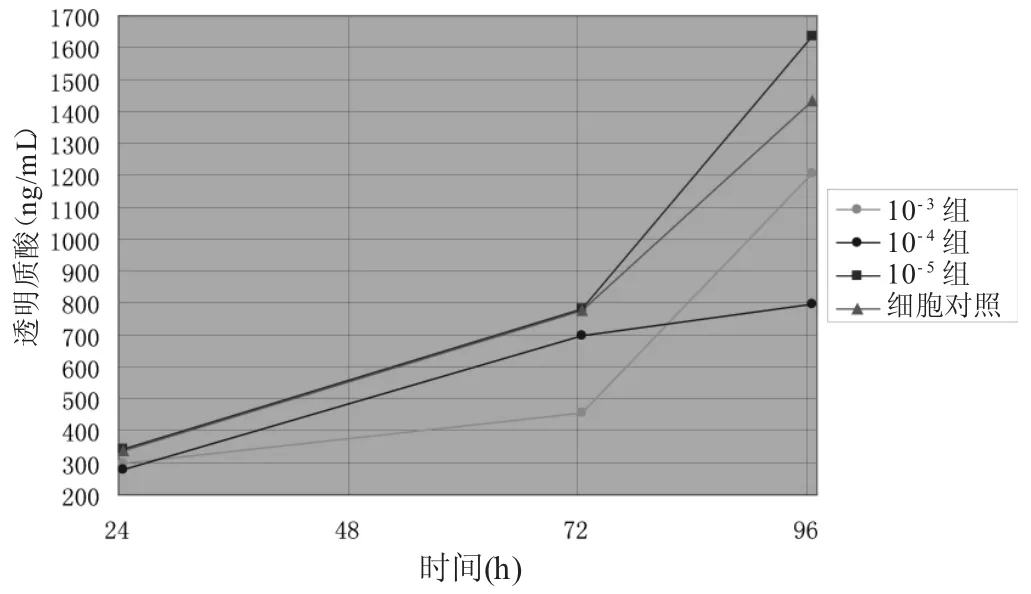
图3 不同浓度苦杏仁苷透明质酸分泌曲线比较
4 讨论
肝纤维化是肝脏在损伤愈合过程中的一种反应,其特征是ECM的过度沉积,其中Ⅰ型胶原、Ⅲ型胶原是ECM的主要成分。HSC致肝纤维化作用的最直接途径是大量ECM的产生。Ⅰ型胶原分子是由2个α1(Ⅰ)链和1个α2(Ⅰ)链组成的异质三联体。在所有类型的肝纤维化中都有Ⅰ型胶原的增生。体外实验结果表明,活化的HSC的Ⅰ型胶原mRNA表达较静止状态时增加60~70倍[1]。免疫组织化学研究也证明,肝硬化大鼠肝脏Ⅰ型胶原蛋白表达明显增加[2]。故目前抗肝纤维化治疗中针对HSC的治疗主要集中于抑制HSC激活、增殖及胶原合成,促进胶原降解。本实验发现,苦杏仁苷对HSC-T6细胞Ⅰ型胶原mRNA表达有明显的抑制作用,对HSC-T6细胞Ⅲ型胶原mRNA表达也有明显的抑制作用,但这种抑制作用不与剂量成正比;同时,HSC-T6细胞分泌Ⅰ型胶原作用的研究也印证了上述结果,在作用72 h后HSC对Ⅰ型胶原分泌有明显抑制作用,且不呈现剂量依赖。提示苦杏仁苷对HSC-T6细胞活化后的ECM分泌功能有明显的抑制作用,此可能是其抗肝纤维化的主要机制之一。
而透明质酸则是反映肝纤维化发生发展动态最灵敏的ECM成分。本实验发现,在24 h、72 h、96 h各不同时间段,苦杏仁苷高、中剂量组均有抑制透明质酸分泌的趋势,提示苦杏仁苷对透明质酸分泌可能有一定的抑制作用,且极为敏感,在48~72 h就已有表现,但效果并不显著,也难以判断是否存在剂量依赖性。另外,本实验过程中,由于24 h的苦杏仁苷高、中剂量组各有1孔处理不当干竭,其值被剔除,也可能导致实验结果的部分偏差。
[1]Failli P,DeFraneo RM,Caligiuri A,et al. Nitrovasodilators inhibit platelet-derived growth factor-induced proliferation and migration of activated human hepatic stellate cells[J].Gastroenterology,2000,119 (2):479-492.
[2]Bedossa P,Ferlicot S,Paradis V,et al.Dystroglycan expression in hepatic stellate cells:role in liverfibrosis[J]. Lab Invest,2002,82(8):1053-1061.
(责任编辑:吴凌)
R285.5
A
0256-7415(2016)03-0224-03
10.13457/j.cnki.jncm.2016.03.088
2015-12-08
广东省自然科学基金课题(S2012010008917)
骆欢欢(1980-),女,副研究员,研究方向:中医临床基础。

