野菊花提取物对KKAy糖尿病小鼠高血糖、高血脂和血醛糖还原酶的影响
陈雁虹,张 娟,艾志鹏,陈 婷
(1.浙江大学实验动物中心,浙江 杭州 310058;2.浙江医学高等专科学校,浙江 杭州 310053)
野菊花提取物对KKAy糖尿病小鼠高血糖、高血脂和血醛糖还原酶的影响
陈雁虹1,张 娟1,艾志鹏1,陈 婷2
(1.浙江大学实验动物中心,浙江 杭州 310058;2.浙江医学高等专科学校,浙江 杭州 310053)
目的 观察野菊花提取物对糖尿病KKAy小鼠血糖和血脂水平的影响,及对醛糖还原酶(AR)的抑制作用。方法 8周龄雄性KKAy小鼠,根据初始空腹血糖随机分为模型组、野菊花提取物20和100 mg·kg-1组及格列美脲0.4 mg·kg-1组,以雄性C57BL/6J小鼠作为正常对照组,每天ig给药1次,连续7周。每周测量小鼠体质量和摄食量,实验结束前测定空腹血糖并进行口服葡萄糖耐量实验(OGTT)。末次给药后禁食过夜,处死小鼠,取血清进行生化检测,ELISA测定血清中胰岛素、瘦素和AR水平,解剖取肝、肾、脾、睾周脂肪和肾周脂肪,测定脏器系数并进行常规病理组织学检查。实时PCR测定肾组织匀浆中AR mRNA表达。结果 与模型组比较,野菊花提取物100 mg·kg-1组小鼠摄食量明显减少(P<0.01),空腹血糖明显降低(P<0.05);OGTT结果表明野菊花提取物可显著抑制葡萄糖吸收(P<0.01),血清谷丙转氨酶、葡萄糖、甘油三酯、胆固醇、低密度脂蛋白胆固醇、胰岛素、瘦素和AR水平明显降低(P<0.05,P<0.01)。组织病理学观察显示,模型组小鼠肝、肾、脂肪、胰腺和脾组织出现不同程度病变,野菊花提取物可抑制糖尿病引起的组织病理变化;同时可降低肾组织AR mRNA表达。结论 野菊花提取物对KKAy小鼠有降血糖和血脂的作用,并能保护因糖尿病引起的肾、肝、脂肪、胰腺和脾损伤,其对肾的保护作用与降低肾组织AR mRNA表达从而抑制AR作用有关。
野菊花;醛糖还原酶;血糖;甘油三酯;胆固醇;
糖尿病是一种因胰岛功能缺失或减退、胰岛素抵抗等引起的慢性代谢综合征,其主要临床表现为高血糖、多饮、多食、多尿和消瘦。我国目前约有1.13亿糖尿病患者[1],糖尿病不仅给患病个体带来了身体和精神上的损害并导致寿命缩短,还给个人和国家带来了沉重的经济负担。
野菊花属于菊科植物野菊,其植物学特点是干燥头状花序。野菊花在我国民间药用历史悠久,应用范围广泛,《本草纲目》中有“菊,味甘,性寒,散风热,平肝明目”的记载,《神农本草经》中描述菊花“主诸风头眩、肿痛、目欲脱,味甘,性寒,散风热,平肝明目”。现代药理学研究发现,野菊花除了清热解毒、疏肝平风和抗菌消炎作用外,还具有提高免疫、保护心血管系统、抗肿瘤、神经保护和清除自由基等诸多功效[2]。野菊花主要化学成分包括萜类、挥发油、黄酮类化合物、多糖、绿原酸、蛋白质、氨基酸、维生素及微量元素等。本研究通过观察野菊花提取物对糖尿病KKAy小鼠血糖和血脂水平的影响及对肾组织醛糖还原酶(aldose reductase,AR)的抑制作用,为野菊花防治糖尿病、延缓糖尿病肾病的发生提供实验依据。
1 材料与方法
1.1 药品、试剂和仪器
野菊花药材产自安徽,由浙江医学高等专科学校生药学吴晓宁副教授鉴定为菊科植物野菊(Chrysanthemum indicumL.)的干燥头状花序(批号:131028),药材粉碎后过60目筛,加入溶剂甲醇,料液比为1∶100,浸泡30 min,加热至80℃回流2 h,提取3次,合并提取液,浓缩得提取物浸膏,4℃冰箱保存。提取物质量控制参照谭晓杰等[3]的方法,反相高效液相色谱法测定浸膏蒙花苷(linarin)含量,将其作为质控标准,回收率为98.4%,蒙花苷含量为2.51%。
格列美脲由赛诺菲(北京)制药有限公司生产,批号AJB052,规格:2 mg。动物组织RNA提取和实时荧光定量试剂盒购自TaKaRa公司;引物由赛默飞世尔科技(中国)有限公司合成;小鼠胰岛素、瘦素和AR酶联免疫试剂盒购自上海朗顿生物科技有限公司;生化试剂盒购自德国罗氏诊断产品有限公司;葡萄糖、甲醛和二甲苯等试剂购自国药集团化学试剂有限公司。Agilent 1260高效液相色谱仪(美国安捷伦公司);Cobas 8000全自动生化分析仪(德国罗氏公司);CFX Connect实时荧光定量PCR仪Model 680酶标仪(美国Bio-Rad公司);One-Touch UltraVue稳豪倍优型血糖仪及试纸(强生医疗器材有限公司);JJ-12J脱水机、JB-P5包埋机和JBL5冻台(武汉俊杰电子有限公司);RM2016石蜡切片机、HI1220烤片机和HI1210摊片机(德国Leica公司);U-25ND6倒置显微镜(日本Olympus公司)。
1.2 动物
SPF级KKAy小鼠28只,雄性,7~8周龄;SPF级C57BL/6J小鼠7只,雄性,7~8周龄;均购自北京华阜康生物科技股份有限公司,生产许可证号:SCXK(京)2014-0004,饲养于浙江大学实验动物中心,使用许可证号SYXK(浙)2012-0178。饲养环境温度22~26℃,湿度40%~70%,明暗交替各12 h,换气次数每小时10~20次,小鼠自由饮水、摄食。KKAy小鼠喂饲以1K65饲料,购自北京华阜康生物科技股份有限公司,生产许可证号SCXK(京)2014-0008;C57BL/6J小鼠喂饲以小鼠生长繁殖饲料,购自上海斯莱克实验动物有限责任公司,沪饲审(2014)04001。实验方案经浙江大学实验动物福利伦理审查委员会审查通过。
1.3 分组和给药
雄性KKAy小鼠28只,禁食6 h,测定空腹血糖,按初始空腹血糖值随机分为4组,分别为模型组,野菊花提取物20,100 mg·kg-1组和格列美脲0.4 mg·kg-1组,以C57BL/6J小鼠为正常对照组,每组7只。每日上午分别ig给药,给药容积为20 mL·kg-1,连续7周。正常对照组和模型组给予同等体积蒸馏水。
1.4 体质量和摄食量的测定
给药期间每7 d称量1次体质量和摄食量,观察小鼠行为体征、自发活动等有无异常。
1.5 空腹血糖和口服葡萄糖耐量实验(oral glucose tolerance test,OGTT)
实验第38天,给药后禁食6 h,剪尾取血,血糖仪测定空腹血糖。第40天,给药后禁食6 h,进行OGTT,小鼠灌胃葡萄糖2 g·kg-1,给药10 mL·kg-1,分别于口服葡萄糖后30,60,90和120 min剪尾取血检测血糖。
1.6 血液生化及胰岛素、瘦素和AR的测定
末次给药后,禁食过夜,处死小鼠,取血清进行生化检测,包括血糖、谷丙转氨酶(glutamic-pyruvic transaminase,GPT)、谷草转氨酶〔glutamicoxal(o)acetic transaminase,GOT〕、甘油三酯(triglycerides,TG)、总胆固醇(total cholesterol,TC)、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)和低密度脂蛋白胆固醇(lowdensity lipoprotein cholesterol,LDL-C)。ELISA试剂盒测定血清中胰岛素、瘦素和AR水平。
1.7 脏器系数计算和病理组织学检查
处死小鼠后,解剖取肝、肾、脾、睾周脂肪和肾周脂肪进行称重,计算其脏器系数〔脏器系数=脏器质量(g)/体质量(g)×100〕。各脏器用10%甲醛溶液固定,进行常规病理取材、制片和HE染色,显微镜下进行病理组织学检查。
1.8 实时PCR检测肾组织AR mRNA表达
按照说明书提取肾组织总RNA,逆转录获得cDNA,在实时PCR专用96孔板中配制标准反应体系,进行SYBR GreenⅠ实时荧光定量PCR扩增,95℃孵育3 min,95℃5 s,60℃30 s,40个循环,融解曲线分析:95℃10 s,65℃5 s。AR引物序列:上游5′-GTCACTTGACGGCACTCAGA-3′;下游5′-ATGCCTCTCCCTTCCAGGAT-3′;β肌动蛋白引物序列:上游5′-ATGACCCAAGCCGAGAAGG-3′;下游5′-CGGCCAAGTCTTAGAGTTGTTG-3′。用基因相对定量法(2-ΔΔCt)计算目的基因相对表达。
1.9 统计学分析
实验结果数据均以x±s表示。采用SPSS13.0统计软件进行分析,组间比较采用t检验。P<0.05认为差异具有统计学意义。
2 结果
2.1 野菊花提取物对小鼠体质量和摄食量的影响
如表1所示,各组小鼠体质量逐渐增加,野菊花提取物100 mg·kg-1组体质量增长较快。第1~4周各给药组体质量与模型组比较无明显差异,第5~6周野菊花提取物100 mg·kg-1组体质量明显高于模型组(P<0.05)。各给药组的摄食量均明显低于模型组(P<0.01)。
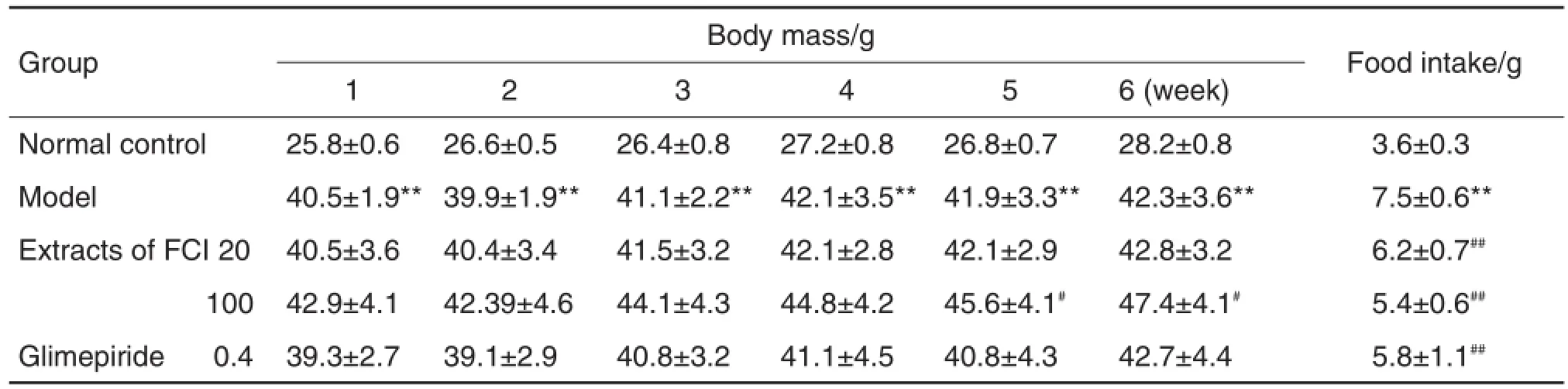
Tab.1 Effect of extract of FlosChrysanthemi indici(FCI)on body mass and food intake of mice
2.2 野菊花提取物对小鼠空腹血糖和OGTT的影响
表2所示,实验前KKAy小鼠各组空腹血糖无明显差异,给药第38天,野菊花提取物20,100 mg·kg-1和格列美脲0.4 mg·kg-1组空腹血糖与模型组比较明显降低(P<0.05)。OGTT实验结果表明,野菊花提取物100 mg·kg-1组0,30,60,90和120 min时血糖均明显低于模型组(P<0.01),曲线下面积明显小于模型组(P<0.01);格列美脲0.4 mg·kg-1组0 min时间点血糖值明显低于模型组(P<0.01),野菊花提取物20 mg·kg-1组与模型组比较作用不明显。
2.3 野菊花提取物对小鼠血液生化指标的影响
如表3所示,与模型组比较,野菊花提取物100 mg·kg-1组GPT明显降低(P<0.05),空腹血糖、TG、TC和LDL-C明显降低(P<0.01),GOT和HDL-C无显著性差异;格列美脲0.4 mg·kg-1组GPT、空腹血糖、TG、TC和LDL-C明显降低(P<0.05),HDL-C和GOT无显著性差异;野菊花提取物20 mg·kg-1组各项生化指标无显著性差异。
2.4 野菊花提取物对小鼠血清胰岛素、瘦素和AR水平的影响
如表4所示,与模型组比较,野菊花提取物20,100 mg·kg-1和格列美脲0.4 mg·kg-1均能显著降低小鼠血清胰岛素、瘦素和AR水平(P<0.05,P<0.01)。

Tab.2 Effect of extract of FCI on fasting glucose and oral glucose tolerance test(OGTT)in mice
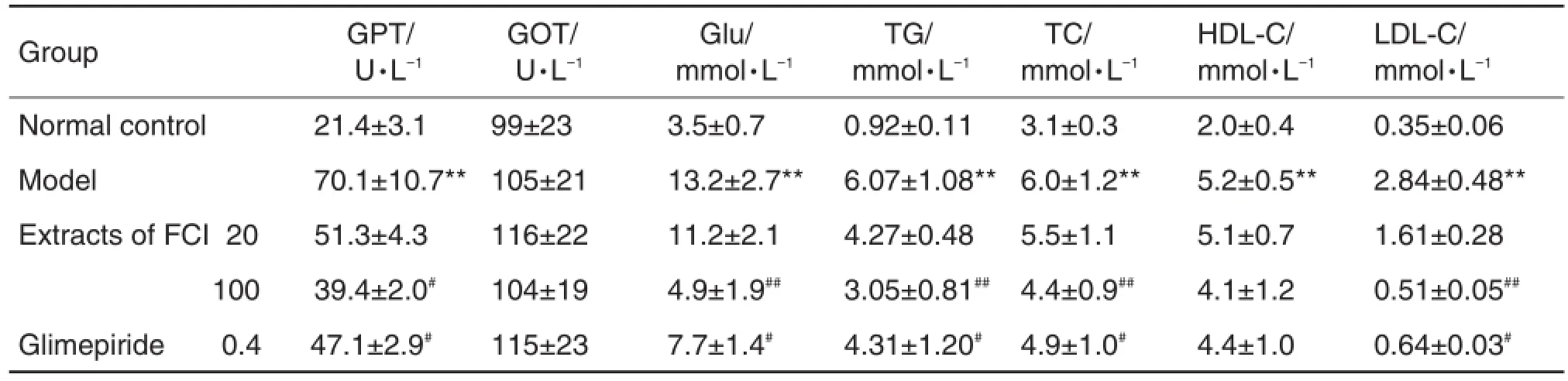
Tab.3 Effect of extract of FCI on blood biochemistry in mice

Tab.4 Effect of extract of FCI on insulin,leptin and aldose reductase(AR)in serum of mice
2.5 野菊花提取物对小鼠脏器系数的影响
如表5所示,与正常对照组相比,模型组肝系数、睾周脂肪与肾周脂肪系数明显增高(P<0.01)。与模型组比较,野菊花提取物100 mg·kg-1组肝系数明显降低(P<0.01),肾系数明显降低(P<0.05),脾系数但明显变化;格列美脲0.4 mg·kg-1组肝和肾系数明显降低(P<0.05);野菊花20 mg·kg-1组肝、脾和肾系数无明显变化。3个给药组对睾周脂肪和肾周脂肪系数的影响均不明显,与模型组比较无明显差异。
2.6 野菊花提取物对小鼠肾组织AR mRNA表达的影响

Fig.1 Effect of extract of FCI on AR mRNA expresion in kidneys detected by real-time PCR.See Tab.1 forthe mouse treatment.x±s,n=7.*P<0.05,compared with normal control group;#P<0.05,compared with model group.
如图1所示,与正常对照组比较,模型组肾组织mRNA表达明显增强(P<0.05)。与模型组比较,格列美脲0.4 mg·kg-1组和野菊花提取物100 mg·kg-1组肾组织AR mRNA表达均明显降低(P<0.05)。
2.7 野菊花提取物对小鼠脏器组织病理变化的影响
显微镜观察结果见图2。正常对照组小鼠肾小球与肾小管组织结构正常,肝、脂肪和胰腺结构无明显异常,脾红髓和白髓结构正常。模型组肾小球细胞数目减少,肾小管上皮细胞空泡变性,部分上皮细胞坏死脱落,肝细胞弥漫性脂变,大小脂滴遍布,脂肪细胞肥大,胰腺胰岛细胞减少,体积减小,少量B细胞空泡变,脾白髓萎缩,甚至消失,滤泡数量减少,体积缩小,管壁细胞核消失。格列美脲0.4 mg·kg-1组肾小球与肾小管组织结构无异常,部分肝细胞有脂肪变性,脂肪细胞与脾细胞结构无异常,胰腺胰岛细胞少量B细胞空泡变。野菊花提取物20 mg·kg-1组肾小球组织结构正常,肾小管上皮细胞轻微空泡变性,肝细胞脂肪变性,大小脂滴共存,脂肪细胞结构正常,胰腺胰岛细胞减少,少量B细胞空泡变,脾白髓萎缩,体积缩小。野菊花提取物100 mg·kg-1组肾小球与肾小管组织结构无异常,脂肪细胞、胰腺和脾结构正常,肝细胞轻微脂肪变性。

Tab.5 Effect of extract of FCI on organ index in mice
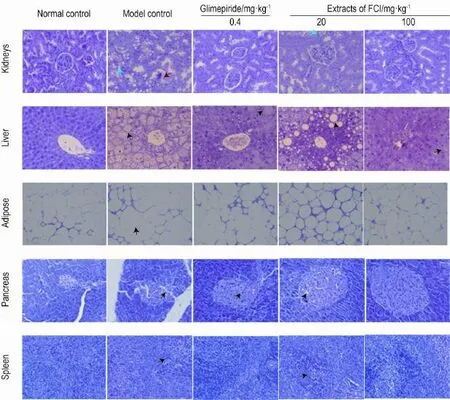
Fig.2 Effect of extract of FCI on histopathological changes of organs in mice(HE staining×200).See Tab.1 for the mouse treatment.Kidneys:the blue arrow refers to renal tubular epithelial cell degeneration,the red arrow refers to the number of glomerular cell reduced;liver:the arrow refers to lipid accumulation;adipose:the arrow refers to hypertrophy of the adipocyte;pancreas:the arrow refers to islet cell degeneration;spleen:the arrow refers to atrophy of white pulp.
3 讨论
我国≥20岁人群中,糖尿病患病率为9.7%,已成为继心脑血管疾病和肿瘤之后另一个严重危害人民健康的重要慢性非传染性疾病[4]。其中约90%为2型糖尿病患者。2型糖尿病通常是由于胰岛β细胞功能障碍造成胰岛素分泌不足或胰岛素敏感性降低导致胰岛素抵抗而引起的。长期的高血糖极易引发血脂异常、高血压和各种糖尿病并发症,包括糖尿病肾病、酮症酸中毒、神经病变、心脏病和视网膜病变等[5]。目前治疗2型糖尿病的药物包括磺酰脲类、双胍类、α-葡萄糖苷酶抑制剂[6]和血管紧张素转移酶抑制剂等,但一些药物在治疗中会出现耐药性或导致心毒性、肝毒性等不良反应[7]。
中国传统中草药具有作用持久、温和和不良反应小的特点。因此,人们开始聚焦从中药中发现对治疗糖尿病更加安全有效的天然药物,如党参、白术、山药和金银花等。我们已有研究表明,野菊花提取物对糖尿病肾病大鼠具有一定的调节血糖和保护肾功能的作用[8]。因此,本研究选择轻度肥胖型2型糖尿病模型KKAy小鼠进行野菊花提取物抗2型糖尿病的进一步研究。
格列美脲为第三代磺脲类口服降糖药物,临床用于治疗2型糖尿病,可改善胰岛素分泌缺陷,并能增加周围组织胰岛素敏感性[9]。因此,本研究选择格列美脲作为阳性对照药物。
研究结果表明,野菊花提取物能明显降低KKAy小鼠血糖和血脂水平,抑制葡萄糖吸收,降低血清胰岛素和瘦素水平。瘦素是脂肪组织中一种特异表达蛋白质,是判断肥胖及相关疾病的重要指标,当人体中存在胰岛素抵抗时,瘦素水平就会显著增高[10]。所以,野菊花提取物对胰岛素和瘦素的调节作用有利于改善胰岛素抵抗。
非酒精性脂肪肝(nonalcoholic fatty liver dis⁃ease,NAFLD)是脂质尤其是甘油三酯在肝细胞内蓄积过多的一种临床病理状态,常与肥胖、高血糖和高胰岛素血症密切相关。胰岛素抵抗是NAFLD发生发展过程中的启动因素和中心环节。血清GPT常用于评价NAFLD的病情,是一个能较好反映肝炎或损伤的血清学指标。本研究结果表明,格列美脲0.4 mg·kg-1组和野菊花提取物100 mg·kg-1组血清GPT降低,肝脂肪病变改善,提示其对NAFLD有一定的治疗作用,这可能与二者均能改善胰岛素抵抗的作用有关,还需相关实验进一步验证。
糖尿病患者多饮、多食、多尿和体质量减轻。本研究中,野菊花提取物100 mg·kg-1组较模型组有体质量增加而摄食量降低的趋势。这可能与野菊花提取物改善葡萄糖利用、降低空腹血糖水平及减少尿糖排出有关。
多元醇糖代谢途径是人体除糖酵解-三羧酸循环和戊糖磷酸途径之外人体进行葡萄糖代谢的另一支路。AR是多元醇糖代谢途径的限速酶,主要负责以烟酰胺腺瞟呤二核苷酸磷酸(还原型辅酶Ⅱ,NADPH)为辅助因子,还原葡萄糖为山梨醇;而后山梨醇脱氢酶利用烟酰胺腺嘌呤二核苷酸(辅酶Ⅰ,NAD+)将山梨醇氧化为果糖。正常生理情况下,人体仅有约3%葡萄糖经该支路代谢,并最终加入到上述2个主要葡萄糖代谢途径[11]。但最近有研究发现,高糖条件下经多元醇糖代谢途径代谢的葡萄糖量大幅增加[12],提示该代谢支路的异常激活可能是某些特定病理生理变化的重要原因。肾组织中AR活性的增强导致大量葡萄糖转化为山梨醇,山梨醇在细胞内积聚,造成细胞渗透性水肿,并破坏细胞膜结构的完整性,从而导致糖尿病肾病的发生发展。野菊花提取物能有效降低血清中AR浓度,抑制肾组织中AR mRNA表达,提示野菊花提取物可通过下调AR mRNA水平抑制AR活性,减少细胞渗透性水肿,从而延缓糖尿病肾病的病程发展。这与观察到的野菊花提取物100 mg·kg-1组肾系数降低结果一致。肾组织病理学观察显示,与模型组肾小球细胞数目减少、肾小管上皮细胞空泡变性和坏死脱落相比,野菊花提取物100 mg·kg-1组肾组织结构正常,说明野菊花提取物对肾损伤有保护作用。同时对脂肪细胞肥大、胰腺胰岛病变和脾白髓萎缩亦有不同程度的改善,其机制有待进一步研究。
综上所述,野菊花提取物对2型KKAy小鼠有降低血糖和血脂的作用,并能保护因糖尿病引起的肾、肝、脂肪、胰腺和脾损伤,其对肾的保护作用可能与下调肾组织AR mRNA表达从而抑制AR作用有关。抗糖尿病作用可作为野菊花新的药用价值以开发应用。
[1] Xu Y,Wang L,He J,Bi Y,Li M,Wang T,et al. Prevalence and control of diabetes in Chinese adults.2010 China Noncommunicable Disease Surveillance Group[J].JAMA,2013 ,310(9):948-959.
[2]Chen CQ,Shen YP,Qu YD,Wang CY,Shan GS, Zhu XF,et al.Study progress of pharmacological actions ofChrysanthemum indicumextract[J].J Jilin Med Coll(吉林医药学院学报),2010,31 (3):175-178.
[3]Tan XJ,Jia Y,Chen XH,Bi KS.Determination of content of linarin in Flos Chrysanthemi Indici by RP-HPLC[J].J Shenyang Pharm Univ(沈阳药科大学学报),2004,21(6):434-435,464.
[4]Chinose Diabetes Society.China Guideline for Type-2 Diabetes(2013)[J].Chin J Diabetes Mellitus(中华糖尿病杂志),2014,6(7):447-498.
[5]He K,Li X,Chen X,Ye X,Huang J,Jin Y,et al. Evaluation of antidiabetic potential of selected traditional Chinese medicines in STZ-induced diabetic mice[J].JEthnopharmacol,2011, 137(3):1135-1142.
[6]Yang X,Yang J,Xu C,Huang M,Zhou Q,Lv J,et al.Antidiabetic effects of flavonoids fromSophora flavescensEtOAc extract in type 2 diabetic KKAy mice[J].J Ethnopharmacol,2015,171:161-170.
[7]Pirat C,Farce A,Lebègue N,Renault N,Furman C,Millet R,et al.Targeting peroxisome proliferatoractivated receptors(PPARs):development of modulators[J].MedChem,2012,55(9):4027-4061.
[8]Chen T,Chen YH,Shen W,Wang YJ.Effects and mechanism of extracts of Flos Chrysanthemi Indici on rats with diabetic nephropathy[J].Chin J Mod Appl Pharm(中国现代应用药学),2015,32 (7):791-795.
[9] Briscoe VJ,Griffith ML,Davis SN.The role of glimepiride in the treatment of type 2 diabetes mellitus[J].Expert Opin Drug Metab Toxicol, 2010,6(2):225-235.
[10]Motawi T,Salman T,Shaker O,Abdelhamid A. Association of polymorphism in adiponectin(+45 T/G)and leptin(-2548 G/A)genes with type 2diabetes mellitus in male Egyptians[J].Arch Med Sci,2015,11(5):937-944.
[11]Morrison AD,Clements RS Jr,Travis SB,Oski F,Winegrad AI.Glucose utilization by the polyol path way in human erythrocytes[J].Biochem BiophysRes Commun,1970,40(1):199-205.
[12] Boesten M,Saskia N,Gertjan J,Aalt Bast. Protective pleiotropic effect of flavonoids on NAD+levels in endothelial cells exposed to high glucose[J].Oxid Med Cell Longev,2015,2015:894597.
Effect of extract of Floson Chrysanthemi indici on hyperglycemia,hyperipidemia and blood aldose reductase in diabetic KKAy mice
CHEN Yan-hong1,ZHANG Juan1,AI Zhi-peng1,CHEN Ting2
(1.Laboratory Animal Center of Zhejiang University,Hangzhou 310058,China;2.Zhejiang Medical College,Hangzhou 310053,China)
OBJECTIVE To investigate the inhibitory effects of extracts of FlosChrysanthemi indici(FCI)on hyperglycemia,hyperipidemia and aldose reductase(AR)in diabetic KKAy mice.METHODS Twenty-eight male KKAy mice of 8 weeks old were randomly divided into four groups according to the initial fasting glucose:KKAy model group,extract of FCI 20,100 mg·kg-1groups and glimepiride 0.4 mg·kg-1group.C57BL/6J mice were taken as the normal control group.These mice were given ig once daily for 7 weeks.The body mass and food intake were recorded weekly.The fasting glucose and OGTT were measured in the last week of the experiment.Mice were sacrificed 1 d after the last admin⁃istration.The indexes of blood biochemistry were determined.Serum insulin,leptin and AR levels were analyzed by immunoassay using ELISA kits.The weights and pathological changes the in the liver,kidney,spleen,including epididymal and perirenal adipose,were measured.The expression of AR mRNA in the kidney was detected by real time-PCR.RESULTS Compared with model control group,the food intake,fasting glucose and AUC in OGTT significantly decreased(P<0.01),the serum glutamic-pyruvic transaminase,glucose,triglycerides,total cholesterol,low-density lipoprotein cholesterol,insulin,leptin and AR levels were markedly reduced(P<0.05),and the organ indexes of the liver and kidney sig⁃nificantly decreased(P<0.05)in extracts of FCI 100 mg·kg-1group.The histopathological changes in model group included tubular epithelial cell degeneration,hepatic steatosis,islet β-cell degeneration,spleen white pulp atrophy and hypertrophy of the adipocyte.Symptoms listed above were attenuated by extracts of FCI and glimepiride treatment.The inhibitory effects of FCI also inhibited the expression of AR mRNA in the kidney.CONCLUSION The extract of FCI has hypoglycemic and hypolipidemic effect and can inhibit AR in KKAy mice,which may protect the kidney,liver,adipose,pancrea and spleen from the damage of diabetes.
FlosChrysanthemi indici;aldose reductase;blood glucose;triglycerides;cholesterol
CHEN Ting,E-mail:tingting-198210@163.com,Tel:13588458729
R285
A
1000-3002-(2016)11-1142-07
10.3867/j.issn.1000-3002.2016.11.03
Foundation item:The project supported by Province Medical and Health Science and Technology Plan Program of Zhejiang(2012KYA057)
2016-02-12 接受日期:2016-11-04)
(本文编辑:齐春会)
浙江省医药卫生一般研究计划(2012KYA057)
陈雁虹,硕士,实验师,主要从事动物实验工作;陈 婷,硕士,讲师,主要从事药物分析研究。
陈 婷,E-mail:tingting-198210@163.com,Tel:13588458729

