Microtox技术应用于生脉注射液综合毒性检测*
罗荔敏,鄢良春,华 桦,祝勇军,胡 美,赵军宁*
(1.华润三九(雅安)药业有限公司 雅安 625000;2.四川省中医药科学院中药药理毒理研究所/国家中医药管理局中药质量生物评价重点研究室/四川省道地药材系统开发工程技术研究中心/中药品质评价与创新中药研究四川省重点实验室 成都 610041)
Microtox技术应用于生脉注射液综合毒性检测*
罗荔敏1**,鄢良春2**,华 桦2,祝勇军1,胡 美1,赵军宁2***
(1.华润三九(雅安)药业有限公司 雅安 625000;2.四川省中医药科学院中药药理毒理研究所/国家中医药管理局中药质量生物评价重点研究室/四川省道地药材系统开发工程技术研究中心/中药品质评价与创新中药研究四川省重点实验室 成都 610041)
目的:探索-Microtox技术应用于生脉注射液综合毒性检测。方法:以费氏弧菌为测试菌种,通过方法学考察确定最优检测体系及方法学可靠性;在最优检测体系条件下,首次以费氏弧菌对不同生产厂家所生产的生脉注射液进行发光菌综合毒性检测。结果:2 mL反应体系下,最优复苏液体积0.9 mL/支菌,每个待测样品加入最优菌液体积50 μL,最优检测时间10 min,最优pH范围5-10,且10 min发光强度以80-120万为宜;重复性试验、中间精密度试验的相对标准偏差均<15%;不同生产厂家A、B、C成品的EC50平均值分别为22.10%、34.10%、46.04%,具有极显著性差异(P<0.01)。结论:生脉注射液对费氏弧菌的毒性存在显著的浓度-效应关系,且不同生产厂家之间成品EC50值具有显著性差异,提示我们生脉注射液成品生物学检测标准存在进一步提升的空间,应用Microtox技术检测生脉射液综合毒性并用于控制不同厂家成品质量波动具有很好的应用前景。
Microtox技术 发光细菌 生脉注射液 综合毒性
生脉散出自李东垣的《内外伤辩感论》,生脉散注射液由中医经典古方生脉散发展而来,以红参、麦冬、五味子入药,具有益气养阴、复脉固脱等功效[1],临床主要用于治疗心悸、气短、冠心病、心绞痛、感染性休克、流行性出血热、心律失常等。但该药不良反应问题较为明显,是2013-2015年国家药品不良反应中心ADR发生率排名前10的品种,以全身损害为主,且多为变态反应[2,3]。
赵军宁等[3]于2010年在新型中药质量控制模式的思路与方法——“功效-毒性-物质”的基础上,结合传统中药功能主治与现代化药理、毒理及药物化学研究成果,建立了新型多指标质量控制与评价的方法体系。本研究探索将Microtox技术运用于生脉注射液综合毒性评价,为辅助该品种质量控制提供理论依据。
1 材料和方法
1.1 试验药物
生脉注射液,呈淡黄色或淡黄棕色的澄明液体,来自A、B、C 3家药企成品,各厂家选3个批次。
1.2 菌种
北京滨松光子技术股份有限公司费氏弧菌冻干粉试剂盒(CS234,批号:D15D006-D15D023),-20℃避光保存。
1.3 试剂与仪器
费氏弧菌复苏稀释液,费氏弧菌渗透压调节液(北京滨松光子技术股份有限公司,批号:20150820),纯化水。发光菌测试仪(北京滨松光子技术股份有限公司,型号:BHP9514)。
1.4 方法
1.4.1 测定发光强度的方法
从冰箱取出费氏弧菌冻干粉1支(-20℃保存),室温(18-25℃)先平衡15 min,后加入0.9 mL复苏液,于室温下放置10 min后,此为测试用菌液。根据预实验结果先将待测样品用纯化水稀释至合适的浓度后,再用渗透压调节液(17:3)混匀,此为待测样品溶液。每次试验均采用复苏稀释液作为空白对照。每支测试管中放入2 mL待测样品或空白对照液,分别向各测试管中加入50 μL测试菌液,轻轻震荡混匀,室温放置10 min后用滨松发光菌测试仪读取各管发光强度值。
1.4.2 方法学考察
(1)测定方法影响因素考察
复苏液体积、加入菌液体积及时间对空白对照管初始发光强度值的影响:向平衡后的费氏弧菌冻干粉中分别加入0.5、0.6、0.7、0.8、0.9 mL复苏液进行复苏,10 min后分别取每个复苏液体积下的菌液20、30、40、50、60 μL至装有2 mL稀释液的空白对照管中,轻轻震荡从混匀开始计时,每2 min测定1次发光强度值,比较不同复苏液体积、不同菌液加入量及不同测定时间对空白对照管初始发光强度值的影响。
时间对不同浓度待测样品发光强度值的影响:向待测管中加入2 mL不同浓度下待测样品溶液,后用移液器加入最优复苏参数条件下测试菌液,轻轻震荡从混匀开始计时,每2 min测定1次发光强度值,比较不同浓度待测样品发光强度值随时间的变化情况。
pH对发光强度的影响:用NaOH溶液或HCl溶液与复苏稀释液以适宜的比例混合混合,配制pH为1、2、4、5、8、10、11、12、14的复苏稀释液;分别取上述复苏稀释液2 mL于测试管中,加入50 μL测试菌液,轻轻震荡使之充分混匀开始计时,每2 min测定1次发光强度值,比较pH对发光强度的影响。
(2)精密度考察
重复性考察:以1.4.1的方法对不同厂家各个批次的生脉注射液成品进行检测,每批样品平行3次试验,对结果进行分析。
中间精密度考察:①不同人员:以1.4.1的方法由不同的实验员在同一个工作日对同一批生脉注射液成品进行检测,对结果进行分析;②不同工作日:由相同的实验员在不同工作日对同一批生脉注射液成品进行检测,对结果进行分析。
1.4.3 采用费氏弧菌对生脉注射液进行综合毒性评价
按照1.4.1的方法,对不同厂家各个批次的生脉注射液成品进行发光强度检测并计算抑制率和半数抑制浓度(EC50值),根据EC50值对比各样品的综合毒性大小(EC50值与各样品综合毒性成负相关)。
1.4.4 数据处理和毒性评价
抑制率计算公式为

采用Excel对数模型拟合并绘制浓度-抑制率曲线,根据曲线拟合公式计算样品的EC50值(半数抑制浓度),以EC50值表征生脉注射液综合毒性的大小,并对数据进行处理和统计分析。
1.4.5 统计学方法
运用Excel软件先进行F-TEST方差齐性检验,后进行T-TEST双尾等方差检验。P>0.05无显著性差异,P<0.05有显著性差异。P<0.01有极显著性差异。
2 结果
2.1 影响因素考察
复苏液体积、加入菌液体积及时间对空白对照管初始发光强度值的影响:由图1可见,固定加入菌液体积,复苏液体积不同会造成初始发光强度值随时间的走势不同,随复苏液体积增大初始发光强度值呈现先增高后降低趋势;固定复苏液体积,所加菌液体积不同会造成初始发光强度值随时间的走势不同,随所加菌液体积增大初始发光强度值亦呈现先增高后降低趋势;结合上述试验结果为减小试验误差同时考虑成本问题,选取最优复苏液体积0.9 mL,每管加菌液体积50 μL,10-30 min内发光强度值基本没有太大变化可用于试验测定(初始发光强度值在80-120万之间为宜)。
2.1.1 时间对不同浓度待测样品发光强度值的影响
由图2可见,不同浓度的生脉注射液对费氏弧菌初试发光强度值的影响不同,低浓度促进发光,高浓度抑制发光,且中间浓度抑制率在15 min左右开始发生衰减。综合空白对照管的结果,设定生脉注射液-费氏弧菌综合毒性评价体系参数为:复苏液0.9 mL,每管加入菌液50 μL,最优检测时间10 min。

图1 复苏液体积、加入菌液体积及时间对空白对照管初始发光强度值的影响(n=3)

图2 时间对不同浓度待测样品发光强度值的影响(n=3)
2.1.2 pH对发光强度的影响
由图3可见,待测样品溶液pH在5-10时对发光强度值的影响较小(±10%)。
2.2 精密度考察
重复性:根据表1可见,重复性试验的相对偏差<15%。
中间精密度:根据表2可见,中间精密度试验的相对偏差<15%。
2.3 不同厂家生脉注射液综合毒性比较
由表3和图4可见,不同生产厂家A、B、C的生脉注射液成品EC50值差异较大(P<0.01),具有极显著性差异。
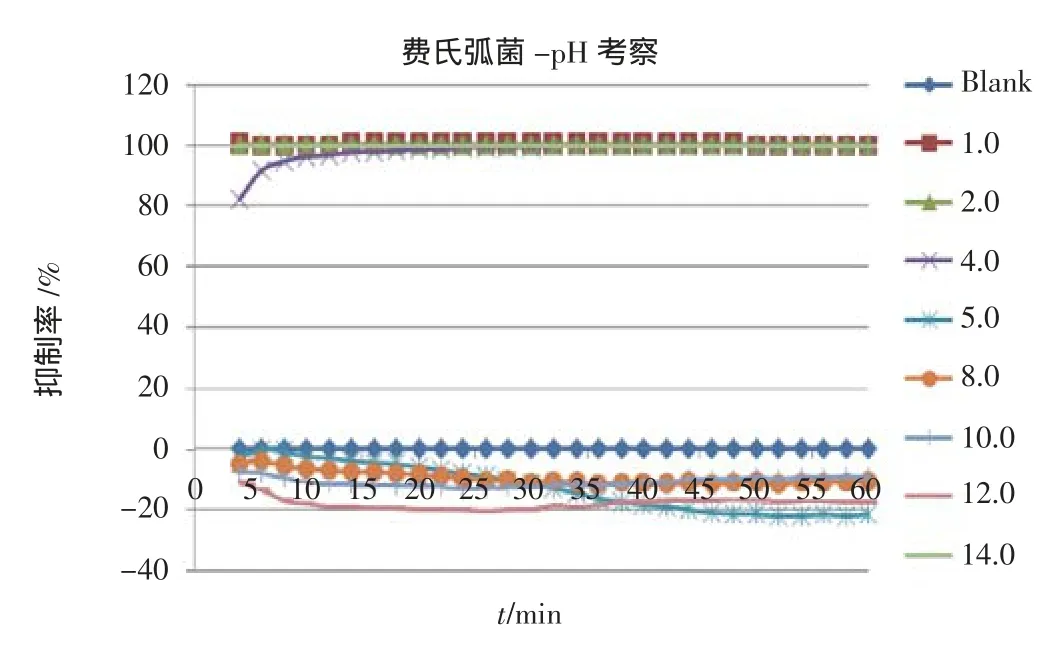
图3 pH对发光强度的影响(n=3)

表1 3批生脉注射液成品重复性试验

表2 中间精密度试验试验
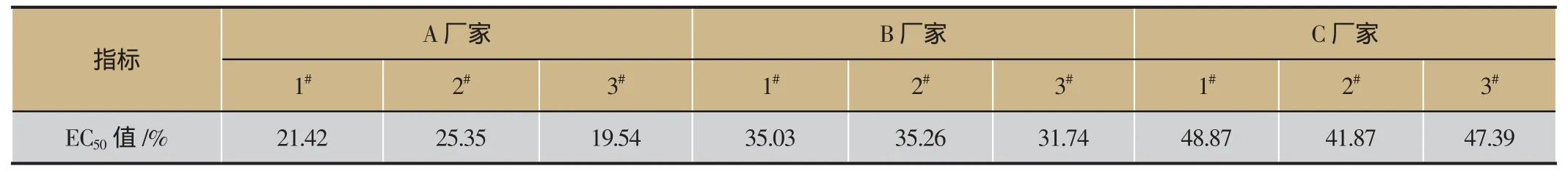
表3 不同厂家生脉注射液成品生物综合毒性结果
3 讨论
3.1 Microtox技术综合毒性评价体系
利用发光菌生理上的独特性,Microtox技术根据发光强度的变化检测生物毒性,也是目前GB/ T 15441-1995和ISO11348认证的急性毒理测试方法。细菌有很多种类,但是他们的发光原理是相同的,都是酶促氧化反应。一般主要有荧光素酶、FMN、NAD(P)H、长链脂肪醛(RCHO)、分子氧等物质参与发光反应。在正常的生理条件下发光菌能发出波长在450-490 nm的蓝绿色可见光,发光强度在特定试验条件下是恒定的;发光强度在接触外来受试物时会发生变化,外来受试物抑制细菌发光主要通过2个途径:①直接抑制酶类参与发光反应的活性;②抑制与发光反应有关的细胞内代谢过程。原理图如图5所示[4]。
该技术评价体系优点如下:①发光菌具有同高等生物类似的物理化学性质和酶作用过程特点,模拟性强,是一种综合性的毒性检测方法;②该方法为国际公认的客观可靠的方法,且方法简单,便于操作,重复性好;③反应灵敏度高,比一般生物反应细胞灵敏几个数量级;④可以同时获得多个定量参数,EC50、标准毒物参比值、毒性剂量-效应动力曲线等多个定量参数的测定,综合表征上述注射剂毒性特点[5-13]。
3.2 生脉注射液对发光菌的综合毒性
本文首次应用一种Microtox技术方法测定生脉注射液综合毒性,选取费氏弧菌作为发光菌测试菌种,考察并建立其生物综合毒性评价体系,确定最优复苏液体积为0.9 mL,最优菌液加入量为50 μL,最优检测时间10 min,最优pH范围5-10,且10 min时空白对照发光强度以80-120万为宜。重复性和中间精密度在此方法体系下较为良好,RSD<15%,方法稳定性好。从研究结果分析,生脉注射液对费氏弧菌的毒性存在显著的浓度-效应关系,且不同生产厂家之间成品EC50值具有显著性差异,提示我们生脉注射液成品生物学检测标准存在进一步提升的空间,应用Microtox技术检测参生脉射液综合毒性并用于控制不同厂家成品质量波动具有很好的应用前景。
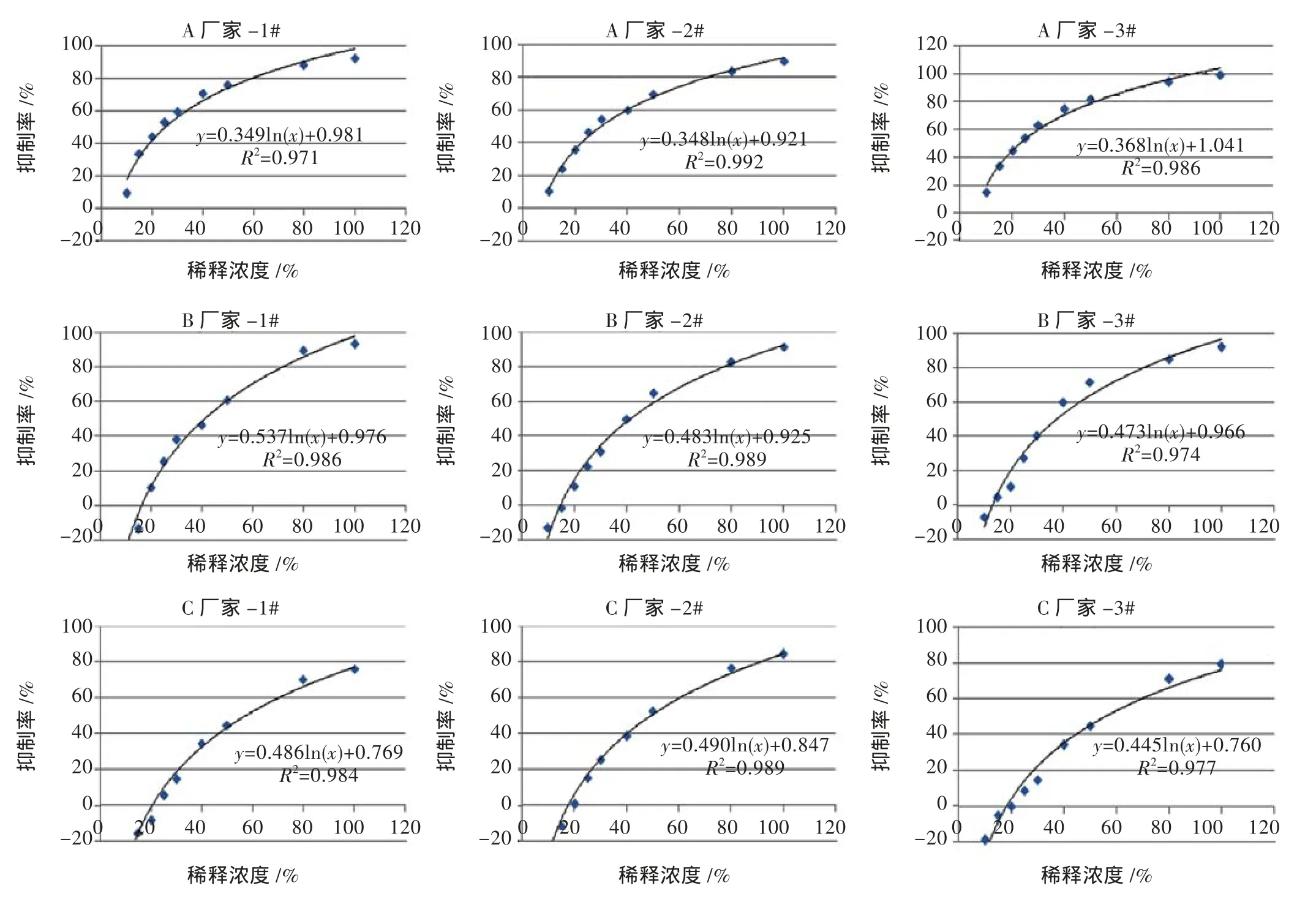
图4 不同厂家生脉注射液成品生物综合毒性结果
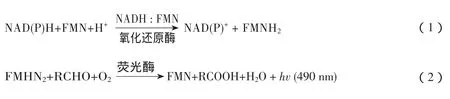
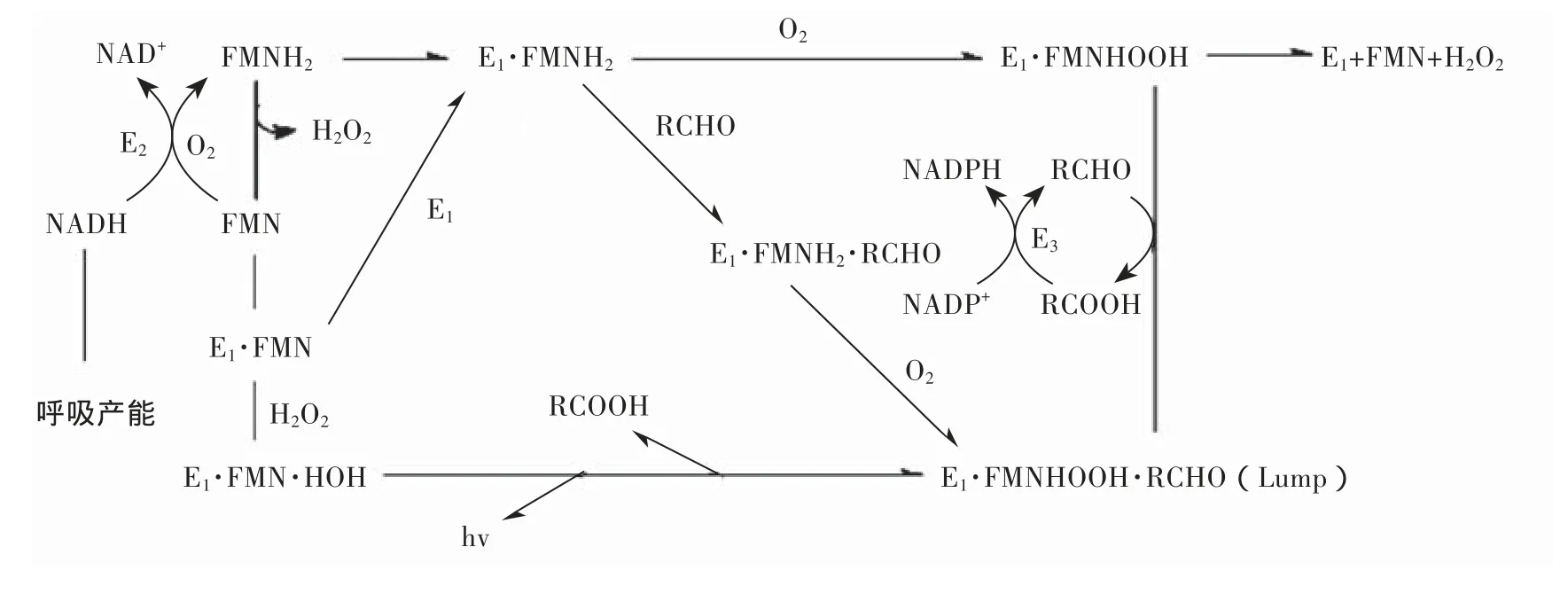
图5 发光菌发光代谢过程和原理图
1 张珊珊,魏德建.生脉注射液治疗缺血性中风急性期随机对照实验的系统评价更新.中国中医急症,2013,22(5):696-697.
2 黄培芬.生脉注射液临床应用及不良反应的文献研究.中国民族民间医药,2015(6):97-98.
3 焦文斌.浅谈生脉注射液的不良反应及产生原因.当代医药论丛,2014,12(5):253.
4 Meighen E A. Molecular biology of bacterial bioluminescence. Microbiol Rev, 1991, 55(1):123-142.
5 赵军宁,鄢良春.基于Microtox技术(微毒测试)的中药综合毒性快速评价.世界中医药,2014,9(2):137-144.
6 赵军宁,鄢良春,郑晓秋.一种快速检测中药注射剂综合毒性的生物测试方法.中国:ZL201310210195.8,2016-09-06.
7 赵军宁,鄢良春,朱雅宁,等.一种快速检测红花注射液综合毒性的生物测试方法.中国:ZL201410113782.X,2016-08-17.
8 赵军宁,鄢良春,郑晓秋,等.一种快速检测鱼腥草注射液综合毒性的生物测试方法.中国:ZL201310369652.8,2016-02-17.
9 李孝容,华桦,鄢良春,等.苍耳子微毒测试(Microtox)与小鼠急性毒性的相关性研究.中药药理与临床,2016,32(2):134-138.
10 夏见英,华桦,鄢良春,等.基于Microtox技术快速检测苍耳子药材及其饮片、成方制剂毒性变化规律.中药药理与临床,2016,32(2):151-154.
11 熊静悦,李孝容,鄢良春,等. Microtox中药注射剂微毒测试体系明亮发光杆菌502和青海弧菌Q67发光反应条件的比较研究.中药药理与临床,2016,32(2):227-230.
12 郑晓秋,鄢良春,赵军宁,等.应用Microtox 技术检测鱼腥草注射液综合毒性的研究.中药药理与临床,2013,29(6):92-95.
13 熊静悦,李孝容,鄢良春,等.基于Microtox技术的中药注射剂微毒快速测试体系反应条件的优化与方法学的考察.中国中药杂志,2016,41(9):1622-1626.
Application of Microtox-Based Fast Test to the Evaluation of Comprehensive Toxicity of Sheng Mai Injection
Luo Limin1, Yan Liangchun1, Hua Hua2, Zhu Yongjun1, Hu Mei1, Zhao Junning2
(1. China Resources 999 Pharmaceutical Co., Ltd. (Ya'an), Ya'an 625000, China; 2. Sichuan Academy of Chinese Medicine Sciences, Chengdu 610041, China)
This study aimed at exploring the application of microtox technology to the evaluation of comprehensive toxicity of Sheng Mai injections. Characteristic parameters of vibrio fischeri (CS234) were measured by methodology inspection under different conditions to optimize the reaction condition with reliable technology. It was the first experiment to accomplish the comprehensive toxicity of Sheng Mai injections from various manufacturers using vibrio fischeri under the target condition. It was found that parameters of the optimum condition contained 0.9 mL recovery liquid volume in each freeze-dried vial and 50 μL bacteria suspension of each sample, being included in 2 mL solution in aggregate under 10 mins' detection time after adding bacteria suspension with the favorable pH value ranging from 5 to 10 and luminous intensity from 0.8 to 1.2 million within 10 mins. The relative standard deviation values of replication experiment and precision test were all below 15%. Under this optimum detection condition, it was found that the EC50 values were 22.10%, 34.10% and 46.04%, respectively, presenting significant statistical differences (P<0.05). These results demonstrated that the growth of biological detection standards of Sheng Mai injection was highlighted a long way to go. Besides, the microtoxbased fast test for the evaluation of the comprehensive toxicity of Sheng Mai injection showed a prospective application to controlling the quality of different products from manufacturers.
Microtox technology, bacteria growth inhibition, Sheng Mai injection, comprehensive toxicity
10.11842/wst.2016.11.018
R285
A
(责任编辑:朱黎婷,责任译审:朱黎婷)
2016-11-15
修回日期:2016-11-30
* 科学技术部“重大新药创制”科技重大专项项目(2015ZX09501004-001-005):基于Microtox(微毒)测试的中药安全性快速检测、质量控制与风险预警新技术研究,负责人:赵军宁;国家自然科学基金委面上项目(81470180):基于Microtox技术的中药毒性分级原理与标准研究,负责人:赵军宁;国家中医药管理局国家公益性行业科研专项(201507004):与临床病症相关的确有疗效常用中药炮制技术与配伍减“毒”研究——苍耳子,负责人:华桦;四川省科技厅科技支撑计划项目(2014SZ0139):益母草注射液、三七通舒胶囊等已上市中成药大品种的二次开发-中药大品种生脉注射液二次开发研究,负责人:朱雅宁。
** 罗荔敏、鄢良春为共同第一作者。
*** 通讯作者:赵军宁,本刊编委,研究员,博士,博士生导师,主要研究方向:中药药理学、中药质量生物控制、道地药材与民族药系统研究开发等。

