常山碱盐急性毒性及其与青蒿素类药物联合用药增效减毒作用
李思迪,李 春,代宝强,张广平,盛益华,李建荣,叶祖光
(中国中医科学院中药研究所,北京 100700)
常山碱盐急性毒性及其与青蒿素类药物联合用药增效减毒作用
李思迪,李 春,代宝强,张广平,盛益华,李建荣,叶祖光
(中国中医科学院中药研究所,北京 100700)
目的探索常山碱盐(DAS)和青蒿素类药物联合用药以达到增效减毒的可能性。方法 用小鼠对DAS进行急性毒性实验,观察小鼠的腹泻率、死亡率、半数致死剂量(LD50)、LD90、半数腹泻剂量(DD50)和DD90,明确DAS安全剂量;采用ip接种疟原虫制备的鼠疟感染小鼠模型进行体内抗疟实验(ig给药,每天1次,连续4 d),比较单用DAS或青蒿素类药物、以及DAS联合青蒿素、双氢青蒿素(Dih)、蒿甲醚、青蒿琥酯时的抗疟效价。动态采集尾静脉血,涂片并吉姆萨染色法染色,显微镜下观察疟疾小鼠疟原虫的转阴以及复燃情况,计算转阴率和抗复燃率,并计算半数有效剂量(ED50)和ED90等。结果 在急性毒性实验中,DAS的安全剂量为0.5 mg·kg-1。鼠疟的体内抗疟实验中,单用DAS 0.25和0.5 mg·kg-1对疟疾小鼠疟原虫的转阴和抗复燃作用较差。与单用DAS 0.5 mg·kg-1或单用青蒿素、Dih、蒿甲醚和青蒿琥酯相比较,DAS与青蒿素(274,392和560 mg·kg-1)、Dih(52,80和123 mg·kg-1)、蒿甲醚(10,20,40和80 mg·kg-1)和青蒿琥酯(32.5,65.0和130.0 mg·kg-1)联合应用时疟疾小鼠疟原虫的转阴率和抗复燃率均明显提高(P<0.05,P< 0.01)。DAS 0.5 mg·kg-1和上述青蒿素类药物联用,与青蒿素类药物单用比较,效价分别提高了0.8,0.2,1.0和0.6倍,同时联合用药组(包括达到与单用DAS同样疗效的联用剂量组)均未发现小鼠腹泻或死亡。结论 DAS安全窗较窄,通过与青蒿素及其衍生物联合用药,可达到增效减毒抗疟的目的。
常山碱盐;青蒿素;衍生物;疟疾;增效减毒
疟疾是热带、亚热带主要的寄生虫传染病之一,是发展中国家严重的卫生问题和阻碍社会经济发展进步的关键社会问题[1]。全世界每年疟疾的发病人数为1亿 ~3亿,每年约80万人口死于疟疾[2]。在世界各地大多数疟疾流行地区,多重耐药虫株的不断出现极大地阻碍了目前抗疟药对疟疾的预防和治疗作用[3]。尤其令人担忧的是,人恶性疟不仅对一线用药氯喹等喹啉类抗疟药产生了耐药性,对目前常用的青蒿素类抗疟药产生耐药性的病例也有报道[4]。因此,有必要尽早进行新型结构的新一代抗疟药物的研发。
常山是虎耳草科植物黄常山(Dichroa febrifuga)的干燥根。中医认为,常山性苦、辛、寒,归肝、脾、心经,常用于寒热往来、间日疟、三日疟、新旧疟疾和老痰积饮等证[5]。常山的抗疟活性成分主要是喹唑酮类生物碱,包括常山碱甲、乙和丙3种[6]。近年来研究表明,常山主要用于治疗疟疾、鸡球虫病和蓝氏贾第鞭毛虫病等,还具有抗钩端螺旋体、抗阿米巴原虫、抗病毒、抗肿瘤、抗心律失常、催吐、降压及兴奋子宫平滑肌等作用[7]。常山是中医重要的抗疟药物之一,据古文献记载,在明清以前,常山经常作为主药应用于大多数中药抗疟方剂中。现代研究发现,其活性比奎宁高100倍[8],但其毒副作用较大,且常山致胃肠道毒性机制研究目前极度匮乏,极大地限制了常山药物的发展[9-10]。正因为其毒副作用较大,所以中药常山在《中华人民共和国药典》(2005年版一部)中被列为有毒药材。本课题即采用中医药减毒的思路,采用二药配伍的方法以减轻其毒副作用,通过常山碱盐(Dichroaalkali salt,DAS)与青蒿素及其衍生物联合用药,减少其用量而达到减毒目的。此外,从青蒿素类抗疟药角度,世界卫生组织织(WHO)推行青蒿素联合用药疗法(artemisinin combination therapy,ACT)的宗旨就是延缓疟原虫对青蒿素类抗疟药的耐药性的产生。本研究探索青蒿素类抗疟药和DAS联合用药的可能性。通过对DAS与青蒿素及其衍生物联合用药进行较系统的药理学和毒理学研究,明确二药配伍后是否具有减毒作用以及抗疟效价是否具有增效作用;换言之,采用DAS与青蒿素类药物联合用药的方式,一方面降低DAS发挥药效作用的剂量从而减轻其毒副作用的发生,另一方面解决青蒿素类药物复燃率高且单独用药易产生的耐药性风险。
1 材料与方法
1.1 动物、药品、试剂和主要仪器
昆明雄性小鼠,体质量18 ~22 g,购自北京维通利华实验动物技术有限公司,许可证号:SCXK(京)2015-0001,饲养于中国中医科学院中药研究所SPF动物房,分笼常规饲养,自由进食饮水,光照时间为自然日照时长,适应环境7 d后开始实验。青蒿素、青蒿琥酯、双氢青蒿素(Droartemising,Dih)、蒿甲醚和DAS:由中国中医科学院中药研究所化学室提供,纯度>99%;吉姆萨染液(批号:20140618),南京建成生物工程研究所;甲醇:分析纯(批号:T20140224),国药集团北京化学试剂有限公司;吐温80(批号:120101M),上海申宇医药化工有限公司;蒸馏水:由本实验室提供。LYMPUSBX51显微镜,日本Olympus公司;AE-200电子天平,日本岛津公司。
1.2 常山碱盐急性毒性实验
小鼠分为6个组,分别为正常对照组、DAS 0.25,0.5,1.0,2.0和4.0 mg·kg-1组,每组10只。把小鼠置于垫有滤纸的鼠笼内,每笼1只,每日观察并记录小鼠的毛色、精神、腹泻、粪便颜色,连续观察1 h,计算半数腹泻剂量(DD50)和DD90[11]。每天记录小鼠死亡情况,并记录死亡时间,连续观察4周,计算半数致死剂量(LD50)和LD90[11]。实验结束后,处死小鼠,迅速摘取胃、小肠和大肠等组织,肉眼观察各器官组织的形态变化。各实验每组10只小鼠,ig给药体积按20 mL·kg-1计算,正常对照组给予等体积蒸馏水。
1.3 鼠疟伯氏鼠疟虫(Plasmodium berghei)感染小鼠模型制备及抗疟活性测定
经眼眶静脉丛采集感染鼠疟原虫小鼠血液,用生理盐水配制成每毫升含5000万个感染鼠疟原虫红细胞的接种溶液;每只小鼠ip接种0.2 mL,制备鼠疟感染小鼠模型[12]。
小鼠体内抗疟实验分为鼠疟感染小鼠模型组、药物单用组(DAS 0.5 mg·kg-1;青蒿素134,192,274,392和560 mg·kg-15组,Dih 22.0,33.8,52.0,80.0和123.0 mg·kg-15组;蒿甲醚5,10,20,40和80mg·kg-15组;青蒿琥酯32.5,65.0和130.0mg·kg-13组)以及联合用药组(DAS 0.5 mg·kg-1+上述各青蒿素类药物各剂量),每组10只。采用Peter 4 d给药方法进行抗疟活性测定[13]。具体操作程序简述如下:接种当日按体质量随机分组并ig给药1次,每天1次,连续4 d,模型组给予等体积蒸馏水,各实验组ig给药体积按20 mL·kg-1计算,末次给药后24 h尾部取血、涂片、吉姆萨染色,镜下观察各剂量组疟原虫的转阴以及复燃情况,计算转阴率〔转阴率(%)=转阴小鼠数/小鼠总数×100%〕、抗复燃率〔抗复燃率(%)=(转阴小鼠数-复燃小鼠数)/小鼠总数×100%〕、半数有效剂量(ED50)和ED90[11],抗复燃实验涂片观察时间8周,并记录小鼠的毛色、精神状况、死亡等一般情况。效价指数=ED90(青蒿素类药物)/ED90(DAS 0.5 mg·kg-1+青蒿素类药物)。
1.4 统计学分析
实验结果数据以x±s表示。应用SPSS 19.0软件采用方差分析,先行方差齐性检验,用各组间均数的两两比较法LSD进行统计;对非正态或方差不齐的数据进行适当的变量转换,待满足正态或方差齐性要求后,用转换后的数据进行统计;若变量转换后仍未达到正态或方差齐性的目的,改用秩和检验进行统计。直线回归法计算DAS LD50,LD90,DD50和DD90;以及实验药物ED50、ED90。相关性分析采用Pearson和Spearman相关性分析法,当两个变量均为连续变量时,采用Pearson相关性分析,当变量为非正态分布时,采用Spearman相关性分析。DAS与青蒿素及其衍生物联合应用,与DAS或青蒿素类药物单用的组间转阴率、抗复燃率比较分析,采用卡方检验。
2 结果
2.1 常山碱盐对小鼠的急性毒性
表1结果显示,与正常对照组(DAS 0.0 mg·kg-1)比较,DAS 0.25和0.5 mg·kg-1组小鼠给药第1 ~4天体质量无明显变化;DAS 1.0和2.0 mg·kg-1组小鼠在给药第2 ~4天体质量明显下降(P<0.05,P< 0.01);DAS 4.0 mg·kg-1组小鼠在给药第1 ~2天体质量明显下降(P<0.01),且给药第3和4天小鼠大量死亡,死亡率分别为80%和100%;表明DAS毒性随剂量的增大而增加(r=0.991,P<0.01)。
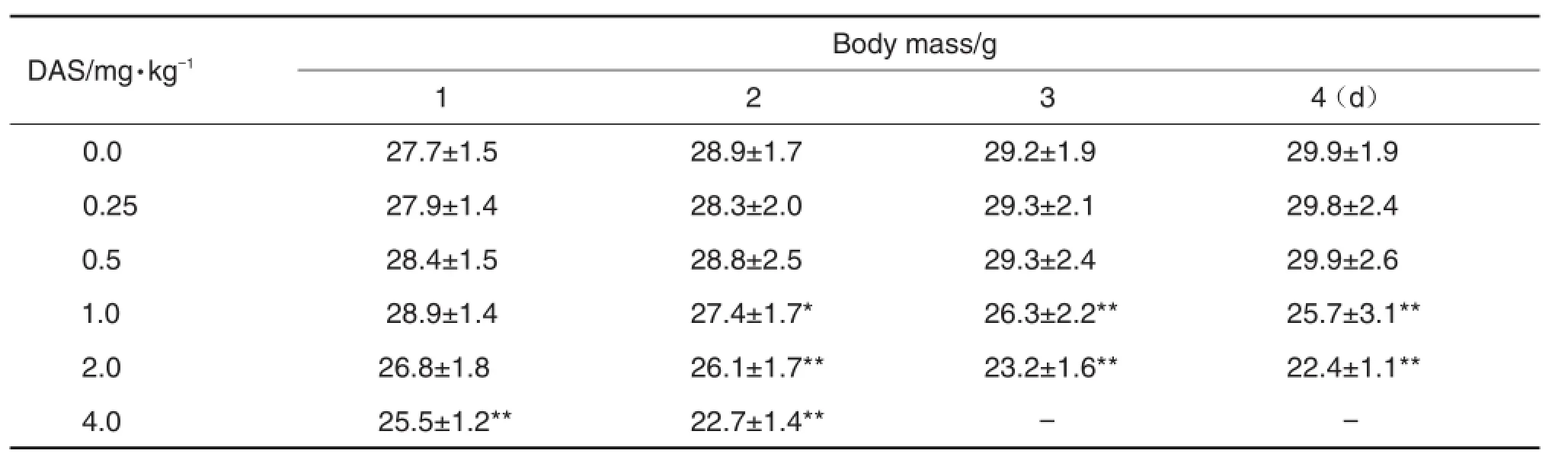
Tab.1 Effect ofDichroaalkali salt(DAS)on body mass of Kunming mice
表2结果显示,DSA 0.25,0.5和1.0 mg·kg-1组未见小鼠死亡;DAS 2.0和4.0 mg·kg-1组90%和100%小鼠出现明显腹泻,翻毛严重,精神萎靡,畏冷,笼内小鼠蜷缩在一起;DAS 1.0 mg·kg-1组10%小鼠出现腹泻。LD50为1.649 mg·kg-1,LD90为1.967 mg·kg-1;DD50为1.508 mg·kg-1,DD90为1.992 mg·kg-1。随着小鼠腹泻率的增加,死亡率也上升(r=0.997,P<0.01),说明DAS使小鼠发生腹泻的毒性作用是其导致死亡的一个重要原因。
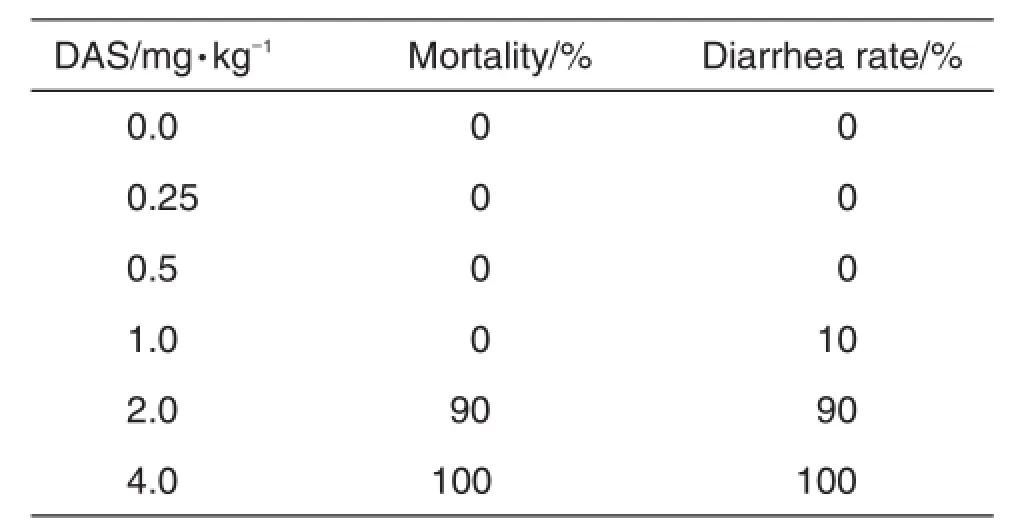
Tab.2 Effect of DAS on diarrhea rate and mortality of Kunming mice
肉眼观察各剂量组小鼠胃、肠组织的大体形态变化。在胃、肠组织黏膜方面,DAS 0.25和0.5 mg·kg-1组小鼠未见明显的水肿、充血和缺损等;DAS 1.0mg·kg-1组少数小鼠出现轻度水肿和充血,未见有黏膜缺损;DAS 2.0与4.0 mg·kg-1组小鼠出现较明显的水肿、充血,严重的出现黏膜缺损、出血灶(数据略)。由此提示,DAS可造成小鼠胃肠出现器官组织的形态变化,提示其存在胃肠道毒性。
2.2 常山碱盐与青蒿素及其衍生物单用或联合应用对鼠疟抗疟效价的比较
由表3所示,随着DAS剂量的增加疟原虫转阴率逐渐增加(r=0.944,P<0.05),其中DAS 2.0 mg·kg-1时疟原虫的转阴率达到100%,但在安全剂量0.5 mg·kg-1转阴率仅30%,表明DAS单用时安全窗较窄。DAS各剂量均无明显抗复燃作用。

Tab.3 Effect of DAS on negative conversion ratio and anti-revival ratio of Kunming mice infected with plasmodium berghei
表4结果显示,与DAS或青蒿素单用相比较,DAS与青蒿素274,392和560 mg·kg-1联用组小鼠疟原虫的转阴率和抗复燃率均明显提高(P< 0.05,P<0.01);且随青蒿素剂量增加抗复燃作用逐渐增强(r=0.938,P<0.05)。给药期间各组均未发现小鼠腹泻或死亡。
表5结果显示,与DAS或Dih单用相比较,DAS 0.5 mg·kg-1与Dih 52.0,80.0和123.0 mg·kg-1联用组疟原虫转阴率和抗复燃率明显提高(P<0.05,P<0.01),且随双氢青蒿素剂量增加抗复燃作用逐渐增强(r=0.932,P<0.05)。给药期间各组均未发现小鼠腹泻或死亡。
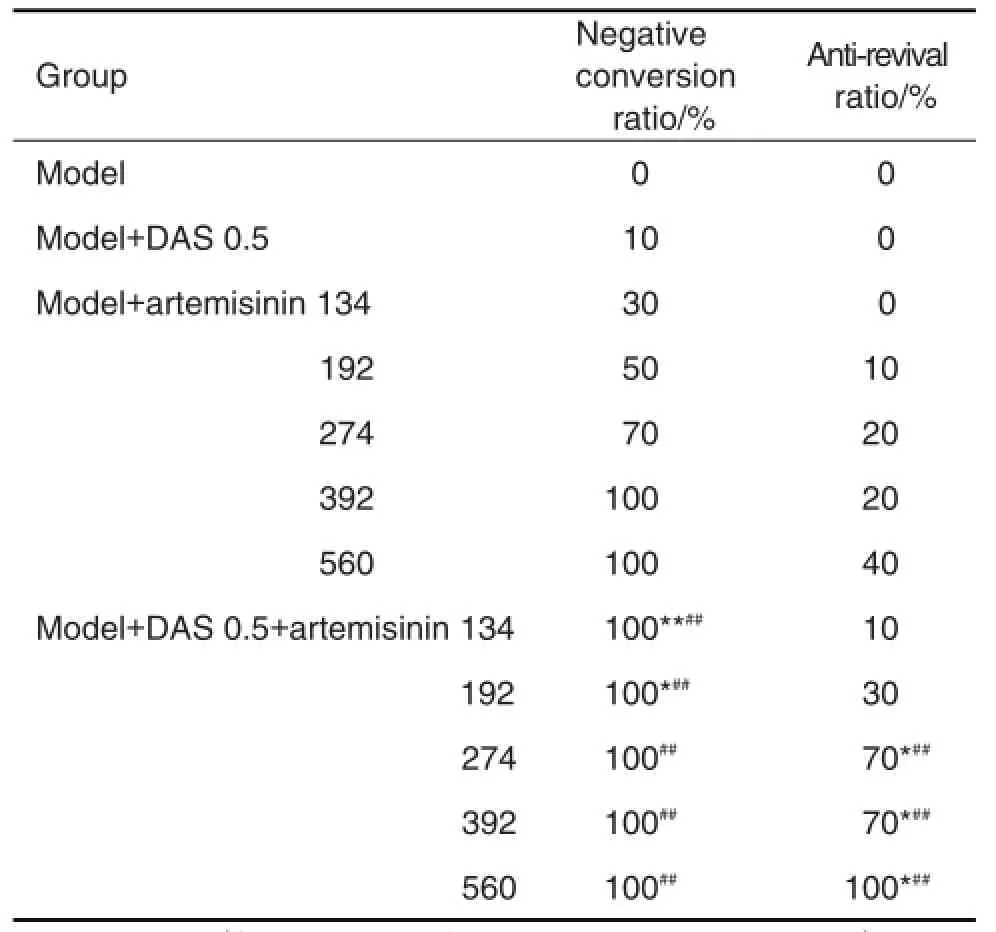
Tab.4 Effect of DAS and artemisinin on negative conversion ratio and anti-revival ratio of Kunming mice infected withP.berghei
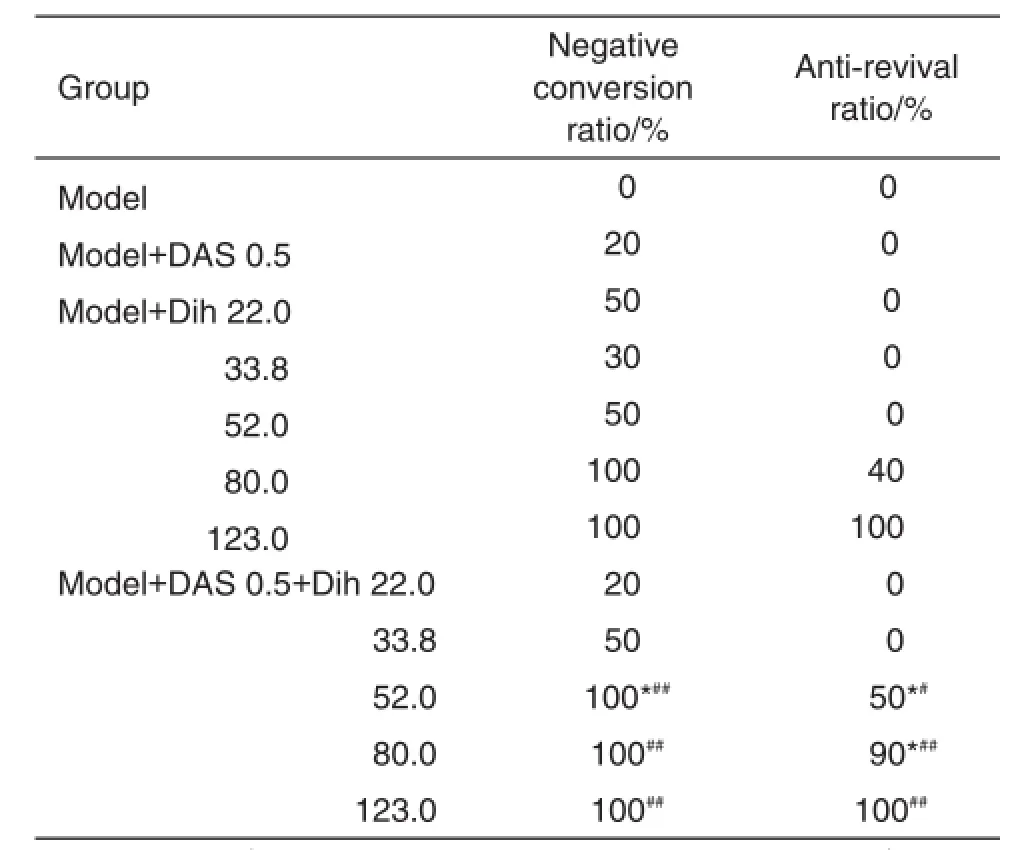
Tab.5 Effect of DAS and dihydroartemisinin(Dih)on negative conversion ratio and anti-revival ratio of Kunming mice infected withP.berghei
表6结果显示,与DAS单用相比较,DAS 0.5 mg·kg-1与蒿甲醚10,20,40和80 mg·kg-1联用组疟原虫转阴率和抗复燃率均明显提高(P<0.05,P<0.01)。随蒿甲醚剂量增加,抗复燃作用逐渐增强(r=0.805,P<0.05)。给药期间未发现小鼠腹泻或死亡。

Tab.6 Effect of DAS and artemether on negative con⁃version ratio and anti-revival ratio of Kunming mice infected withP.berghei
表7结果显示,与DAS或青蒿琥酯单用相比较,DAS 0.5 mg·kg-1与青蒿琥酯32.5,65.0和130.0 mg·kg-1联合用药组疟原虫转阴率和抗复燃率明显提高(P<0.05,P<0.01),提示DAS与青蒿琥酯联用可有效地提高抗疟活性,并提高抗复燃率。给药期间各组均未发现小鼠腹泻或死亡。
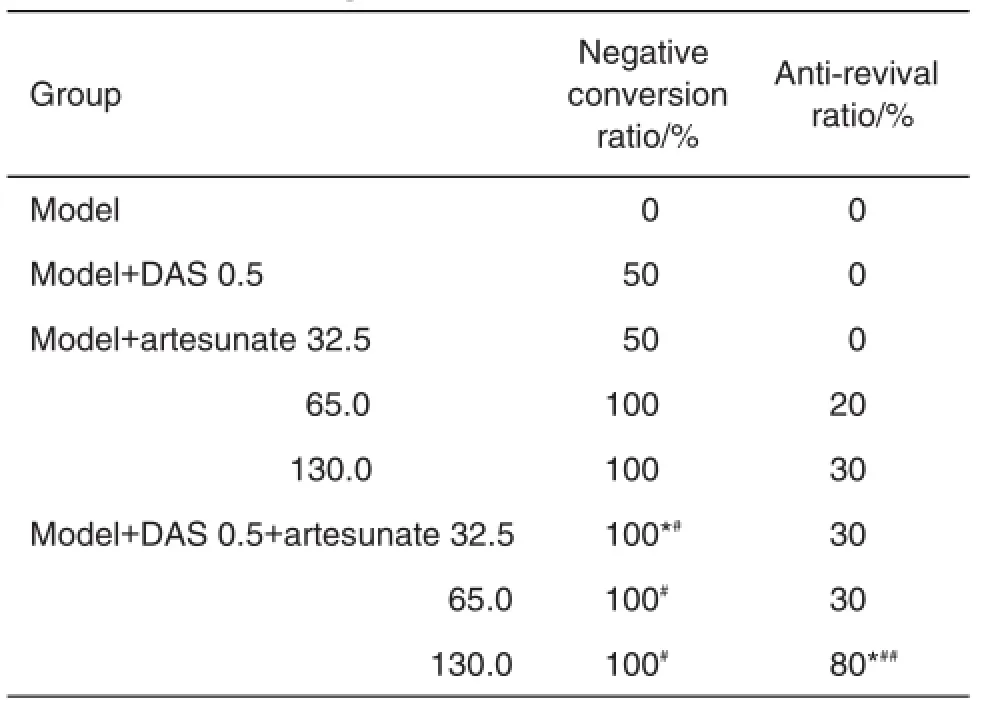
Tab.7 Effect of DAS and artesunate on negative con⁃version ratio and anti-revival ratio of Kunming mice infected withP.berghei
表8结果显示,DAS与青蒿素类药物联用,使青蒿素类药物的ED50和ED90明显降低,提示联用的抗疟效价高于单用青蒿素类抗疟药(如青蒿素与DAS配伍前和后ED90分别为783.3和439.7 mg·kg-1,效价指数提高1.8倍)。给药期间各组均未发现小鼠腹泻或死亡。
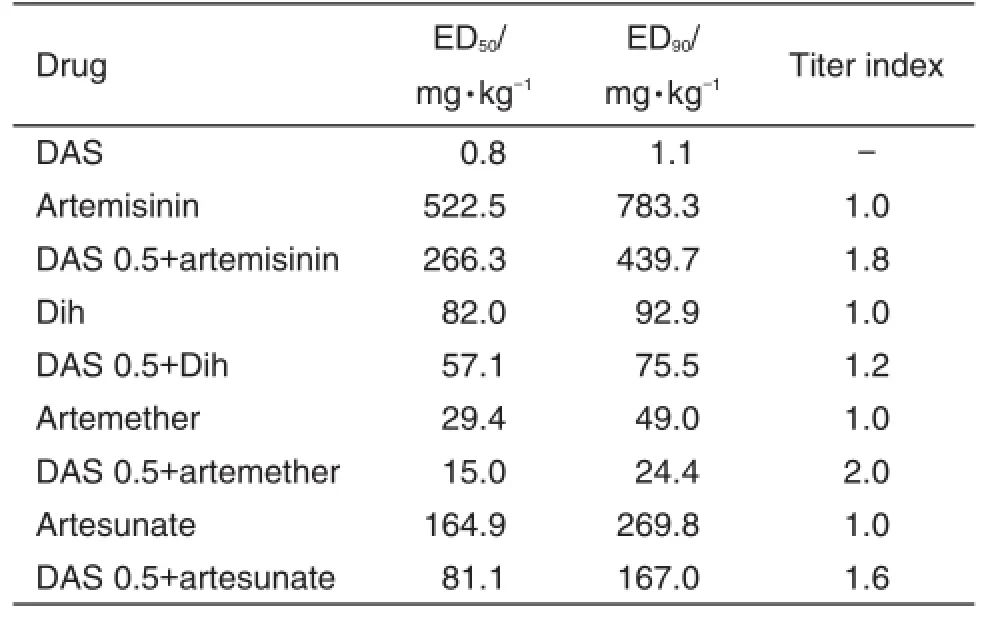
Tab.8 Comparison of antimalarial titer between DAS and artemisinin with its derivatives
3 讨论
本研究和已有的报道均证实过量常山碱可引起实验动物恶心、呕吐、腹泻及胃肠黏膜充血和出血[5]。据报道化学药物口服引起胃肠道毒性可通过肠腔直接作用于肠道黏膜,或通过血液循环作用于肠嗜铬细胞并使肠嗜铬细胞释放神经递质,作用于腹腔迷走传入神经末梢的相关受体[14]。然而目前国内外对常山碱胃肠道副作用的毒理学机制研究尚未见相关的研究报道。本研究发现,DAS 0.25和0.5 mg·kg-1时小鼠未出现腹泻、死亡,但在剂量为1.0 ~2.0 mg·kg-1时,即出现明显毒副作用甚至死亡,并且给予DAS的小鼠死亡率随腹泻率上升而上升,提示DAS使小鼠发生腹泻的毒性作用可能是DAS导致小鼠死亡的一个重要原因。DAS剂量为0.5 mg·kg-1时,虽其对昆明小鼠的毒性较小或未出现毒性,但该剂量的DAS抗疟活性却较弱,DAS 0.5 mg·kg-1转阴率平均仅为25%(10%,20%,20%,50%)。DAS 2.0 mg·kg-1时,疟疾小鼠疟原虫的转阴率虽达到100%,但最终的死亡率(给药后2周内)却达到了90%。可见,DAS安全窗比较小,从抗疟的有效性和安全性角度评价,DAS的成药性较差。因此,DAS单用难以成为一个安全有效的抗疟药物。本研究针对DAS安全窗窄的问题,将其配伍青蒿素类抗疟药,从而提高DAS的抗疟活性。
近几年,有关青蒿素耐药性的报道一直不断,最近在东南亚地区已发现了抗青蒿素类药物的耐药性疟疾感染的人群[15]。早在1990年,就曾建议在治疗疟疾过程中必须将青蒿素同其他的抗疟药联合使用,用来延缓和防止疟疾对青蒿素的耐药性。本研究通过DAS与青蒿素类抗疟药的联用,不仅可以提高低剂量DAS的抗疟效价,且还可解决青蒿素类药物复燃率高且单用易产生耐药性的风险。
本研究采用鼠疟原虫株接种小鼠成功复制鼠疟感染小鼠模型,将DAS分别联合应用青蒿素、Dih、蒿甲醚和青蒿琥酯等抗疟药。结果表明,DAS联用的抗疟效价较之其各自单用的抗疟转阴率和抗复燃率均有明显提高。在联用中选用了较低剂量的DAS(0.5 mg·kg-1),通过和青蒿素类配伍用药,不仅能增强DAS抗疟活性,且还提高了抗复燃率。另外,由于采用了较低剂量的DAS,所以也减少了其腹泻等胃肠道毒副作用的发生,基本上克服了DAS因胃肠道毒副作用而成药性差的缺陷。
总之,DAS与青蒿素类药物联用,一方面降低DAS用量,从而减轻其毒副作用的发生;另一方面可解决青蒿素类药物复燃率高且单用易产生耐药性风险的缺陷。DAS有可能成为一种抗疟药应用于临床。本研究为青蒿素类药物与DAS的联用提供了实验依据。
[1]Cao J,Zhou SS,Zhou HY,Yu XB,Tang LH,Gao Q.Malaria from control to elimination in China:transition of goal,strategy and interventions[J].Chin J Schi Contl(中国血吸虫病防治杂志),2013,25(5):439-443.
[2]Fu Y,Ding Y,Guo B,Liu TP,Zheng H,Tan ZP,et al.Effect of diverse donor mice used on the development of experimental cerebral malaria[J].J Trop Med(热带医学杂志),2012,12(1):26-29.
[3]Luo D,Liu WG,Yang YM.Reaserch progress in antimalarial mechanism and drug-resistant mecha⁃nism of artemisinin and its derivatives[J].Med Innov China(中国医学创新),2014,11(9):131-134.
[4]Zhao SM, Wang MY.Artemisinin resistance inplasmodium falciparum:global status and basic research[J].Chin J Parasitol Parasit Dis(中国寄生虫学与寄生虫病杂志),2014,32(5):380-384.
[5]Xia LY.Traditional Chinese Materia Medica Toxi-cology(现代中药毒理学)[M].Tianjin:Tianjin Science and Technology Translation and Publishing Corp,2005:712-713.
[6]Zhang Y,Li C,Lei GL.Study of chemical consti⁃tutes inDichroa[J].Chin J Exp Tradit Med Form(中国实验方剂学杂志),2010,16(5):40-42.
[7]Lei HD,Liang JP,Guo ZY,Wang XH,Hua LY. Study on the acute toxicity ofDichroa febrifugaextractive[J].Chin Anim Husb Vet Med(中国畜牧兽医),2011,38(6):236-238.
[8]Li Y,Liu MC,Jin LH,Hu DY,Yang S.Advances in chemicalcomponents and bioactivities ofDichroa febrifugaLour.[J].Guangzhou Chem Ind(广州化工),2011,39(9):7-9.
[9]Medical teams for schistosoma and ancylostomiasis in Meishan.Clinical study for intervention of vomiting induced byDichroain treating malaria[J].J Chengdu College Tradit Chin Med(成都中医学院学报),1958,1(1):56-58.
[10]Zhou YL,Zhang DJ.Clinical study ofDichroaand their volatile materials in treating malaria[J].JChengdu College Tradit Chin Med(成都中医学院学报),1959,2(1):59-63.
[11]Xiong HM,Wei BQ,Wei RJ,Yang NH,Qi MY,Jin J,et al.Calculation of median lethal dose(LD50)forYersinia pestisby SPSS package[J].Chin J Zoonoses(中国人兽共患病学报),2013,29(11):1127-1130.
[12]Peters W.Drug resistance inPlasmodium bergheiVinckeetLips,1948.Ⅰ.Chloroquine resistance[J].Exp Parasitol,1965,17(1):80-89.
[13]Xu SY,Bian RL,Chen X.Methodology of Pharma⁃cological Experiments(药理实验方法学)[M].2nd ed.Beijing:People′s Medical Publishing House,1991:1317.
[14]Ma J. Countermeasures on mechanisms of nausea and vomiting induced by chemotherapy[J].Acta Acad Med Xuzhou(徐州医学院学报),2010,30(9):627-630.
[15]Zhang N.Analysis on the artemisinin resistance containment[J].Chin J Drug Eval(中国药物评价),2012,29(4):300-304.
Acute toxicity of Dichroa alkali salt and efficacy enhancement and toxicity alleviation in combination with artemisinin and its derivatives
LI Si-di,LI Chun,DAI Bao-qiang,ZHANG Guang-ping,SHENG Yi-hua,LI Jian-rong,YE Zu-guang
(Institute of Chinese Materia Medica,China Academy of Chinese Medical Sciences,Beijing 100700,China)
OBJECTIVE To explore the possibility thatDichroaalkali salt(DAS)can enhance effi⁃cacy and reduce toxicity when combined with artemisinin and its derivatives.METHODS Kunming mice were used in acute toxicity test of DAS.Diarrhea rate,mortality,50%lethal dose(LD50),LD90,50% diarrhea dose(DD50)and DD90were determined,and the safe dose of DAS was defined.An animal model of malaria was established by inoculating strains of the parasite in an antimalarialin vivoexperiment. The model mice were ig given drugs,once a day,for 4 d.The titer was compared between alone use and combined use of DAS with artemisinin and its derivatives.Blood of the caudal vein was dynamically collected for blood smear.Gemsa dying assay was used to observe whether the change of the parasite and its revival under a microscope in each group.Finally,negative conversion ratio,anti-revival ratio,50%effective dose(ED50)and ED90were calculated.RESULTS The safe dose of DAS was 0.5 mg·kg-1in acute toxicity test.While a low dose of DAS(0.25 and 0.5 mg·kg-1)was alone used,negative conversion ratio was relatively low and anti-revival effect was not obvious.In vivoexperiments of anti-mouse malaria indicated that compared with alone use of DAS 0.5 mg·kg-1or artemisinin with its derivatives〔artemisinin,dihydroartemisinin(Dih),artemether and artesunate〕,negative conversion ratio and anti-revival ratio were increased significantly(P<0.01,P<0.05)when DAS 0.5 mg·kg-1andartemisinin(134,192,274,392 and 560 mg·kg-1),Dih(52,80 and 123 mg·kg-1),artemether(10,20,40 and 80 mg·kg-1)and artesunate(32.5,65.0 and 130.0 mg·kg-1)were used in combination.When DAS 0.5 mg·kg-1and artemisinin with its four derivatives were in combination used,the titer was increased 1.8,1.2,2.0 and 1.6 times compared with alone use of artemisinin and its derivatives,respectively.In addition,diarrhea or death didn′t occur in combined groups.CONCLUSION DAS has a narrow safe dose window.DAS in combination with artemisinin and its derivatives can possibly reduce toxicity while enhancing efficacy.
Dichroaalkali salt;artemisinin;derivatives;malaria;efficacy enhancing and toxicity reducing
YE Zu-guang,E-mail:yezuguang@sina.com,Tel:(010)84252805
R285.1
A
1000-3002-(2016)08-0808-07
10.3867/j.issn.1000-3002.2016.08.003
Foundation item:The project supported by National Science and Technology Major Project of China(2014ZX09304-307);and National Science and Technology Major Project of China(2015ZX09501004)
2016-07-22接受日期:2016-08-19)
(本文编辑:贺云霞 齐春会)
国家科技重大专项(2014ZX09304-307);国家科技重大专项(2015ZX09501004)
李思迪,助理研究员,医学博士,主要从事药理学和毒理学研究;叶祖光,研究员,主要从事中药药理学和毒理学研究。
叶祖光,E-mail:yezuguang@sina.com,Tel:(010)84252805
——记2017年度国家科学技术进步奖二等奖获得者潘卫庆

