骨盆骨折大出血伴凝血病的救治策略
韦功滨,高劲谋,胡 平,杨 俊,王建柏,刘朝普
·论 著·
骨盆骨折大出血伴凝血病的救治策略
韦功滨,高劲谋,胡 平,杨 俊,王建柏,刘朝普
目的 总结骨盆骨折大出血伴凝血病的救治方法和治疗效果。方法 对1995年1月~2003年2月及2007年1月~2015年12月笔者科室收治的严重骨盆骨折大出血病例临床资料进行回顾性分析。其中1995~2003年未采用损害控制外科(DCS)及损害控制复苏(DCR)治疗的198例作为对照组;2007~2015年按照DCS及DCR技术治疗的423例作为治疗组。对照组均行Ⅰ期手术治疗;治疗组Ⅰ期急诊先行髂内动脉断血术以控制出血,伴脏器损伤者同时行相应手术控制出血并阻断污染,然后转往ICU按DCR原则行复苏治疗,生命体征平稳后行确定性手术。结果 对照组发生创伤性凝血病52例,其中死亡23例,死亡率44.23%(23/52)。治疗组中382例有进行性出血,86例出现凝血障碍。382例进行性出血急诊行髂内动脉断血术,其中206例加用骨盆外固定支架。对合并脏器伤按DCS原则行剖腹手术,同时按DCR原则作止血性复苏,及时输入血液制品及凝血因子。ICU复苏治疗生命体征平稳后行骨盆骨折固定等确定性手术。主要并发症包括盆腹腔感染17例、腹腔间隙综合征22例、脂肪栓塞综合征12例、深静脉血栓形成30例。治疗组中发生凝血病者死亡率为22.09%(19/86),主要死因为失血性休克。结论 严重骨盆骨折易并发创伤性凝血病。按照DCR原则行低压复苏和止血性复苏,同时行髂内动脉断血术加骨盆外固定支架控制出血,将明显提高救治生存率。
骨盆骨折; 腹部损伤; 并发症; 复苏; 损害控制
严重骨盆骨折是骨关节创伤中重要的致死原因,并发急性创伤性凝血病者救治难度更大[1]。近年来,随着对凝血病的认识深入、损害控制外科(DCS)理念的普及、复苏策略的改进,抢救成功率明显提高。笔者科室1995年1月~2003年2月收治骨盆骨折大出血198例(对照组),发生凝血病者52例;2007年1月~2015年12月收治骨盆骨折大出血423例(治疗组),其中出现凝血障碍者86例,现作回顾性分析。
临床资料
1 一般资料
对照组骨盆骨折伴大出血共198例,男性138例,女性60例;年龄18~85岁,平均(46.3±8.6)岁。致伤原因:道路交通伤126例,高处坠落伤72例。骨折分型:Tiles B型110例,C型88例。合并伤:腹部伤122例次,颅脑伤26例次,胸部伤85例次,脊柱四肢伤167例次,合并3个及以上部位损伤24例次。损伤严重度评分(ISS)20~68分,平均(35.5±7.1)分。发生凝血异常者52例。治疗组骨盆骨折并出血423例,其中男性292例,女性131例;年龄17~87岁,平均(45±7.7)岁。致伤原因:道路交通伤262例,高处坠落伤161例。骨折分型:Tiles B型247例,C型176例。合并伤:腹部伤328例次,颅脑伤74例次,胸部伤187例次,脊柱四肢伤362例次,合并3个及以上部位损伤53例次。ISS 16~72分,平均(36±5.4)分。423例失血量1 600~4 000mL,入院表现进行性出血382例,有休克262例,发生凝血异常者86例。ISS≥16分者412例。因时间跨度较大,未采用血栓弹力图测试作为凝血病诊断标准,仍以传统的凝血酶原时间(PT)、活化部分凝血酶原时间(APTT)、活化部分凝血酶原时间(INR)延长1.5倍以上作为诊断标准。两组患者一般资料见表1。

表1 两组患者一般资料比较
2 治疗方法
对照组未采用DCS技术及限制性液体复苏、损害控制复苏(DCR)等策略进行救治,抢救初期大量输液,均Ⅰ期手术治疗。
治疗组采用以下方式治疗。
2.1 液体复苏治疗 出血未控制前采用限制性液体复苏即低压复苏,将收缩压控制在80~85mmHg[2]。同时行止血性复苏,即液体复苏开始输入红细胞同时,全面补充凝血因子,包括新鲜冰冻血浆、冷沉淀和血小板;部分患者补充重组Ⅶa[3],以及48h内采集的全血;补充钙,纠正低温和酸中毒。
2.2 DCS原则三阶段治疗 第一阶段:控制致命性大出血,阻断污染,对不稳定性骨折行早期临时外固定及骨盆支架固定;第二阶段:ICU复苏以稳定生命状态;第三阶段:患者生理状况允许后,做延期的骨折确定性复位和内固定手术。
382例进行性出血行髂内动脉断血术,其中双侧髂内动脉结扎260例,双侧髂内动脉栓塞122例。加用骨盆外固定支架206例。急诊手术处理毗邻脏器损伤:膀胱破裂22例,后尿道损伤7例(3例膀胱后尿道同时损伤),行膀胱修补和(或)造瘘26例;腹膜外直肠损伤25例,均行乙状结肠近端造口并骶前引流;腹膜内结直肠损伤20例,其中Ⅰ期修补或切除吻合18例,结肠造口后期还纳2例。急诊处理腹内远隔脏器伤:脾破裂76例,其中行脾切除64例,选择性脾动脉造影栓塞8例次;肝破裂37例,其中行肝修补+肝固有动脉结扎27例,清创性肝切除+肝固有动脉结扎5例,清创性肝切除+肝固有动脉结扎+肝周填塞5例;肾破裂2例行肾切除;空回肠破裂52例,其中行肠修补43例,肠切除吻合9例;胰腺挫裂伤6例,行胰修补及胰周引流。腹外合并伤包括颅脑伤38例,胸伤53例,脊柱四肢伤26例,均做相应治疗。
患者生命状态相对稳定后,行骨折确定性内固定术。其中耻骨联合分离或伴耻骨骨折行解剖钢板内固定67例,耻骨联合分离伴耻骨骨折或伴髋臼骨折行钢板内固定54例,髋关节中心脱位髋臼骨折伴髂骨骨折行钢板内固定21例,耻骨联合分离伴骶髂关节脱位行钢板内固定22例,髂骨骨折伴骶髂关节脱位行钢板内固定31例,骶髂关节脱位伴骶骨骨折行钢板内固定19例。两组患者中发生凝血病者治疗情况比较见表2。
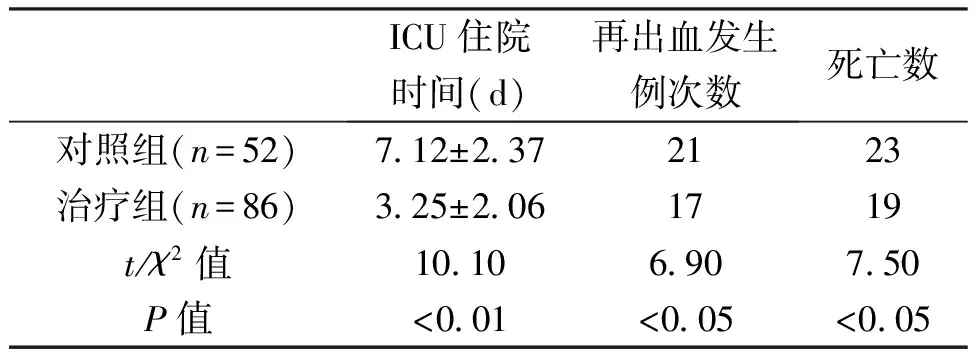
表2 对照组和治疗组中发生凝血病患者的治疗比较
3 统计学处理
结 果
对照组中出现凝血病者死亡率44.23%(23/52)。其中18例死于失血性休克,2例死于急性呼吸窘迫综合征(ARDS),1例死于多脏器功能衰竭(MODS),1例死于急性肾功能衰竭,1例因脑伤死亡。治疗组中出现凝血病者死亡率22.09%(19/86)。19例死亡病例中, 11例于术中或术后24 h内因失血性休克死亡,2例因严重胸伤、连枷胸、肺挫伤合并ARDS死亡,4例死于MODS,2例因深静脉血栓形成后脱落导致肺栓塞死亡,死亡组ISS平均值45.3分。术后并发症包括:9例合并ARDS者经呼吸机支持治疗痊愈;1例骶髂关节脱位伴右髂总动脉挫伤后血栓形成,行取栓手术失败后行截肢术;25例髂总静脉、髂外静脉血栓形成,经抗凝治疗好转,5例髂外静脉血栓形成后经下腔静脉滤网置放、溶栓、抗凝治疗痊愈,血栓形成者中共19例残存深静脉瓣膜功能障碍;2例出现肱静脉血栓形成,其中1例发生脱落致肺栓塞,经ICU抢救、复苏后存活;12例膈下脓肿行膈下引流术后治愈;3例肠间隙脓肿经引流后好转;17例乙状结肠造口术后于半年后顺利还纳,1例因肛门毁损永久造口;11例尿道断裂者后期行重建术后,2例出现尿道狭窄;4例盆腔感染,1例髂骨骨髓炎,经反复清创、引流术、死骨切除术后治愈。本组生存患者均获得6个月~2年随访。
讨 论
1 严重骨盆骨折时发生凝血病的原因
创伤性凝血病是严重骨盆骨折较为常见的并发症,虽然DCS技术的广泛实施极大地提高了严重骨盆骨折抢救的成功率,但并发凝血病者死亡率明显升高,其治疗仍然棘手。随着近年来研究的深入,对于凝血病的发病机制有了新的认识,为预防和治疗提供了全新的视野。目前认为组织灌注不足、组织损伤并非仅仅因为凝血因子消耗而导致创伤性凝血病[4]。严重骨盆骨折通常由高能量损伤导致,出血多,直接伤及动静脉概率高,组织损伤严重,常常伴有毗邻脏器及远隔器官损伤,因此极易发生创伤性凝血病。可以认为严重骨盆骨折从受伤一开始就已启动创伤性凝血病机制,在临床工作中需要从接诊初始即着眼于骨盆骨折的治疗和创伤性凝血病两方面的防治。凝血病可能因为组织损伤引起,也可能作为治疗过程中的并发症发生,而并发凝血病的严重骨盆骨折更易发生各种严重并发症,死亡率大大上升[5]。严重骨盆骨折发生创伤性凝血病的原因包括大失血、大量输血输液、创伤反应严重、易发生低体温和酸中毒[6]、易出现感染并发症、继发出血以及复苏不及时和输血不足等。
2 凝血病的诊断
经典的实验室诊断指标包括PT、INR、APTT超过正常值1.5倍以上,但实际工作中往往不能准确、实时反映病人实际状态。目前对于急性创伤性凝血病的机制尚未完全研究清楚,诊断和治疗也缺乏相应规范。公认的诊断标准需进行血栓弹力图检查,而这种检查耗时,对于抢救危重病人十分不利。有学者认为,出血>2 500mL时极易发生凝血障碍,而>3 000mL的失血将不可避免地发生凝血病[7]。严重骨盆骨折患者出现休克、凝血象异常、广泛渗血、皮下出血时即应考虑凝血病的诊断,应立即治疗。
3 严重骨盆骨折伴凝血病的治疗
自采用DCS技术以来,严重骨盆骨折救治成功率大幅提高。但数据表明伴有凝血障碍的创伤患者死亡率高于普通创伤患者3~4倍[8],骨盆骨折出现凝血病者死亡率大幅增高。对于严重骨盆骨折伴创伤性凝血病患者的救治,笔者的经验是高度重视DCR的核心内容,将低压复苏、止血性复苏、DCS技术三者紧密结合,作为治疗严重骨盆骨折伴凝血病的重要原则[7]:(1)低压复苏即限制性或延迟性复苏[9]。术前及术中控制收缩压在80~85mmHg,过度补液可增加骨折处管腔内压力,导致血凝块脱落造成持续性出血,过度补液也可稀释凝血因子、造成低体温,进而加重凝血病。限制性液体复苏能在短时间内维持较低但相对充足的组织灌注,但对于老年创伤患者,尤其是伴有原发性高血压者应谨慎维持血压于相对较高水平。(2)止血性复苏指大量输血时重视血制品比例,开始输血时即输入足量凝血因子,强调新鲜全血的价值;止血性复苏的根本着眼点在于重视预防凝血障碍而不是治疗,以减少致死三联征的发生。抢救的关键在于及时止血,同时补充凝血因子。目前推荐的输血标准为红细胞悬液、血浆、血小板比例为1∶1∶1输入[10],但实际工作中血小板往往不能及时获得,而新鲜全血更是难以获得。笔者的经验是预备适量AB型血浆,紧急时可先行输入。入院后第一时间预约血小板输注。实践证明,积极的有针对性的止血性复苏能大幅降低死亡率。 (3)按DCS原则尽快手术止血,这是比液体复苏更关键的措施。不能因为纠正休克输入大量晶体液及胶体液;也不能因为急于处理休克而忽视了第一时间采用止血性复苏措施;更不能因为确诊凝血病,没有及时采用可靠有效的外科止血措施。
笔者推荐的外科处理常规包括:(1)双侧髂内动脉断血术[5]。断血术不仅对于因动脉损伤出血有效,对于在骨盆骨折中更为常见的静脉性出血同样有效,通过阻断动脉血流,减小静脉回流量,降低管腔内压力,从而减少出血。同时因为盆腔内广泛的侧支循环,不至于引起器官缺血坏死。断血术包括双侧髂内动脉结扎以及造影栓塞。本组病例共实施双侧髂内动脉断血术328例,无一例出现盆腔内脏器缺血坏死。在具体术式选择上,对于伴有腹内脏器损伤需开腹处理者施行双侧髂内动脉结扎术,一并进行腹腔内脏器手术以达止血、阻断污染的目的。对于腹膜后血肿破入腹腔者出血往往不能自止,临床上难于判别是否伴有腹内脏器损伤,也推荐行剖腹探查及双侧髂内动脉结扎术;对于无腹腔内脏损伤无需剖腹,且经骨盆固定、止血性复苏措施处理后血流动力学相对好转的病例施行造影栓塞术。对于伴有严重骨盆骨折的老年创伤患者,凝血病更易发生,外科处理应积极、果断,尽量采用简化手术,避免过大手术打击。(2)骨盆骨折外固定。包括外固定支架固定、骨盆钳固定等,可以固定骨折,防止进一步损伤,同时能起到缩小盆腔容积,造成压迫而限制出血的作用,也使得危重病人易于转运ICU复苏。对于实施以上措施后效果仍不确定者加行腹膜外盆腔填塞。(3)毗邻脏器损伤按DCS的原则处理。遵循“抢救生命第一,保存器官功能第二”原则,急性期只进行止血手术和阻断污染手术,后期再行确定性手术治疗,包括骨折的固定、正常解剖结构的重建等。对于开放性骨盆骨折,出血凶猛,多伴有多脏器损伤。除外固定支架、髂内动脉断血术外,应Ⅰ期阻断污染,有胃肠破裂者需修补,腹膜外直结肠损伤者需单口造口,远端封闭,避免行襻式造口;伴尿道损伤者需行膀胱造瘘术、尿道会师术;会阴部创口需彻底清创,骶前充分引流[5]。因负压可加重出血,笔者并不主张Ⅰ期手术使用负压封闭引流(VSD)。本组1例骨盆及下腹部碾压伤患者,急诊入院后立即行骨盆外固定支架固定术、双侧髂内动脉断血术、乙状结肠造瘘术、会阴开放伤口清创术、骶前引流术,转入ICU复苏成功,后期出现盆腔内感染、脓毒血症,治疗后采用外固定支架作为最终固定方式,7个月后行乙状结肠还纳,随访患者生活自理能力良好。
发生创伤性凝血病者经急性期治疗好转后,后期更易发生高凝状态和血栓形成[11]。骨盆骨折者应警惕下肢深静脉血栓形成,应定期检查肢体肿胀情况,复查凝血象、D-二聚体、超声检查等,必要时抗凝治疗。
文献指出DCR措施可以快速纠正致死三联征[12]。笔者认为对于严重骨盆骨折伴创伤性凝血病的处理应该以DCR为指导,做到在DCS手术止血的基础上,应用低压复苏、止血性复苏的措施实施救治,这样才能取得好的疗效。
[1] Costantini TW, Coimbra R, Holcomb JB, et al.Current management of hemorrhage from severe pelvic fractures:results of an American Association for the Surgery of Trauma multi-institutional trial [J].J Trauma Acute Care Surg,2016,80(5):717-725.
[2] 任建安,黎介寿.损伤控制性复苏[J].中国实用外科杂志,2007,27(8):593-594.
[3] 黄光斌,王攀,何平,等.重组活化Ⅶ因子在严重多发伤凝血功能障碍中的应用[J].中华创伤杂志,2013,29(7):588-590.
[4] Cohen MJ,Kutcher M,Redick B,et al.Clinical and mechanistic drivers of acute traumatic coagulopathy[J].J Trauma Acute Care Surg,2013,75(S):S40-47.
[5] 高劲谋.骨盆骨折合并脏器损伤的救治[J].创伤外科杂志,2011,13(4):289-291.
[6] Spahn DR,Bouillon B,Cerny V,et al.Management of bleeding and coagulopathy following major trauma: an updated European guideline[J].Crit Care,2013,17(2):R76.
[7] 高劲谋.损伤控制复苏的研究进展[J].中华创伤杂志,2013,29(3):193-195.
[8] Curry N,Davis PW.What’s new in resuscitation strategies for the patient with multiple trauma [J].Injury,2012,43(7):1021-1028.
[9] Burkhardt M,Kristen A,Culemann U,et al.Pelvic fracture inmultiple trauma:are we still up-to-date with massive fluid resuscitation [J]. Injury,2014,45(S):S70-75.
[10] Holcomb JB,Zarzabal LA,Michalek JE,et al.Increased platlet:RBC ratios are associated with improved survival after massive transfusion[J].J Trauma,2011,71(2):318-328.
[11] Brohi K,Cohen MJ,Ganter MT,et al.Acute traumatic coagulopathy: initiated by hypoperfusion: modulated through the protein C pathway[J].Ann Surg,2007,245(5):812-818.
[12] 黄强,杨洋,魏安卿,等.损伤控制性复苏对创伤性凝血障碍的影响[J].中国急救医学,2013,33(10):901-903.
(本文编辑: 黄小英)
Treatment strategy of pelvic fractures associated with trauma induced coagulopathy
WEIGong-bin,GAOJin-mou,HUPing,YANGJun,WANGJian-bai,LIUChao-pu
(Department of Traumatology,Chongqing Emergency Medical Center,Chongqing 400014,China)
Objective To summarize managing methods for pelvic fractures associated with trauma induced coagulopathy. Methods A retrospective analysis was done on the clinical data of 423 cases of severe pelvic fractures treated by damage control surgery(DCS) and damage control resuscitation(DCR) from Jan.2007 to Dec.2015. Another 198 cases,as the control group,were treated without DCS or DCR from Jan.1995 to Feb.2003. And the former was as the study group. The control group underwent definitive operation initially. The study group underwent internal iliac arteries devascularization in the first place,followed by surgical interventions for hemostasis and blocking contamination. Patients were then transferred to ICU for further resuscitation based on DCR protocol. Definitive operations were performed only when patients became stable. Results Traumatic induced coagulopathy developed in 52 patients in the control group,including 23 deaths among them. And the mortality was 44.23%(23/52). In the study group,there were 382 cases with ongoing hemorrhage,and trauma induced coagulopathy occurred in 86 cases. A total of 382 patients with ongoing hemorrhage underwent emergent internal iliac arteries devascularization,206 of whom received pelvic external fixation. In patients associated with visceral injuries,laparotomy was performed in accordance with DCS. Abiding by the principle of damage control resuscitation,hemostatic resuscitation measures were performed,and blood products and coagulation factor were transfused in the first place. The definitive surgery was performed when vital signs got stable after further resuscitation in ICU. The main complications included 17 cases of sepsis of pelvic and abdominal cavity,22 cases of abdominal compartment syndrome,12 cases of fat embolisation syndrome,and 30 cases of deep venous embolism. The death rate of the study group was 22.09%(19/86). The main cause of death was hemorrhagic shock. Conclusion Trauma induced coagulapathy would easily develop when pelvic fractures are severe. It would be greatly helpful in treating such patients with DCR protocol,combined with internal iliac arteries devascularization and pelvic external fixation to control hemorrhage,and the survival rate will be improved obviously.
pelvic fracture; abdominal injury; complication; resuscitation; damage control
1009-4237(2016)11-0648-04
400014 重庆,重庆市急救医疗中心创伤科
R683.3
A 【DOI】 10.3969/j.issn.1009-4237.2016.11.003
2016-07-05;
2016-09-18)

