第三代流式细胞分选仪及96孔板分选单个细胞的方法及参数优化
闵智慧, 程韵枫
1.复旦大学附属中山医院临床研究院实验研究中心,上海 200032 2.复旦大学附属中山医院血液科,上海 200032 3.复旦大学附属中山医院青浦分院实验研究中心,上海 201700 4.复旦大学附属中山医院青浦分院血液科,上海 201700 5.上海市器官移植重点实验室,上海 200032
技术与方法
第三代流式细胞分选仪及96孔板分选单个细胞的方法及参数优化
闵智慧1,3,5, 程韵枫1,2,3,4,5
1.复旦大学附属中山医院临床研究院实验研究中心,上海 200032 2.复旦大学附属中山医院血液科,上海 200032 3.复旦大学附属中山医院青浦分院实验研究中心,上海 201700 4.复旦大学附属中山医院青浦分院血液科,上海 201700 5.上海市器官移植重点实验室,上海 200032
目的:用第三代流式细胞分选仪比较不同直径喷嘴分选的单细胞的得率及细胞活性,进一步完善单细胞微孔板分选的参数设置及条件优化。方法:用FACSAria Ⅲ 流式细胞分选仪及96孔板对Raji细胞、A549、DT 40、RAW 264.7 细胞系进行单细胞分选,分别采用70 μm 、100 μm 和130 μm喷嘴分选,比较分选后单细胞得率及克隆形成率。结果:在单细胞分选模式下,用3种不同直径喷嘴及96孔板分选后的单细胞得率为86.55%~93.44%,即96孔板有单细胞的孔数为84~92孔;分选后的单个细胞培养7 d后,经70 μm 、100 μm 和130 μm喷嘴分选的单细胞克隆孔数分别为31~52孔、49~70孔、58~78孔。结论:进行单细胞微孔板分选时,在精确调节及优化实验参数的前提下,为了保证单细胞的活性,应优先选择100 μm或130 μm喷嘴。
单细胞分选;流式细胞分选仪;96孔板;喷嘴;液滴延迟
随着分选型流式细胞仪功能的不断完善,其在单细胞分选相关研究中的应用越来越广泛,尤其广泛应用于细胞个体差异研究、单细胞基因测序、转录组学研究[1],以及代谢物转运途径、肿瘤细胞免疫应答机制、富集异质性微生物群落研究等方面[2-5]。第3代分选型流式细胞仪FACSAriaⅢ是FACSAria系列最新型的高端分选系统之一,其光学系统具有更高的灵敏度和检测分辨率,液流系统较前两代更加稳定,且有更好的数据获取和分析功能,这些特点有利于提高分选效率。此外,分选前流式细胞仪参数、喷嘴尺寸的选择对于保证高分选效率和高分选纯度亦很重要,但这需要丰富的经验和一定的技巧,且目前相关报道很少。本研究旨在探讨应用FACSAriaⅢ及96孔板进行单细胞分选时的主要参数调节及不同直径喷嘴对细胞纯度和活性的影响,为单细胞分选相关研究提供技术支持。
1 材料与方法
1.1 仪器与试剂 FACSAriaⅢ分选型流式细胞仪,自动细胞定位分选装置 (ACDU) 及ACDU制冷循环装置、质控微球(货号:642412)、分选荧光校准微球(货号:345249)、FACSFlow鞘液20 L(货号:342003)均购自美国BD 公司;RPMI-1640培养液、DMEM培养液、胎牛血清(FBS)和胰酶均购自美国Gibco公司。
1.2 方 法
1.2.1 细胞培养与样本制备 人Burkitt's 淋巴瘤Raji细胞、人肺腺癌细胞A549、鸡淋巴瘤DT 40采用含10%FBS的RPMI-1640培养液培养,小鼠单核巨噬白血病细胞RAW 264.7用含10%FBS的DMEM培养液培养。所有细胞均置于含5% CO2、37℃、饱和湿度的细胞培养箱内培养。分选前将对数生长期的A549和RAW 264.7细胞用胰酶消化,制备成单细胞悬液;将Raji 和DT 40细胞重悬, 300×g离心5 min,再次制备成单细胞悬液。细胞均重悬于无菌磷酸盐缓冲液(PBS)中(1×106个/mL),用400目滤网过滤,置于冰上。整个操作过程在超净台中完成。
1.2.2 流式细胞仪常规校准 打开FACSAriaⅢ 仪器总开关及电脑的Diva软件,联机后执行开机程序。首先安装70 μm喷嘴 (nozzle,应用前经超声洗涤1 min) ,从Diva软件菜单Sort Setup中选择对应的喷嘴尺寸,cytometer菜单中选择相应配置 (Configuration) ,打开主液流窗口 (Stream) ,待液流稳定后,调节液滴的频率 (Freq) 和振幅 (Ampl),使液流断点位于窗口的1/3~2/3处、液滴断裂间隔数值 (Gap) 趋于恒定。然后进入仪器质控CS&T程序,根据流程提示,上样CS&T质控微球,仪器自动质检通过表明仪器整体状态稳定,可开始单细胞分选。70 μm喷嘴单细胞分选完毕后更换成100 μm及130 μm喷嘴,每更换1次喷嘴须重新按照上述步骤调节仪器。
1.2.3 分选偏转液流调节 进行微孔板分选时,需要于分选槽下方插入液滴防溅板,用75%乙醇擦拭电极偏转板,使其保持清洁、干燥。调好主液流后,点中侧液流窗口的电压 (Voltage) 图标,使液流带电,激活测试分选 (Test Sort) 图标,通过微调振幅和第2滴 断点(Drop 2)使4路偏转的液流分束清楚且各自集中。打开Waste Drawer图标,肉眼观察带电液流偏转情况,通过移动下方的滑动条使左侧带电偏转的两束液流 (Left和Far Left) 重合通过防溅孔中心(下方滑动条的数字一致代表两束液流重合),再关闭右侧偏转的两束液流,调节完毕后关闭Waste Drawer。在主液流窗口输入第1滴断点(Drop 1)和Gap的实际数值后,选中同窗口的Sweet Spot图标后,FACSAriaⅢ自动调节液滴振幅使Drop 1 位置保持恒定,断点位置波动在1~10属于可接受范围。
1.2.4 液滴延迟调节 根据试剂说明书用PBS配制分选荧光校准微球,用于分选时液滴延迟的调节。先建立调节液滴延迟的实验文件,创建新的样品管及工作模板,在工作界面建立散点图 (FSC 比 SSC) 和柱状图 (FSC histogram),设Interval门为P1,包括整个柱状图,固定FSC阈值为5 000。创建分选窗口(Sort Layout),在设备 (Device)窗口中选择2管( Tube),在分选指标(Target events)选项中选连续分选(continuous),分选左路添加 P1门。上样稀释好的荧光校准微球,调节流速为1 000~1 500个/s,打开Auto Delay 软件仪器以自动调节液滴延迟并保存数值。
1.2.5 分选前96孔板精确定位 提前打开ACDU 制冷循环装置,温度设为4℃,预冷。将96孔板置于ACDU上,使A1孔位于左前方。软件菜单依次选择分选 (Sort)、主页设置(Home Device),出现设备安装(Device Setup)界面 (图1),选择96孔板,点击显示主页(Go to Home),96孔板自动移动到默认分选开始位置,再点开该界面的测试液滴图标,系统自动加电,左边产生一束偏转液流通过防溅孔中心落入96孔板的板盖上。如果液流没有落在A1孔中心位置,可点击界面中的双箭头和单箭头对孔板位置进行粗调和微调。调好后,点击固定主页 (Set Home),保存即可。为了分选的精确定位,还需要预分选细胞到孔板盖上,观察液滴位置。取500 μL准备好的样本于流式管中,上样,建立散点图 (FSC比 SSC),并设好P1门,在Sort Layout的Device菜单中选96孔板 (96-Well Plate),精度 (Precision)菜单中选单细胞 (Single Cell),分选 A~C前三横排,每排分P1门的10个细胞,点击Sort,开始分选。分好后,取出96孔板,观察盖子上小液滴是否位于每个孔的中心,如果有偏移还应进入Device Setup界面进行微调。

图1 ACDU精确定位界面
1.2.6 96孔板单细胞分选 提前打开上样仓4℃预冷,取下96孔板的盖子,96孔板每孔预先加入100 μL培养液。新建实验文件,建立散点图 (FSC比 SSC),设P1门选定A549或Raji细胞;对于Raw 264.7细胞和DT 40细胞,再设P2门选定GFP阳性细胞。分别加入用300目无菌尼龙筛网过滤后的不同种类的细胞,在Sort Layout依次设每孔分选P1或P2门内的1个细胞,开始分选,每种细胞依次用70 μm 、100 μm及130 μm喷嘴分别分选3块96孔板。分选结束后,立刻加盖并取出96孔板,倒置显微镜下观察计数分选后的单细胞孔数,再置于细胞培养箱内,培养7 d后计数有单细胞克隆的孔数。
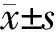
2 结 果
2.1 3种不同直径喷嘴液流调试结果 依次安装70 μm 、100 μm 和130 μm 喷嘴后,调试好的主液流见图2A~2C。主液流断点及Gap灰带位于窗口的1/3~2/3处,每个主液滴近似圆形,卫星点逐渐融入主液滴。液流加电压后,侧液流窗口可见清晰集中的直径约2 mm左右的斑点,中央流入废液槽的斑点直径约4 mm。如果斑点不够明亮,可调节摄像头的螺钉旋钮,至液流光斑最亮。调节滑动条将 Far Left 和 Left 两束液流重合使其通过防溅孔中心 (图2D)。
2.2 3种不同直径喷嘴液滴延迟调试结果 液滴延迟时间为从激光分析检测点到液流充电断裂成液滴的时间。液滴延迟需要调节,FACSAria Ⅲ具备自动调试液滴延迟的功能。不同直径的喷嘴液滴延迟数值不同,本实验中,经软件自动调节的70 μm、100 μm、130 μm喷嘴的液滴延迟值分别为42.31、30.60、18.68,左框的液滴比例达99%~100%(图2E~2G),说明分选精确性较高。

图2 3种喷嘴液流断点、偏转液流通过防溅孔中心及液滴延迟调节结果
A、B、C:液滴通过70 μm、100 μm、130 μm喷嘴;D:偏转液流通过防溅孔中心(箭头所示为防溅孔中心);E、F、G:液滴通过70 μm、100 μm、130 μm喷嘴的延迟值
2.3 分选前96孔板精确定位结果 调节偏转液流使其落到96孔板A1孔中心位置后,进行预分选至板盖,进一步观察分选液滴实际下落的位置。结果显示,由10个细胞组成的液滴分选至前3排板盖每孔中心点,且在光线下清晰可见,分选时微孔板的位置未发生偏移。
2.4 不同直径喷嘴对用96孔板分选的单细胞纯度及活性的影响 在96孔板Single Cell分选模式下,70 μm喷嘴分选的Raji、A549、Raw 264.7、DT 40单细胞孔数为84~90,所占百分比(即单细胞得率)分别为(92.36±2.19)%、(87.84±0.33)%、(90.63±1.73)%、(88.89±0.86)%;100 μm喷嘴分选的上述4种细胞的单细胞孔数为85~92,所占百分比分别为(93.44±1.02)%、(89.54±1.51)%、(90.06±1.85)%、(87.82±0.38)%;130 μm喷嘴分选的上述4种细胞的单细胞孔数为86~90,所占百分比分别为(89.75±0.87)%、(90.25±1.33)%、(90.84±1.59)%、(86.55±1.47)%。分选后的单个细胞培养7 d后,用70 μm喷嘴分选的单细胞克隆形成的孔数为31~52孔;用100 μm喷嘴分选的单细胞克隆形成的孔数为49~70孔,用130 μm喷嘴分选的单细胞形成克隆的孔数为58~78孔。倒置显微镜下观察,见细胞折光性好;培养7 d后,可见数十个细胞分裂形成克隆,Raw 264.7和DT40由于转染有GFP载体而呈绿色荧光(图3)。
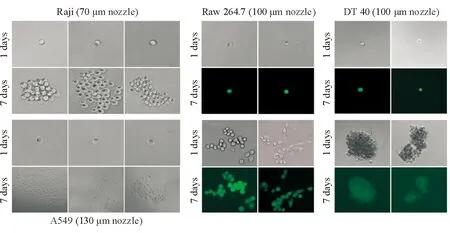
图3 3种喷嘴96孔板分选的4种单细胞的培养结果Original magnification: ×200
3 讨 论
单细胞分选技术有助于观察细胞状态,研究基因表达及调控,进而分析疾病病理进展的本质。目前,流式细胞仪分选是获取单个细胞的最佳方法。该方法具有高通量、多参数、耗时短、无污染等优势,而且分选后的细胞能直接培养、移植,用于提取核酸、单细胞PCR扩增或原位杂交等,以及进行细胞基因、蛋白、功能水平的研究和不同细胞的差异化研究[6-9]。
流式细胞仪分选时,样本流在鞘液的包裹和流体动力学的推动下,以一定速度聚焦并从流动室的喷嘴喷出。由于喷嘴处有超高频的压电晶体,能产生高频振荡,当加电压后喷出的液流被振荡断裂成均匀的微小液滴,待分选的细胞即分散在这些液滴中。通过设置,待分选的细胞可被充以正、负电荷,当流经电压偏转板时,在电场的作用下发生偏转落入收集管或微孔板中,没有充电的液滴落入中间的废液槽,从而实现细胞的分选。进行微孔板分选需要在Single Cell模式下,调节Far Left液流的偏转使其通过防溅孔中心。Single Cell分选模式较Purity或Yield模式对液流调试的精确度要求更高,尤其是对分选前96孔板A1 孔的精确定位,如果液滴没有落在A1孔的中心位置,将会影响后续分选的准确性,细胞容易发生偏移甚至落在孔板的间隙。因此稳妥的方法是除了要微调偏转液流使其通过防溅孔中心落到96孔板A1孔中心位置,还要进行预分选细胞到96孔板盖上前3~5排,每孔10个细胞,分好后再肉眼观察10个细胞形成的可见小液滴落入孔的实际位置,再据此进行微调使液滴落入孔中心。只要观察到大多数液滴落入前3~5排孔的中心位置,就能保证整块微孔板分选时的准确位置。在96孔板分选时,理论上可以获得100%的单细胞分选得率,而实际上仪器运行中样本流、鞘液流细微的波动以及ACDU装置移动时的轻微惯性等因素都可能导致个别细胞发生偏移而无法落入孔内,使单细胞分选得率一定程度降低。
本研究选用常用的3种不同直径的喷嘴对4种细胞系进行96孔板单细胞分选,观察分选后单细胞得率及细胞活性,结果表明,3种细胞系经3种喷嘴分选后的单细胞得率均无明显差异,单细胞得率在86%以上,说明3种喷嘴都能实现良好的单细胞分选得率。但是培养7 d后,结果显示,用70 μm喷嘴分选的单细胞的克隆形成孔数为31~52孔,130 μm喷嘴分选的单细胞的克隆形成孔数最多78孔,而100 μm喷嘴分选的单细胞的克隆形成孔数介于两者之间,为49~70孔,表明喷嘴直径越大,分选的细胞活性越好,单细胞形成的克隆孔数也越多。这与不同直径的喷嘴液流压力不同有关,130 μm喷嘴管路中液流压力为10 psi,100 μm喷嘴液流压力为20 psi,70 μm喷嘴液流压力最高,为70 psi。流式细胞仪鞘液和样本流的高速流动都是由压力驱动的,直径小的喷嘴对应的流速和振荡频率较大,形成的包裹细胞的液滴小而多,分选速度随之增加,但分选后的细胞活性降低,体积偏大且脆弱的细胞经小喷嘴分选后甚至形成细胞碎片;而直径大的喷嘴形成的包裹液滴较大,能给细胞较多的缓冲保护作用,另外直径大的喷嘴分选时鞘液压力更低,样本细胞所承受的压力也更小,分选后的细胞活性相应增高。选择喷嘴尺寸时还要根据细胞大小来决定,喷嘴直径一般大于细胞的5倍才会得到最佳单细胞得率及活性。例如,Raji淋巴瘤细胞直径约15 μm,可选择100 μm或130 μm喷嘴进行分选。此外,虽然选择130 μm喷嘴可得到较高的细胞活性,但这种大尺寸喷嘴更适合分选体积较大的原代细胞等,而且其调试也需要花费更长时间,而100 μm喷嘴足以适用于与淋巴瘤细胞近似大小的多种细胞的分选。除仪器因素外,细胞样本的制备对分选结果也起决定性的作用,合格的细胞样本应为:单个细胞悬浮、细胞碎片较少、细胞生长活力良好。本实验选用的细胞为新复苏,处于对数生长期,活性好,因此单细胞克隆形成率也较高。单细胞分选时,细胞悬液的细胞密度不能太高,每秒通过喷嘴500~3 000个细胞可得到较好的分选得率,这可能与细胞密度越小,液流的稳定性越好、单位时间内通过激光检测区的细胞数越少有关,从而提高细胞检测的灵敏度,进而提高分选效率和纯度。此外,我们应用ACDU制冷循环装置,使分选时的温度维持在4℃,保证细胞活力;实验用的鞘液也是仪器专配的20 L无菌PBS,背景噪点低,对分选的干扰较小。
综上所述,合适的喷嘴大小、精确的液滴延迟、稳定的液流、适中的细胞密度及良好的细胞状态是保证单细胞分选纯度及活性的关键,只有平衡上述因素才能得到最佳的分选效果。100μm喷嘴适用于细胞直径在20 μm以下的单细胞分选;130 μm喷嘴更适用于体积偏大的原代细胞等的单细胞分选;而70 μm喷嘴虽然也有较高的单细胞分选率,但其鞘液压力偏高使分选后的单个细胞活性降低。因此,应尽量用大喷嘴低压力进行单细胞分选。该实验为应用流式细胞仪及微孔板进行单细胞分选的流程及参数选择提供了一定的参考,有助于单细胞分选技术的更好应用及后序基因测序等实验的进行。
[1] RINKE C, LEE J, NATH N, et al.Obtaining genomes from uncultivated environmental microorganisms using FACS-based single-cell genomics[J].Nat Protoc, 2014, 9(5): 1038-1048.
[2] IBRAHIM S F, VAN DEN ENGH G.High-speed cell sorting: fundamentals and recent advances[J].Curr Opin Biotechnol, 2003, 14(1): 5-12.
[3] CZECHOWSKA K, JOHNSON D R, VAN DER MEER J R.Use of flow cytometric methods for single-cell analysis in environmental microbiology[J].Curr Opin Microbiol, 2008, 11(3): 205-212.
[4] KATSURAGI T, TANI Y.Screening for microorganisms with specific characteristics by flow cytometry and single-cell sorting[J].J Biosci Bioeng, 2000, 89(3): 217-222.
[5] WIACEK C, MÜLLER S, BENNDORF D.A cytomic approach reveals population heterogeneity of Cupriavidus necator in response to harmful phenol concentrations[J].Proteomics, 2006, 6(22): 5983-5994.
[6] MAGBANUA M J, PARK J W.Isolation of circulating tumor cells by immunomagnetic enrichment and fluorescence-activated cell sorting (IE/FACS) for molecular profiling[J].Methods, 2013, 64(2): 114-118.
[7] HAROON M F, SKENNERTON C T, STEEN J A, et al.In-solution fluorescence in situ hybridization and fluorescence-activated cell sorting for single cell and population genome recovery[J].Methods Enzymol, 2013, 531: 3-19.
[8] MORONO Y, TERADA T, KALLMEYER J, et al.An improved cell separation technique for marine subsurface sediments: applications for high-throughput analysis using flow cytometry and cell sorting[J].Environ Microbiol, 2013, 15(10): 2841-2849.
[9] MANOME A, ZHANG H, TANI Y, et al.Application of gel microdroplet and flow cytometry techniques to selective enrichment of non-growing bacterial cells[J].FEMS Microbiol Lett, 2001, 197(1): 29-33.
[本文编辑] 姬静芳
Method and parameter optimization of the third-generation flow cytometry sorter and 96-well plate in single cell sorting
MIN Zhi-hui1,3,5, CHENG Yun-feng1,2,3,4,5
1.Experimental Research Center of Institute for Clinical Sciences, Zhongshan Hospital, Fudan University, Shangha 200032, China 2.Department of Hematology, Zhongshan Hospital, Fudan University, Shanghai 200032, China 3.Experimental Research Center, Qingpu Branch of Zhongshan Hospital, Fudan University, Shanghai 201700, China 4.Department of Hematology, Qingpu Branch of Zhongshan Hospital, Fudan University, Shanghai 201700, China 5.Shanghai Key Laboratory of Organ Transplantation, Shanghai 200032, China
Objective:To compare the sorted single cell rate and cell viability with different diameters of nozzles by the third-generation flow cytometry sorter FACS Aria Ⅲ so as to further improve the optimization of parameter settings and conditions for single-cell microplate sorting.Methods:Single-cell sorting of four different types of cell lines-Raji cells, A549, DT40, RAW 264.7 cell line-was done on FACSAria Ⅲ flow cytometry sorter and 96-well microplate.70 μm, 100 μm and 130 μm diameter nozzles were adopted respectively, and the sorted single cell rate and the cell colony-forming rate were counted.Results:In the single-cell sorting mode, the percentages of sorted single cell with three nozzles were from 86.55% to 93.44%, which meant that the hole numbers with single cell in the 96-well micorplate were from 84 to 92.After 7-day culture, Single cell clone hole numbers sorted by 70 μm, 100 μm and 130 μm diameter nozzles were 31-52, 49-70 and 58-78, respectively.Conclusions:In single cell sorting with the microplate and under the premise of accurate adjustment and optimization of parameters, 100 μm or 130 μm nozzles should be given preference for single cell activity.
single-cell sorting; flow cytometry sorter; 96-well microplate; nozzle; drop delay
2016-01-14[接受日期]2016-10-15
国家自然科学基金(81170473).Supported by National Natural Science Foundation of China (81170473).
闵智慧, 硕士,工程师.E-mail: min.zhihui@zs-hospital.sh.cn
10.12025/j.issn.1008-6358.2016.20151012
Q 2-33
A

