多发性硬化患者外周血S100A8/A9、TLR4和MMP-2表达水平的变化
刘大进, 吴明凤, 余 浩, 张振中, 马 丽, 姚瑞芹
徐州医科大学神经生物学研究中心,徐州 221004
短篇论著
多发性硬化患者外周血S100A8/A9、TLR4和MMP-2表达水平的变化
刘大进, 吴明凤, 余 浩, 张振中, 马 丽, 姚瑞芹*
徐州医科大学神经生物学研究中心,徐州 221004
目的:探讨多发性硬化(multiple sclerosis, MS)患者外周静脉血血清钙结合蛋白复合物(S100A8/A9)、Toll-样受体4(Toll-like receptor 4, TLR4)和基质金属酶蛋白2(matrix metalloproteinase-2, MMP-2)表达水平的变化。方法:选取MS患者16例作为MS组,健康体检者16例作为对照组。采用蛋白芯片检测法对血清样本进行检测,定量分析血清S100A8/A9、TLR4和MMP-2表达水平的变化。结果:MS组血清S100A8/A9、TLR4和MMP-2水平均高于对照组(P<0.01);MS组患者血清中上述3个指标具有明显相关性(P<0.05)。结论:MS患者血清S100A8/A9、TLR4和MMP-2表达上调,联合检测三者可能有助于临床MS疾病活动状态的判断。
多发性硬化;S100A8/A9;TLR4;MMP-2
多发性硬化(multiple sclerosis,MS)是一种中枢神经系统(central nervous system, CNS)脱髓鞘性疾病,其发病与多种因素有关,其中自身免疫性炎症反应在MS的发生发展中发挥着重要作用。研究表明,钙结合蛋白复合物(S100A8/A9)参与了神经系统炎症反应的起始过程[1],并且在多种急慢性炎症性疾病[2]和肿瘤疾病[3]中发挥重要作用。S100A8/A9不仅可作为Toll-样受体4(Toll-like receptor 4, TLR4)的内源性配体与其结合,促进IL-17的表达并激活CD8+T细胞,从而诱发自身免疫反应[4],而且可以通过激活基质金属酶蛋白2(matrix metalloproteinase-2, MMP-2)介导组织损伤[5]。TLR4的激活可以直接通过NF-κB信号通路促进其下游靶蛋白MMP-2的表达和激活[6-7],发挥生物学功能。因此,上述三者功能上的紧密联系与多种疾病的发生发展密切相关。MS作为典型的神经系统免疫性损伤疾病,其发病过程中上述3个指标可能呈现规律性改变,但目前鲜见关于S100A8/A9、TLR4和MMP-2在MS病程中的变化报道。因此,本研究检测了上述指标在MS患者血清中的表达变化,旨在探讨三者与MS的关系,为MS的临床诊断、治疗及预后提供理论依据。
1 资料与方法
1.1 一般资料 选取2015年3月至2015年6月在徐州医科大学附属医院住院的MS确诊患者16例为MS组,其中男性4例,女性12例;年龄25~50岁,平均(40.13±9.00)岁。全部MS患者均符合2010年McDonald诊断标准[8]。排除标准:入院前3个月内接受免疫调节治疗的患者;合并其他免疫相关疾病,如系统性红斑狼疮、糖尿病、肿瘤等患者;合并颅内外感染,如脑炎、脑膜炎等患者;脑卒中患者。
对照组为本院健康体检者16例,其中男性4例,女性12例;年龄25~48岁,平均(38.88±6.92)岁,无心肝肾等器质性疾病史,采血前1周无服药史,自愿参与研究。两组人群年龄、性别构成、病程和受教育年限差异无统计学意义(表1),具有可比性。
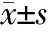

组别n年龄(岁)性别(男/女)病程(年)受教育年限(年)MS组1640.13±9.004/125.75±2.3210.13±2.64对照组1638.88±6.924/12-10.50±3.67P值1.0000.6351.000-0.872
1.2 检测方法 采用RayBio○RG-系列玻片式人细胞因子抗体芯片(蛋白芯片)对血清样本进行检测,并通过激光扫描仪检测荧光信号,定量分析血清S100A8/A9、TLR4和MMP-2水平。所有患者均签署知情同意书后,MS组于上午采血,正常对照组于清晨空腹抽血,采肘静脉血5 mL,立即1 500×g离心5 min,取上清分装于分离管内,标记,-80℃冻存待测。蛋白芯片检测由广州瑞博奥生物科技有限公司完成。
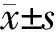
2 结 果
各组患者血清S100A8/A9、TLR4和MMP-2水平荧光定量分析结果显示,MS组血清S100A8/A9、TLR4和MMP-2水平均高于对照组(图1)。

图1 2组患者血清S100A8/A9、TLR4和MMP-2水平的比较**P<0.01, ***P<0.001与对照组相比
MS组患者血清S100A8/A9、TLR4及MMP-2相关性分析显示,在去除个别离群值后,3者之间两两相关性良好,相关系数有统计学意义(P<0.05,图2)。

图2 MS组血清S100A8/A9、TLR4和MMP-2水平相关性分析散点图
3 讨 论
MS的发病机制复杂,临床表现多样,目前对于MS疾病的诊断主要是依据临床表现结合脑脊液、神经电生理学和影像学检查。血清学检查在目前的临床诊断中应用极少。本实验通过检测患者血清中S100A8/A9、TLR4和MMP-2水平变化发现,三者在MS患者血清中的含量比正常对照组明显升高,提示血清学相关细胞因子检测在临床MS患者诊断中可能也具有一定的辅助价值。对于传统的诊断标准难以评价和确诊的MS,应用血清学检查有望成为重要的诊断依据,实现早期诊断和及时治疗。
自身免疫性炎症反应在MS的发生发展中扮演重要角色。免疫系统的活化与炎症因子的释放是介导自身免疫病的基础。S100钙调素蛋白家族中的重要成员S100A8和S100A9构成的异源二聚体S100A8/A9参与炎症反应,与机体自身免疫病关系密切。其主要存在于炎性细胞的胞质中或胞膜上,在炎症状态下,炎性细胞活化后被释放入血浆及体液,因而被认为是一种潜在的临床炎症标记物。S100A8/A9已被证实在多种炎症状态下高表达,如巨细胞性动脉炎、囊性纤维病、类风湿性关节炎、恶性肿瘤及自身免疫性疾病[9-10]。但其在临床MS病程中的具体变化目前未见报道。多数学者认为,在自身免疫病患者疾病发作前,尚无任何其他临床标记可提示时,S100A8/A9已开始升高。本研究中MS组患者血清S100A8/A9水平较正常对照组显著升高,S100A8/A9在MS组血清中含量远远高于对照组(约10倍),进一步证实了上述观点。且van Bon等[11]通过蛋白质组学检测发现,在另一种自身免疫性疾病系统性硬化患者的血清中,S100A8/A9水平明显上调。提示S100A8/A9对于自身免疫性疾病如MS的诊断和治疗具有一定的意义。
TLR4是天然免疫系统识别病原微生物的主要受体,通过与微生物病原相关分子模式相结合,启动信号转导通路,在人体天然免疫及获得性免疫中起重要作用。TLR4分布广泛,在中枢神经系统多种细胞中均有表达,如小胶质细胞、星形胶质细胞和少突胶质细胞等[12]。小胶质细胞是中枢神经系统TLR4炎性反应的主要细胞类型,较易被激活诱导。TLR4主要表达在小胶质细胞。在MS患者中枢神经系统病变周围除有T淋巴细胞、单核细胞和巨噬细胞浸润外,还有大量活化的小胶质细胞和星形胶质细胞,这提示TLR4参与介导了神经元损伤[13]。Olson等[14]报道,TLR4在实验性自身免疫性脑脊髓炎(experimental autoimmune encephalomyelitis, EAE)模型小鼠的中枢神经系统表达水平在整个疾病过程中始终呈持续升高状态。而抑制TLR4信号转导途径[15]对EAE发生具有一定抑制作用[16]。本研究结果显示,MS组患者血清样本中TLR4含量明显高于对照组,具有统计学意义,提示TLR4在人类MS疾病进程中与EAE动物模型中发挥相似的作用,促进MS发病。
MMPs是一类能特异性降解细胞外基质的蛋白水解酶家族,与炎症、感染及自身免疫疾病密切相关。MMP-2作为该家族最主要成员之一,在炎症细胞和肿瘤细胞的迁移和浸润中被广泛研究[7]。MMP-2在CNS疾病血脑屏障的破坏中发挥重要的作用[17]。研究[18]表明,在EAE大鼠模型中,MMP-2在疾病早期即出现表达上调,当MMP-2分泌过量时可以降解血管的基底膜,引起血脑屏障开放,促进炎性细胞向CNS浸润最终导致轴突损伤。向EAE大鼠大脑内注射MMP-2可以导致细胞外基质的破坏和血脑屏障的开放,加速EAE的发病[19]。而在EAE模型中应用具有抑制MMPs活性的二甲胺四环素(minocycline)可以减轻动物的发病程度[17]。本研究结果显示,在MS患者血清样本中MMP-2的含量显著高于正常对照组,这与之前的报道结果一致。说明对MMP-2进行干预可能在MS的诊断和治疗中具有一定的应用价值。
综上,S100A8/A9、TLR4和MMP-2在自身免疫性疾病的发生发展中发挥着广泛的作用。三者既可能是独立作用于机体引起疾病,也可能是通过某种内在联系共同作用于机体导致发病。从相关性分析结果来看,三者在MS患者血清中的表达水平存在明显的相关性,因此,我们推测S100A8/A9、TLR4和MMP-2在MS疾病的发展中很可能是相互作用、相互关联的。三者在MS病程中的可能作用机制为:(1)活化的炎症细胞释放S100A8/A9异二聚体至细胞外,与TLR4结合后经过MyD88依赖通路或MyD88非依赖通路激活NF-κB和p38 MAPK信号通道促进炎症因子的合成与释放,并放大炎症因子反应,诱导MS发病。(2)S100A8/A9通过结合TLR4促进MMP-2的表达,介导血脑屏障的破坏,促进炎性细胞和炎症介质向CNS浸润,加速MS发病。(3)S100A8/A9直接激活或通过TLR4介导的NF-κB通路激活MMP-2,直接介导轴索损伤。
[1] CHERNOV A V, DOLKAS J, HOANG K, et al.The calcium-binding proteins S100A8 and S100A9 initiate the early inflammatory program in injured peripheral nerves[J].J Biol Chem, 2015,290(18):11771-11784.
[2] GOYETTE J, GECZY C L.Inflammation-associated S100 proteins: new mechanisms that regulate function[J].Amino Acids, 2011,41(4):821-842.
[3] SALAMA I, MALONE P S, MIHAIMEED F, et al.A review of the S100 proteins in cancer[J].Eur J Surg Oncol, 2008,34(4):357-364.
[4] LOSER K, VOGL T, VOSKORT M, et al.The Toll-like receptor 4 ligands Mrp8 and Mrp14 are crucial in the development of autoreactive CD8+T cells[J].Nat Med, 2010,16(6):713-717.
[5] VAN LENT P L, GREVERS L C, BLOM A B, et al.Stimulation of chondrocyte-mediated cartilage destruction by S100A8 in experimental murine arthritis[J].Arthritis Rheum, 2008,58(12):3776-3787.
[6] POUDEL B, LEE Y M, KIM D K.DDR2 inhibition reduces migration and invasion of murine metastatic melanoma cells by suppressing MMP2/9 expression through ERK/NF-κB pathway[J].Acta Biochim Biophys Sin (Shanghai), 2015,47(4):292-298.
[7] 徐春燕, 黄杰安, 覃蒙斌, 等.NIBP在结肠癌细胞中通过调控NF-κB信号通路促进MMP2、MMP9表达[J].实用医学杂志, 2015,31(11):1752-1755.
[8] POLMAN C H, REINGOLD S C, BANWELL B, et al.Diagnostic criteria for multiple sclerosis: 2010 revisions to the McDonald criteria[J].Ann Neurol, 2011,69(2):292-302.
[9] NACKEN W, ROTH J, SORG C, et al.S100A9/S100A8: Myeloid representatives of the S100 protein family as prominent players in innate immunity[J].Microsc Res Tech, 2003,60(6):569-580.
[10] FOELL D, FROSCH M, SORG C, et al.Phagocyte-specific calcium-binding S100 proteins as clinical laboratory markers of inflammation[J].Clin Chim Acta, 2004,344(1-2):37-51.
[11] VAN BON L, COSSU M, LOOF A, et al.Proteomic analysis of plasma identifies the Toll-like receptor agonists S100A8/A9as a novel possible marker for systemic sclerosis phenotype[J].Ann Rheum Dis, 2014,73(8):1585-1589.
[12] BEUTLER B A.TLRs and innate immunity[J].Blood, 2009,113(7):1399-1407.
[13] OKUN E, GRIFFIOEN K J, LATHIA J D, et al.Toll-like receptors in neurodegeneration[J].Brain Res Rev, 2009,59(2):278-292.
[14] OLSON J K, MILLER S D.Microglia initiate central nervous system innate and adaptive immune responses through multiple TLRs[J].J Immunol, 2004,173(6):3916-3924.
[15] ANDERSSON A, COVACU R, SUNNEMARK D, et al.Pivotal advance: HMGB1 expression in active lesions of human and experimental multiple sclerosis[J].J Leukoc Biol, 2008,84(5):1248-1255.
[16] MARTA M, ANDERSSON A, ISAKSSON M, et al.Unexpected regulatory roles of TLR4 and TLR9 in experimental autoimmune encephalomyelitis[J].Eur J Immunol, 2008,38(2):565-575.
[17] BRUNDULA V, REWCASTLE N B, METZ L M, et al.Targeting leukocyte MMPs and transmigration: minocycline as a potential therapy for multiple sclerosis[J].Brain, 2002,125(Pt 6):1297-1308.
[18] 刘瑞春, 董 梅, 郭 力, 等.实验性变态反应性脑脊髓炎发病初期血脑屏障的变化及基质金属蛋白酶的作用研究[J].脑与神经疾病杂志, 2005,13(2):86-88.
[19] ROSENBERG G A, DENCOFF J E, MCGUIRE P G, et al.Injury-induced 92-kilodalton gelatinase and urokinase expression in rat brain[J].Lab Invest, 1994 ,71(3):417-422.
[本文编辑] 廖晓瑜, 贾泽军
Changes of serum S100A8/A9, TLR4, and MMP-2 levels in multiple sclerosis patients
LIU Da-jin, WU Ming-feng, YU Hao, ZHANG Zhen-zhong, MA Li, YAO Rui-qin*
Research Center of Neurobiology, Xuzhou Medical University, Xuzhou 221004, Jiangsu, China
Objective:To investigate the clinical significance of S100A8/A9, Toll-like receptor 4 (TLR4) and matrix metalloproteinase (MMP-2) levels in peripheral venous serum of patients with multiple sclerosis (MS).Methods:Totally 16 cases of MS patients were selected as MS group, and 16 cases of healthy people as control group.The serum samples were detected by protein chip detection method to quantificationally analyze the changes of serum S100A8/A9, TLR4 and MMP-2 levels.Results:The serum of S100A8/A9, TLR4 and MMP-2 levels in MS group were significantly higher than which in control group (P<0.01); The three indicators in MS patients showed significant correlations (P<0.05).Conclusions:The expression of S100A8/A9, TLR4 and MMP-2 in the serum of patients with clinical MS is up-regulated, suggesting that they might be involved in the pathogenesis of MS.Combined detection of serum S100A8/A9, TLR4 and MMP-2 levels may provide a new way of thinking for the diagnosis, treatment and judgment of state in clinical MS.
multiple sclerosis; S100A8/A9; TLR4; MMP-2
2016-08-21[接受日期]2016-09-05
国家自然科学基金(81271345),江苏省自然科学基金(BK20131132),江苏省2014年度高校“青蓝工程”中青年学术带头人资助项目,江苏省高校自然科学研究面上项目(15KJB180018,15KJB310023).Supported by National Natural Science Foundation of China (81271345), Natural Science Foundation of Jiangsu Province (BK20131132), and 2014 "Qing Lan Project" Young Academic Leaders Foundation Project in Colleges and Universities of Jiangsu Province, Surface Project of University Natural Science Research of Jiangsu Province(15KJB180018,15KJB310023).
刘大进,硕士生.E-mail: LDJ_XZMU@163.com
*通信作者(Corresponding author).Tel: 0516-83262301, E-mail: wenxi_yao@163.com
10.12025/j.issn.1008-6358.2016.20160830
R 744.5+1
A

