小麦转录因子TabHLH041基因的克隆与表达分析
郭 创,王 翔,曹 云,王静轩,李 璐,姜玉梅,尹 钧
(河南农业大学/国家小麦工程技术研究中心,河南 郑州450002)
小麦转录因子TabHLH041基因的克隆与表达分析
郭 创,王 翔,曹 云,王静轩,李 璐,姜玉梅,尹 钧*
(河南农业大学/国家小麦工程技术研究中心,河南 郑州450002)
利用RT-PCR方法从小麦品种辽春10号中克隆得到1个bHLH转录因子基因TabHLH041,并对其表达特性进行分析,以期为研究bHLH转录因子在小麦发育中的功能奠定基础。结果表明,TabHLH041cDNA开放阅读框(ORF)长1 179 bp,编码392个氨基酸,TabHLH041蛋白在C端含有1个bHLH结构域;该基因包括4个外显子和3个内含子。系统发育分析发现,TabHLH041蛋白与大麦bHLH蛋白亲缘关系最近。实时荧光定量PCR分析表明, 总体上该基因的表达具有昼夜节律性,在光照条件下表达量呈下降趋势,在黑暗条件下表达量呈上升趋势。在低温条件下,TabHLH041基因的表达呈现前期被诱导、后期被抑制的特征,处理24 h时低温的抑制作用最明显;在高盐、外源ABA和干旱处理条件下,TabHLH041基因的表达持续受到抑制。综上,TabHLH041基因可能参与光周期及逆境胁迫的信号转导途径。
小麦;TabHLH041; 克隆; 表达; 非生物胁迫; 光周期
在自然生长环境中,植物经常要面临各种胁迫,包括生物胁迫和非生物胁迫(干旱、高盐、高温、低温等)。在面临外界环境变化时,植物体内基因的表达会发生变化,以适应环境变化。转录因子对基因转录具有激活或抑制作用,是植物中最重要的一类调节因子[1]。bHLH转录因子广泛分布于真核生物中,在生物体内以大家族形式存在,bHLH是植物的第二大类转录因子家族,在植物许多生物学过程中发挥关键调节作用,主要包括抗逆境胁迫、光信号传导、茎分支发生、花和果实发育、小孢子发生、叶片表皮绒毛发生、气孔分化和根系生长等[2-4]。近年来,已鉴定出多种bHLH 转录因子,主要集中在拟南芥和水稻中。其中,大多数bHLH转录因子与盐[5-6]、干旱[7-8]、冷[9]、营养缺乏[10]等逆境胁迫响应有关;也有一些bHLH转录因子,其表达具有昼夜节律性,且对与植物节律钟和光周期相关的开花具有重要的调控作用[11-12]。Shigeru等[11]研究发现,在拟南芥中许多MYB、bHLH、bZIP转录因子的表达具有昼夜节律性,其中转录因子MYB3R2、bHLH69和bHLH92虽然不是生物钟的组成成分,但它们可以影响LHY(LATEELONGATEDHYPOCOTYL)、CCA1(CIRCADIANCLOCKASSOCIATED1)等节律相关基因的表达。后来研究发现,bHLH转录因子家族的光敏相互作用因子(phytochrome-interacting factors,PIFs)可以通过与光敏素基因相互作用来调控植物开花;其中,PIF4和PIF5的表达具有节律性,它们可能通过与节律钟基因的相互作用来调控植物的开花时间[12]。进一步研究发现,拟南芥中的bHLH转录因子FLOWERING BHLH 1(FBH1)、FBH2、FBH3、FBH4能结合到光周期效应因子CO(CONSTANS)启动子的E-box上,正向调控CO的表达,分别过表达上述4个FBHs基因均能显著提高CO基因的表达水平,进而促使植株提早开花[13];另外,FBH1基因还能与CCA1基因的启动子结合进而调节CCA1基因的表达[14]。在拟南芥中,在短日照条件下,bHLH型转录因子NFL (NO FLOWERING IN SHORT DAY)对于植株开花是必需的,该基因通过GA信号途径发挥作用[15]。在小麦中,有关bHLH转录因子的报道相对很少,已报道的有TaBHLH1、TaBHLH13等逆境胁迫响应基因[16-17]。其中,TabHLH1基因对低磷、低氮、干旱和高盐等逆境明显应答,其在低磷等非生物胁迫的信号转导中可能发挥着重要作用[16];TabHLH13是一个盐胁迫诱导表达基因[17]。为了研究小麦中bHLH转录因子的作用,在前期小麦光周期表达谱分析(尚未发表)的基础上,筛选出一个长日照条件下表达下调的bHLH转录因子基因TabHLH041,并对其序列进行生物信息学分析,同时研究TabHLH041在不同光周期处理下的昼夜节律性表达及在高盐、干旱、低温胁迫以及外源ABA处理条件下的表达特性,为进一步探索TabHLH041的生物学功能奠定基础。
1 材料和方法
1.1 材料及处理
供试材料为普通小麦品种辽春10号和宁春36号。
分别选取籽粒饱满的辽春10号和宁春36号的种子,经表面灭菌后置于25 ℃条件下浸泡12~24 h,种子萌动后播种于装有营养土的盆中。辽春10号放置于16 h光照/8 h黑暗条件下培养。宁春36号分别放置于每天6 h光照(SD)和18 h光照(LD)2种光周期条件下培养。光照培养箱温度设定为21 ℃恒温,每天常规水肥管理,保证植株正常生长。3周后剪取宁春36号的叶片用于基因的昼夜节律性表达分析。取样时间从照光开始设为0,每隔3 h取一次,连续取48 h。同时,剪取辽春10号的叶片用于基因克隆。材料用液氮冷冻后保存于-80 ℃冰箱备用。
选取宁春36号发芽一致的种子置于灭菌培养皿中,于16 h光照/8 h黑暗、21 ℃的培养箱中培养。培养液为1/2 MS培养液,每隔2 d更换一次,21 d后进行以下处理。(1)对照(CK):不进行任何胁迫处理;(2)胁迫处理:取一部分幼苗分别放进含有100 μmol/L ABA、100 mmol/L NaCl、20% PEG6000的1/2MS培养液中进行ABA、盐、干旱处理,另取一部分幼苗置于4 ℃的光照培养箱中进行低温胁迫处理。分别剪取各个处理0.5、6、12、24 h 的叶片,液氮速冻后置于-80 ℃冰箱中备用。
1.2 DNA 和RNA的提取及cDNA第一链的合成
小麦叶片DNA的提取采用CTAB法,总RNA 的提取参照Invitrogen 公司的Trizol Reagent试剂说明书进行。用琼脂糖凝胶电泳检测总RNA 的提取质量,采用核酸蛋白分析仪测定RNA 浓度和纯度。总RNA 经DNaseⅠ(Promega 公司)处理后,参照Invitrogen公司的SuperScriptTMⅢ Reverse Transcriptase反转录试剂盒反转录合成第一链cDNA。
1.3 小麦TabHLH041基因DNA、cDNA序列的克隆及其编码蛋白的结构、系统发育分析
在前期研究所得的小麦光周期表达谱(尚未发表)中进行筛选获得TabHLH041基因的EST序列,利用NCBI的ORF Finder分析其ORF,利用Primer Premier 5.0设计2 条特异性引物用于该基因全长片段的扩增。其中,上游引物F1:5′-CTTGCTGAGGGATGGATGAT-3′,下游引物R1:5′-CCAATCTAAGGTATGGGAATGAG-3′。PCR反应体系参照TaKaRa公司的PremixTaqTM(LATaqTMVersion 2.0)说明书配制,体系为20 μL:2×PremixTaqTM(LATaqTMVersion 2.0) 2.0 μL,上、下游引物各1 μL,模板1 μL,用灭菌蒸馏水补齐至20 μL。以cDNA为模板时,PCR 反应程序为:95 ℃预变性5 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸2 min,35个循环;72 ℃最后延伸10 min。以DNA为模板时,PCR反应条件为:95 ℃预变性5 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸3 min,35个循环;72 ℃最后延伸10 min。用1%琼脂糖凝胶对PCR产物进行电泳检测,回收目的条带,然后与pMD19-T进行连接,转化大肠杆菌DH5α,PCR扩增鉴定后将阳性克隆菌液送至北京华大六合基因有限公司进行测序。
采用DNASTAR 软件比对TabHLH041基因的cDNA 和基因组DNA序列,以确定内含子和外显子;采用NCBI的Conserved Domains (http://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi) 进行保守结构域分析;采用PredictProtein (http://www.predictprotein.org/)进行蛋白质二级结构的预测;采用NCBI Blast(http://blast.ncbi.nlm.nih.gov/Blast.cgi)进行蛋白质序列同源性比对;采用DNAMAN 软件进行蛋白质序列比对;采用MEGA 6.0软件构建系统发育进化树。
1.4 实时荧光定量PCR(qRT-PCR)分析
采用Primer Premier 5.0设计目的基因qRT-PCR引物F2(5′-GTGATGGTGAAGAGCAGCCT -3′)和R2(5′-GTCCTTCTTTGAGCAGGGGG -3′)。根据小麦看家基因β-actin(登录号:AB181991)cDNA序列,采用Primer Premier 5.0设计其特异引物 F3(5′-GTTCCAATCTATGAGGGATACACGC-3′)和R3(5′-GAACCTCCACTGAGAACAACATTACC-3′)。 qRT-PCR反应体系参照TaKaRa公司的 SYBR Premix ExTaqTMⅡ(Tli RNaseH Plus)试剂盒说明书,20 μL体系含SYBR Premix ExTaqTMⅡ(2×) 10.0 μL,cDNA模板2.0 μL,10 μmol/L 的上、下游引物各1.0 μL,ddH2O 6.0 μL。每个样品设置3个重复。反应条件参照TaKaRa公司的 SYBR Premix ExTaqTMⅡ(Tli RNaseH Plus)试剂盒
说明书:95 ℃预变性 30 s;95 ℃变性 5 s,60 ℃退火 30 s,72 ℃ 延伸30 s,40个循环。在60 ℃反应步骤时收集荧光信号。反应在BIO-RAD CFX Connect Real-Time System上进行。采用2-ΔΔCt方法计算目的基因的相对表达量。
2 结果与分析
2.1 小麦TabHLH041基因的克隆及其编码蛋白序列分析
利用NCBI的ORF Finder分析TabHLH041的ORF,利用Primer Premier 5.0在该基因ORF的5′和3′非编码区设计2 条引物用于cDNA和DNA片段的扩增。以辽春10号叶片cDNA和DNA为模板,利用特异性引物对F1和R1进行扩增,结果得到与预期片段大小一致的产物(图1)。测序表明,TabHLH041基因DNA长3 135 bp,包含4个外显子和3个内含子(图2);cDNA片段全长1 531 bp,其中ORF为1 179 bp,5′非编码区包含 11 bp,3′非编码区包含341 bp,该ORF编码392个氨基酸。预测编码的TabHLH041蛋白分子质量为42.90 ku,等电点为5.670。保守结构域分析显示(图3),TabHLH041蛋白仅在多肽链C端有1个bHLH结构域,该结构域含有典型的E-box/N-box识别位点、二聚体界面和DNA结合碱性区域。对TabHLH041蛋白进行分析发现,TabHLH041蛋白无跨膜螺旋和双硫键,定位于细胞核中; TabHLH041有2个蛋白结合位点,分别位于第1、2位氨基酸。

图1 小麦TabHLH041基因的PCR扩增结果
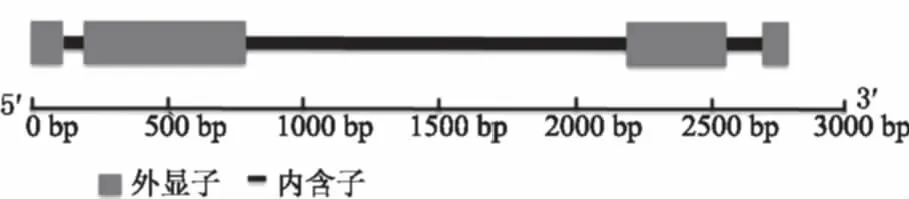
图2 TabHLH041的DNA结构分析

图3 TabHLH041蛋白的保守结构域分析
2.2TabHLH041编码氨基酸序列比对及系统发育分析
将TabHLH041编码的氨基酸序列与来自大麦(BAJ99887.1)、二穗短柄草(XP_010231939.1)、水稻(BAB90265.1)、高粱(XP_002455828.1)、玉米(XP_008656612.1)、谷子(XP_004969032.1)、拟南芥(NP_200506.1)等含有bHLH结构域蛋白的氨基酸序列进行比对分析(图4)发现, TabHLH041氨基酸序列长度与其他物种bHLH蛋白氨基酸序列长度相近,所有参比序列均含有1个bHLH结构域,该结构域在序列上非常保守,其中有28个氨基酸在不同bHLH蛋白中是完全相同的,占bHLH结构域氨基酸总数的57%。TabHLH04蛋白序列与大麦、二穗短柄草、水稻、高粱、玉米、谷子、拟南芥的bHLH蛋白序列同源性分别达92%、57%、53%、51%、46%、50%、21%。

下划线部分为bHLH结构域; 黑色阴影表示相同氨基酸,灰色阴影表示差异氨基酸;大麦:BAJ99887.1, 二穗短柄草:XP_010231939.1,水稻:BAB90265.1,谷子:XP_004969032.1,玉米:XP_008656612.1, 高粱:XP_002455828.1,拟南芥:NP_200506.1
对小麦TabHLH041蛋白与其他物种bHLH蛋白进行系统发育分析(图5),根据亲缘关系所有参比bHLH蛋白可以分为3类,分别是小麦、大麦、二穗短柄草、水稻、谷子、玉米等亲缘关系较近的单子叶植物bHLH蛋白,油棕、海枣、小果野芭蕉等单子叶植物bHLH蛋白及拟南芥、芝麻等双子叶植物bHLH蛋白。其中,TabHLH041蛋白与大麦bHLH蛋白亲缘关系最近,其次为二穗短柄草、水稻。

大麦:BAJ99887.1; 二穗短柄草:XP_010231939.1; 水稻:BAB90265.1; 谷子:XP_004969032.1; 玉米:ACG29202.1、 XP_008656612.1; 小果野蕉:XP_009407301.1; 油棕:XP_010925429.1; 海枣:XP_008797775.1; 拟南芥:NP_200506.1; 芝麻: XP_011094007.1
2.3 小麦TabHLH041的表达特性分析
2.3.1 昼夜节律性TabHLH041基因是在光周期表达谱中筛选出来的,推测该基因可能参与光周期调控,为此本研究分析了TabHLH041基因的昼夜节律性表达。从图6可以看出,无论是在长日照还是短日照条件下,TabHLH041基因表达总体上都有昼夜的节律性。在LD处理条件下,在0~6 h光照期间TabHLH041基因的表达量持续下降,之后其表达量持续上升直到12 h,随后在12~18 h光照期间该基因表达量先下降后趋于平稳,最后在黑暗中(18~24 h)其表达量持续上升;在第2个循环中,TabHLH041基因的表达量在光照期间(24~42 h)总体呈下降趋势,而在黑暗中(42~48 h)总体呈迅速上升趋势。在SD处理条件下,TabHLH041基因的表达量在0~6 h光照期间迅速下降后趋于平稳,随后在黑暗中(6~24 h)呈上升—下降—上升趋势;在第2个循环中,TabHLH041基因的表达量在光照期间(24~30 h)急剧下降,而在黑暗中(30~48 h)总体呈升高趋势。这暗示着该基因很有可能在光周期信号转导途径中发挥作用。

图6 TabHLH041基因的昼夜节律性表达情况
2.3.2 胁迫诱导性 对TabHLH041基因在不同胁迫处理条件下的表达特性进行分析(图7)发现,在ABA处理条件下,TabHLH041基因在整个胁迫处理过程中均受ABA抑制,在 ABA 处理0.5、6、12、24 h 时,该基因的表达量仅为CK的48%、59%、48%、53%。
在20%PEG6000干旱处理条件下,TabHLH041基因的表达持续受到抑制。在 20%PEG6000处理0.5、6、12、24 h时,该基因的表达量仅为CK的37%、53%、60%、79%。说明随着处理时间延长,干旱对该基因表达的抑制程度降低。
在100 mmol/L NaCl处理条件下,TabHLH041基因的表达持续受到抑制,与CK相比,在处理0.5 h时其表达量降低了1倍,在24 h时抑制效果最明显,其表达量仅为CK的30%。
在4 ℃低温处理条件下,处理前期低温诱导TabHLH041基因表达;从处理12 h开始,低温抑制该基因表达,在处理24 h时抑制程度最高。

图7 TabHLH041基因在不同胁迫条件下的表达情况
3 结论与讨论
本研究从小麦品种辽春10号中克隆到TabHLH041基因。多序列比对和进化分析结果显示,TabHLH041蛋白序列相当保守,与近缘物种大麦同源性最高,达92%。蛋白质结构域分析显示,TabHLH041蛋白含有典型的bHLH结构域,该bHLH结构域具有E-box/N-box识别位点,含有形成同源或异源二聚体的二聚体界面,也含有与DNA片段结合的碱性区域,说明它可能具有调控其他基因转录的功能。基因组结构分析表明,TabHLH041基因含有4个外显子和3个内含子,说明该基因在转录后存在剪接加工过程。
利用qRT-PCR分析TabHLH041在小麦不同光周期条件及不同逆境条件下的表达模式,结果显示,TabHLH041在长日照和短日照条件下的表达总体上都具有昼夜节律性。在光照下其表达量总体保持下降趋势,在黑暗中其表达量总体呈现上升趋势,这与前期工作获得的光周期表达谱结果一致。前人研究表明,与光周期途径相关的多个关键基因CO、LHY、CCA1等的表达均呈现昼夜节律性[18-19]。目前已克隆出FBHs、PIFs等多个与光周期相关的bHLH基因[12-13]。故推测该基因可能在光周期信号转导途径中发挥作用。
TabHLH041对多种逆境胁迫(高盐、干旱、ABA、低温)均有不同程度的响应。其中,在高盐、干旱及ABA胁迫下该基因的表达模式基本相同,均受抑制;而在低温胁迫后其表达量呈现前期被诱导、后期被抑制的表达模式。这个结果暗示,TabHLH041也可能参与了逆境胁迫的信号通路。下一步将构建TabHLH041基因植物表达载体,并对该基因在光周期及逆境胁迫中的功能做进一步分析。
[1] Guilfoyle T J.The structure of plant gene promoters[M]//Setlow J K.Genetic engineering.New York:Plenum Press,1997:15-47.
[2] Morohashi K,Zhao M,Yang M,etal.Participation of theArabidopsisbHLH factor GL3 in trichpme initiation regulatory events[J].Plant Physiol,2007,145(3):736-746.
[3] Kanaoka M M,Pillitteri L J,Fujii H,etal.SCREAM/ICE1 andSEREAM2 specify three cell-state transitional steps leading toArabidopsisstomatal differentiation[J].Plant Cell,2008,20(7):1775-1785.
[4] Menand B,Yi K,Jouannic S,etal.An ancient mechanism controls the development of cells with a rooting function in land plants[J].Science,2007,316:1477-1480.
[5] Jiang Y Q,Deyholos M K.Comprehensive transcriptional profilting of NaCl-stressed Arabidopsis roots reveals novel classes of responsive genes[J].BMC Plant Biology,2006,6(1):1-20.
[6] Jiang Y Q,Yang B,Deyholos M K.Functional characte-rization of theArabidopsisbHLH92 transcription factor in abiotic stress[J].Molecular Genetics and Genomics,2009,282(5):503-516.
[7] Kiribuchi K,Sugimori M,Takeda M,etal.RERJ1,a jasmonic acid responsive gene from rice,encodes a basic helix-loop-helix protein[J].Biochemical and Biophysical Research Communications,2004,325(3):857-863.
[8] Kiribuchi K,Jikumaru Y,Kaku H,etal.Involvement of the basic helix-loop-helix transcription factor RERJ1 in wounding and drought stress responses in rice plants[J].Bioscience Biotechonlogy and Biochemistry,2005,69(5):1042-1044.
[9] Wang Y J,Zhang Z G,He X J,etal.A rice transcription factor OsbHLH1 is involved in cold stress response[J].Theoretical and Applied Genetics,2003,107(8):1402-1409.
[10] Ogo Y,Nakanishi I R,Nakanishi H,etal.The rice bHLH protein OsIRO2 is an essential regulator of the genes involved in Fe uptake under Fe-deficient conditions[J].Plant Joumal,2007,51(3):366-377.
[11] Shigeru H,Ralf S,Marc J,etal.A systematic survey inArabidopsisthalianaof transcription factors that modulate circadian parameters[J].BMC Genomics,2008,9:1-13.
[12] Niwa Y,Yamashino T,Mizuno T.The circadian clock regulates the photoperiodic response of hypocotyl elongation through a coincidence mechanism inArabidopsisthaliana[J].Plant Cell Physiol,2009,50(4):838-854.
[13] Ito S,Young H S,Josephson-Day A R J,etal.FLOWERING BHLH transcriptional activators control expression of the photoperiodic flowering regulatorCONSTANSinArabidopsis[J].PNAS,2012,109(9):3582-3587.
[14] Dawn H N,Jose L P,Steve A K.FBH1 affects warm temperature responses in theArabidopsiscircadian clock[J].PNAS,2014,111(40):14595-14600.
[15] Nidhi S,Xin R J,Dong-Hwan K,etal.NO FLOWERING IN SHORT DAY(NFL) is a bHLH transcription factor that promotes flowering specifically under short-day conditions inArabidopsis[J].Development,2016,143(4):682-690.
[16] 张珉,文彦丽,赵小磊,等.小麦bHLH型转录因子TaHLH1的分子特征和表达特性研究[J].河北农业大学学报,2013,36(1):1-5.
[17] 符思路,刘国祥,张立超,等.小麦盐胁迫相关基因TabHLH13的克隆与分析[J].植物遗传资源学报,2014,15 (5):1006-1011.
[18] Suárez-López P,Wheatley K,Robson F,etal.CONSTANSmediates between the circadian clock and the control of flowering inArabidopsis[J]. Nature, 2001, 410(6832):1116-1120.
[19] Mizoguchi T,Wheatley K,Hanzawa Y,etal.LHYandCCA1 are partially redundant genes required to maintain circadian rhythms inArabidopsis[J].Dev Cell,2002,2:629-641.
Cloning and Expression Analysis of Transcriptional Factor Gene TabHLH 041 from Wheat
GUO Chuang,WANG Xiang,CAO Yun,WANG Jingxuan,LI Lu,JIANG Yumei,YIN Jun*
(Henan Agricultural University/National Engineering Research Centre for Wheat,Zhengzhou 450002,China)
In order to lay a foundation for the study of the function of bHLH transcription factors in the development of wheat,a bHLH transcription factorTabHLH041 gene was cloned by RT-PCR method from wheat variety Liaochun No.10,and its expression pattern was analyzed.The results showed that the open reading frame ofTabHLH041 was 1 179 bp in length that encoded 392 amino acids.The TabHLH041 protein contained a bHLH domain in its C terminal.The analysis of the sequence ofTabHLH041 from genome DNA showed thatTabHLH041 gene contained four exons and three introns.Phylogenetic analysis showed that the sequence of TabHLH041 was closest toHordeumvulgarebHLH protein.Real time PCR analysis revealed that the expression ofTabHLH041 displayed the day-night rhythm,and its expression level decreased in the light while increased in the dark.The expression ofTabHLH041 was induced in the early time,and then was inhibited under the treatment of low temperature,the inhibition was very significant when treated for 24 h.The expression ofTabHLH041 was inhibited continuously under the treatment of high salt,ABA and PEG.In summary,the results suggest thatTabHLH041 may be involved in the signal transduction pathway of photoperiod and adversity stress.
wheat (Triticumaestivum);TabHLH041; cloning; expression; abiotic stress; photoperiod
2016-03-14
国家科技支撑计划项目(2011BAD16B07,2013BAD04B01)
郭 创(1990-),男,湖南娄底人,在读硕士研究生,研究方向:小麦栽培与生物技术。 E-mail:1368614151@qq.com
*通讯作者:尹 钧(1957-),男,山西万荣人,教授,博士,主要从事小麦栽培与生物技术研究。E-mail:xmzxyj@126.com
S512.1;Q943.2
A
1004-3268(2016)07-0007-07

