食管癌Eca109细胞的HPV16-E6基因转染条件优化
康馨丹,陈卫刚,阮开学,张宁,郑勇
(石河子大学医学院第一附属医院,新疆石河子832000)
食管癌Eca109细胞的HPV16-E6基因转染条件优化
康馨丹,陈卫刚,阮开学,张宁,郑勇
(石河子大学医学院第一附属医院,新疆石河子832000)
目的 确定HPV16-E6基因转染食管癌Eca109细胞的最佳转染条件。方法 取体外培养的食管癌Eca109细胞,用中心复合试验设计分组,转染条件控制因素包括DNA用量、Lip2000/DNA和饥饿时间,DNA用量分0.65、1.00、1.50、2.00、2.35 μg共5档,Lip2000/DNA分0.65、1.00、1.50、2.00、2.35 μL/μg共5档,饥饿时间分0、3、7.5、12、15 h共5档,共设20个组。转染24 h后,倒置显微镜下观察各组荧光情况并拍照,用图像处理软件计算细胞转染效率;用CCK-8法测算各组细胞相对存活率。用响应曲面法绘制有交互影响的因素对细胞转染效率和相对存活率影响的响应曲面,以目的基因细胞数(转染效率×细胞存活率)最大化为原则,确定最佳转染条件。在最佳转染条件下用HPV16-E6基因转染食管癌Eca109细胞,检测细胞转染效率和相对存活率。结果 随着饥饿时间延长,细胞转染效率和细胞相对存活率呈下降趋势。依据饥饿0 h的转染效率、细胞存活率响应曲面图,得出最佳转染条件为(24孔培养板):DNA用量1.35 μg、Lip2000/DNA1.12 μL/μg(换算成Lip2000用量为1.51 μL)、细胞饥饿时间0 h;转染效率预测值可达38.68 %,细胞相对存活率预测值为85.09%。在最佳转染条件下用相同方法转染,实际转染效率为39.79 %,与预测值的相对误差为2.87%。结论 HPV16-E6基因转染Eca109细胞的最佳转染条件(24孔板)为:每孔DNA用量1.35 μg,脂质体Lip2000用量1.51 μL,不对细胞进行饥饿处理。
食管癌;人乳头瘤病毒16;基因转染效率;细胞相对存活率;实验设计
人乳头状瘤病毒(HPV)是一种具有高度特异性的嗜上皮性病毒,与宫颈癌的发病密切相关,HPV16黏膜高危亚型与食管癌发病的关系尤其密切[1,2],但其相关程度以及HPV对食管癌细胞的作用机制并没有明确的定论[3,4]。研究HPV16对食管癌细胞的影响首先要通过基因转染技术将HPV16核酸片段转染入食管癌细胞中。阳离子脂质体转染法是常用转染方法,但是转染目标DNA和所用阳离子脂质体LipofectamineTM2000(Lip2000)本身有一定的细胞毒性,过量应用可能导致转染效率和细胞存活率降低。转染前是否应该行饥饿处理目前也有争议。本研究通过阳离子脂质体转染法,将搭载致癌基因HPV16-E6的重组质粒,转染入Eca109食管癌Eca109细胞中,并通过中心复合正交试验设计分析转染条件(DNA用量、Lip2000/DNA、饥饿时间)对转染效率和细胞相对存活率的影响,构建转染效率如细胞相对存活率的响应曲面,确定HPV16-E6基因转染食管癌Eca109细胞的最佳转染条件。现报告如下。
1 材料与方法
1.1 材料 Eca109型食管癌细胞株由石河子大学地方高发病重点实验室提供。绿色荧光蛋白标记的搭载 HPV16-E6基因片段的pcDNA3.1(+)质粒由上海生工生物工程公司构建。阳离子脂质体Lip2000购自Invitrogen公司。Opti-MEM培养液、DMEM高糖培养基购自Gibco公司。胎牛血清、胰蛋白酶购自HyClone公司。质粒提取纯化试剂盒购自天根生化科技公司。CCK-8试剂盒购自东仁化学科技公司。Loading buffer上样缓冲液、PBS细胞缓冲液、24孔与96孔培养板。荧光倒置显微镜为Olympus公司产品。CO2培养箱、超净台、核酸浓度分析仪、低温高速离心机为Thermo Fisher公司产品。酶标仪、电泳仪、紫外凝胶成像仪为Bio-Rad公司产品。
1.2 食管癌Eca109细胞分组及 HPV16-E6基因细胞转染方法
Eca109细胞贴壁培养于含10%胎牛血清的DMEM培养基中,并加入适量的青-链霉素混合液,置于37 ℃、5 %CO2培养箱中,隔天换液1次,细胞融合度80 %左右传代。当细胞处于对数生长期时,使用胰蛋白酶将细胞消化,接种于24孔培养板中,每孔接种细胞数量为1×105个,培养条件保持不变,细胞融合度达到70 %左右进行转染。设1~20组,各组DNA用量、Lip2000/DNA和饥饿时间见表1。各组先用无血清的DMEM培养基对Eca109细胞进行饥饿处理,达到规定的饥饿时间后进行转染。各组抽取相应量的的质粒DNA稀释于50 μL的Opti-MEM培养基中,抽取相应的脂质体Lip2000,同样稀释于50 μL的Opti-MEM培养基中,室温孵育5 min后将二者混合均匀,并静置25 min得到DNA-Lip2000复合物。将上述复合物均匀滴入各培养孔,然后把培养板放入37 ℃、5 %CO2培养箱中,5 h后更换为含10 %胎牛血清的DMEM培养基终止细胞转染。
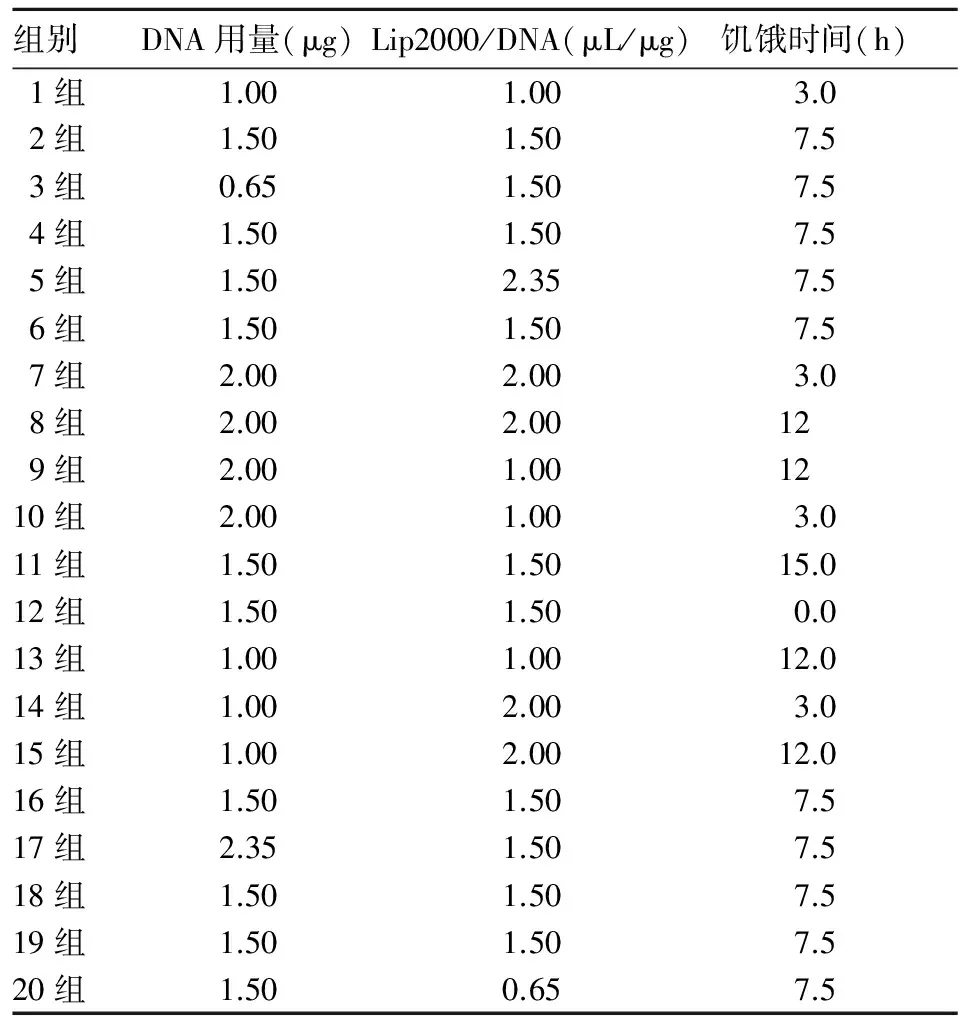
表1 各组转染条件
1.3 各组转染效果评价 包括细胞转染效率和细胞相对存活率两方面。
1.3.1 各组基因转染效率测算 细胞转染24 h后,将细胞培养板置于荧光倒置显微镜下放大100倍,每组随机选取10个视野,分别在可见光和荧光滤镜下拍照。使用图像处理软件Image J进行细胞计数和荧光计数,通过荧光数/细胞数折算出每个视野下的细胞转染效率,求加权平均数后,最终得出各组的转染效率。
1.3.2 各组细胞相对存活率测算 采用CCK-8法,另设空白对照组(只加培养液,无细胞),转染24 h后,向各试验组中加入10 μL的CCK-8溶液,在培养箱中孵育1 h左右,使用酶标仪测定450 nm波长的光密度(OD)值。各组细胞相对存活率=(各组OD值/空白对照组OD值)×100%。
1.5 最佳转染条件的转染效果验证 在最佳转染条件下用1.2中的方法转染,用1.3中的方法检测细胞转染效率和相对存活率。
2 结果
2.1 各组细胞转染效率和相对存活率 各组细胞转染效率和相对存活率见表2。

表2 各组基因转染效率和细胞相对存活率
2.2 最佳转染条件的优化结果 多元非线性回归分析结果显示DNA用量、Lip2000/DNA、饥饿时间均对细胞转染效率有显著影响,因素显著性的主次顺序为:饥饿时间>Lip2000/DNA>DNA用量;且DNA用量与Lip2000/DNA对转染效率的影响存在显著交互作用,而其他因素之间则无显著交互作用。DNA用量、Lip2000/DNA和饥饿时间均对细胞相对存活率有显著影响,显著性的主次顺序为:饥饿时间>Lip2000/DNA>DNA用量;三者对细胞相对存活率的影响无交互作用。
DNA用量对转染效率的影响具有两面性。随着DNA用量增加,转染效率先逐渐增大,在DNA用量为1.35 μg左右达到最大值,此后随着DNA的增加逐渐减小。DNA用量与细胞相对存活率呈非线性负相关,随着DNA用量增加,细胞存活率呈加速下降趋势,当DNA用量达到2.35 μg时,细胞存活率仅为40 %左右。
Lip2000/DNA比值对转染效率的影响同样具有两面性。当Lip2000/DNA从0.65 μL/μg增大至1.2 μL/μg时,转染效率由25%提升至30%;当Lip2000/DNA从1.2 μL/μg增大至2.35 μL/μg时,转染效率开始急剧下降,下降幅度达到20%。当Lip2000/DNA在0.65~1.2 μL/μg的区间内,细胞细胞相对存活率保持相对稳定;当Lip2000/DNA从1.2 μL/μg增大至2.35 μL/μg时,细胞相对存活率呈加速下降趋势。
随着饥饿时间延长,细胞转染效率和细胞相对存活率呈下降趋势。
饥饿时间与DNA用量、Lip2000/DNA之间不存在显著交互作用,并且对转染效率和细胞存活率的影响均为单调抑制作用,因此在细胞转染时不进行饥饿处理更为适宜。饥饿0 h的细胞转染效率响应曲面见图1。最高转染效率位于响应曲面的中间区域。当DNA用量在1.2 ~1.8 μg区间内、Lip2000/DNA在0.9~1.5区间内,转染效率可保持在35%以上。饥饿0 h的细胞存活率响应曲面件图2。DNA和Lip2000用量与细胞存活率的影响呈负相关,当DNA用量与Lip2000/DNA均处于低水平时,细胞存活率可达最大值。DNA用量在0.65 ~1.6 μg区间内、Lip2000/DNA在0.65~1.4区间内,细胞存活率可保持在70%以上。
以目的基因细胞数(转染效率×细胞存活率)最大化为原则,通过响应曲面法得出最佳转染条件为(24孔培养板):DNA用量1.35 μg、Lip2000/DNA为1.12 μL/μg(Lip2000用量1.51 μL)、细胞饥饿时间0 h;转染效率预测值可达38.68%,细胞相对存活率预测值为85.09%。
2.3 最佳转染条件的转染效果 在最佳转染条件下用相同方法转染食管癌Eca109细胞,实际转染效率为39.79%,与响应曲面预测值的相对误差仅为2.87%。
3 讨论
阳离子脂质体转染法是目前常用的基因转染技术之一[6],在使用脂质体Lip2000将目的基因转染入细胞的过程中,转染效率会受到诸多因素的影响,因此对转染条件的优化必不可少。转染过程中DNA和脂质体均有导致细胞凋亡的作用。为了尽可能多的获取携带HPV16-E6基因的食管癌细胞,在提高转染效率的同时,还需考虑细胞转染之后的存活率。
本研究结果显示,DNA用量、Lip2000/DNA和饥饿时间这三个因素对细胞转染效率和细胞相对存活率都有影响,并且DNA用量与Lip2000/DNA对转染效率的影响存在显著的交互作用。增大DNA用量可形成更多的核酸-脂质体复合物,有利于提高转染效率,但是细胞本身对DNA的吸收存在饱和度,且过多的DNA会导致核酸-脂质体复合物的氮磷比失衡[7],细胞毒作用增强,因此过量的DNA会降低转染效率。适量的提高Lip2000用量可与DNA结合更加充分,形成的核酸-脂质体复合物具有更稳定的空间结构,能有效提高转染效率[8]。但是,当Lip2000/DNA值较大时,过量的Lip2000分子以游离状态存在,将细胞膜表面的负电荷中和,从而削弱细胞膜对核酸-脂质体复合物的吸附能力,造成转染效率降低;另一方面,Lip2000本身对细胞也具有毒性,这是其造成细胞相对存活率下降的主要原因[9]。转染前对食管癌细胞进行饥饿处理的目的在于,使细胞处于静息状态而达到细胞周期的同步化,同时消除血清对转染效率的影响[10]。有文献[11]提出,处于饥饿状态的细胞可以更好的吸收转染试剂,在一定程度上可以提高转染效率。而本研究结果表明,饥饿处理会降低细胞转染效率,过度饥饿会使细胞状态变差,内吞和膜融合活动减弱,并且造成细胞损伤,不能有效的抵抗DNA和脂质体的毒性作用。另外,饥饿处理时间过长,细胞没有足够的营养维持生长,会逐渐裂解、死亡,细胞相对存活率下降。
根据响应曲面对转染条件优化得出:在24孔培养板上行HPV16-E6基因转染Eca109细胞,每孔DNA用量1.35 μg,脂质体Lip2000用量1.51 μL,且不对细胞进行饥饿处理时,理论上转染效率可达到最大值,实际转染效率为39.79%,完全可满足后续实验需求。
[1] Mammas IN, Sourvinos G, Zaravinos A, et al. Vaccination against human papilloma virus: epidemiological evidence of HPV in nongenital cancer[J]. Pathol Oncol Res, 2011,17(2):103-109.
[2] Gong H, Song L, Lin C, et al. Downregulation of microRNA-138 sustains NF-kβ activation and promotes lipid raft formation in esophageal squamous cell carcinoma[J]. Clin Cancer Res, 2013,19(5):1083-1093.
[3] 林克荣,陈国荣,王维维,等.食道乳头状瘤与人乳头状瘤病毒感染的相关性研究[J].中华医院感染学杂志,2014,3(24):599-601.
[4] 朱红霞,周晓波,刘梅,等.HPV16-E7蛋白对TNF-α诱导食管癌细胞凋亡及其机制的探讨[J].中华肿瘤防治杂志,2013,1(20):5-9.
[5] 陈彦祥,乔卫红,刘栋良,等.阳离子脂质体的转染机制及转染效率影响因素[J].生物工程学报,2007,5(23):776-780.
[6] Christian M, Cermak T, Doyle EL, et al. Targeting DNA double-strand breaks with TAL effector nucleases[J]. Genetics, 2010,186(2):757-761.
[7] 严爱芬,刘婉霞,刘芳,等.TALEN质粒转染HEK-293T细胞的条件优化[J].基因组学与应用生物学,2015,12(34):2554-2559.
[8] Elsabahy M, Nazarali A, Foldvari M, et al. Non-viral nucleic acid delivery: key challenges and future directions[J]. C'urr drug deliv, 2011,8(3):235-244.
[9] Wu Y, Gao TL, Wang XL, et al. TALE nickase mediates high efficient targeted transgene in tegration at the human multi-copy ribosomal DNA locus[J]. Biochem Biophys Res Commun, 2014,446(1): 261-266.
[10] 周艳芳,陈晓爱,叶美红,等.正交设计优化聚乙烯亚胺介导肝癌细胞基因转染效率的研究[J].生物医学工程学杂志,2011,1(28):104-109.
[11] Koynova K, Tenchov B. Cationic lipids: molecular structure transfection activity relationships and interactions with biomem branes[J]. Top Curr Chem, 2010,296(11):51-93.
Optimal transfection conditions for HPV16-E6 gene in esophageal cancer Eca109 cells
KANGXindan,CHENWeigang,RUANKaixue,ZHANGNing,ZHENGYong
(TheFirstAffiliatedHospitalofShiheziUniversityMedicalCollege,Shihezi832000,China)
Objective To find the optimal transfection conditions for transfecting HPV16-E6 plasmid to esophageal cancer Eca109 cells. Methods The in vitro cultured Eca109 cells were selected. We used central composite experiment to design the groups. The control factors of transfection conditions included DNA dosage (0.65, 1.00, 1.50, 2.00, and 2.35 μg), Lip2000/DNA (0.65, 1.00, 1.50, 2.00, and 2.35 μL/μg) and starvation time (0, 3, 7.5, 12, and 15 h) and according to the above, we established 20 groups. After 24 h, the expression of green fluorescent was observed by inverted microscope and then was photographed. The transfection efficiency was evaluated by image processing software, and the cell proliferation by CCK-8. Response surface methodology was used to draw the response surface on effects of interaction factors on cell transfection efficiency and relative survival rate.The optimal transfection conditions were determined based on the principle of maximizing the number of target cells (transfection efficiency×cell survival rate). The transfection efficiency and relative survival rate of esophageal carcinoma Eca109 cells were detected by HPV16-E6 gene transfection under optimal transfection conditions.Results On the basis of cell transfection efficiency without starvation, the response surface showed that the highest transfection efficiency area was located in the middle of the response surface. Without starvation, the response surface of cell survival rate showed that the DNA and Lipo 2000 was negatively correlated with the survival rate. The optimal transfection conditions (24-well plate) determined based on the principle of maximizing the number of target cells (transfection efficiency×cell survival rate): the plasmid amount was 1.35 μg, Lipo2000/DNA ratio was 1.12∶1 μg/μL (converted to Lip2000 dosage of 1.51 μL) and the starvation time was 0 h. The predicted value of transfection efficiency reached 38.68% and the cell survival rate was 85.09%. Under the optimal transfection conditions, the actual transfection efficiency was the highest (39.79%), with the relative error of 2.87% as compared with the predicted value. Conclusion The optimal transfection conditions for transfecting HPV16-E6 plasmid to Eca109 cells for 24-well plate are asfollows: 1.35 μg DNA per well, 1.51 μL Lip2000 liposome, and the cells are not starved.
esophageal cancer; human papillomavinus 16; gene transfection efficiency; cell relative survival rate; experimental design
国家自然科学基金资助项目(81260362)。
康馨丹(1991-),女,硕士研究生,主要研究方向为消化道肿瘤。E-mail: 75321631@qq.com
简介:郑勇(1956-),男,医学博士,主任医师,主要研究方向为消化系统疾病。E-mail: zy2850@126.com
10.3969/j.issn.1002-266X.2016.47.004
R735.1
A
1002-266X(2016)47-0013-04
2016-08-21)

