免疫组化检测BMP-6在乳腺癌临床标本中的表达差异
张运峰
(唐山师范学院 生命科学系,河北 唐山 063000)
生物科学与技术研究
免疫组化检测BMP-6在乳腺癌临床标本中的表达差异
张运峰
(唐山师范学院 生命科学系,河北 唐山 063000)
通过免疫组化染色方法检测了BMP-6在乳腺癌,癌旁乳腺组织和正常淋巴结组织的表达。免疫组化结果显示,BMP-6在13例癌旁乳腺组织(纤维脂肪组织)中表达均呈现阴性;在9例正常淋巴结组织中表达均呈现阳性;但在34例乳腺癌(非特殊性浸润性导管癌)中的阴性表达率26.5%;在9例乳腺癌(淋巴结转移性非特殊性浸润性导管癌)阴性表达率33.3%;在35例癌旁乳腺组织(上皮细胞)中阴性表达率14.3%。结果表明BMP-6在乳腺癌、癌旁乳腺组织和正常淋巴结组织的表达存在明显差异,BMP-6在乳腺癌中表达的缺失是诱发乳腺癌发生重要原因。
BMP-6;免疫组化染色;乳腺癌
骨形态发生蛋白-6(BMP-6)属于转化生长因子β(TGF-β)超家族[1-2],BMP-6信号传导主要是通过激活Smad信号通路实现的[3],除了Smad依赖性信号通路外,BMP-6还可以激活例如MAPK信号通路等其他信号通路[4]。BMP-6最初鉴定为软骨和骨形成的诱导因子[5-6],但是,后来发现BMP-6在胚胎发育以及出生后组织重建过程中也可以调节多种类型细胞生长、分化、趋化和凋亡。乳腺癌是最常见的女性恶性肿瘤之一[7],乳腺癌细胞的异常增殖和随后发生的转移过程是一个多基因调控、需要多个步骤才能实现的复杂过程,它包括细胞的异常生长、信号调控网络的改变、组织特异性基因表达紊乱以及许多其他参与生物过程因素的改变[8-9]。我们先前的研究发现BMP-6可以调控乳腺癌细胞的增殖和转移,但是BMP-6在乳腺癌临床标本中的表达及其与乳腺癌发生的关系还不是很清楚。因此,我们用免疫组织化学染色的方法检测了BMP-6在乳腺癌以及癌旁组织中表达情况。深入研究BMP-6在乳腺癌临床病理标本中的表达,将有助于我们了解BMP-6在乳腺癌发生病理过程中的作用,从而为BMP-6应用于乳腺癌前期诊断提供新思路。
1 材料
组织组合芯片(BR1002a):组化芯片试验在陕西超英生物科技有限公司进行。所有标本都有详细的年龄、性别、组织、病理诊断、临床分级、TNM分级、临床阶段、标本类型和结果信息。
主要试剂:BMP-6抗体(ab13472)购买于美国Abcam公司。
2 方法
免疫组织化学染色及分析:60℃烤片30 min,常规脱蜡水化。抗原修复:以0.01 M柠檬酸缓冲液(pH 6.0)高压2 min修复抗原,冷却至室温,磷酸盐缓冲液(PBS)洗5 min×3次;用3% H2O2-甲醇封闭内源性过氧抗原,冷却至室温,磷酸盐缓冲液(PBS)洗5 min×3次;用3% H2O2-甲醇封闭内源性过氧化物酶,室温10 min,PBS洗5 min×3次。滴加一抗:BMP6(1:50),4℃冰箱过夜;用0.1% Tween-20 PBS洗5 min×3次;滴加聚合物增强剂,室温孵育20 min;用0.1% Tween-20 PBS洗5 min×3次;滴加酶标抗鼠/兔聚合物,室温孵育30 min;DAB显色5 min,蒸馏水洗终止显色;苏木素复染、水洗、分化后充分水洗返蓝;常规脱水透明,中性树胶封片。阴性对照操作方法同上,一抗改为同种的IgG。
3 结果
3.1 BMP-6在乳腺癌临床标本中的表达
试验用免疫组织化学染色的方法检测了BMP-6在乳腺癌导管癌、淋巴结转移癌以及匹配或不匹配正常癌旁组织中表达,结果如图1和图2所示。BMP-6在98例临床标本中的表达存在明显差异,BMP-6在13例癌旁乳腺组织(纤维脂肪组织)中呈阴性表达;在9例正常淋巴结组织中均呈阳性表达;BMP-6在34例乳腺癌(非特殊性浸润性导管癌)中的阴性表达率是26.5%;在9例乳腺癌(淋巴结转移性非特殊性浸润性导管癌)阴性表达率分别是33.3%;在35例癌旁乳腺组织(上皮细胞)中阴性表达率是14.3%。

图1 不同乳腺癌组织及癌旁乳腺组织中BMP-6的表达情况分析(n代表病例数)
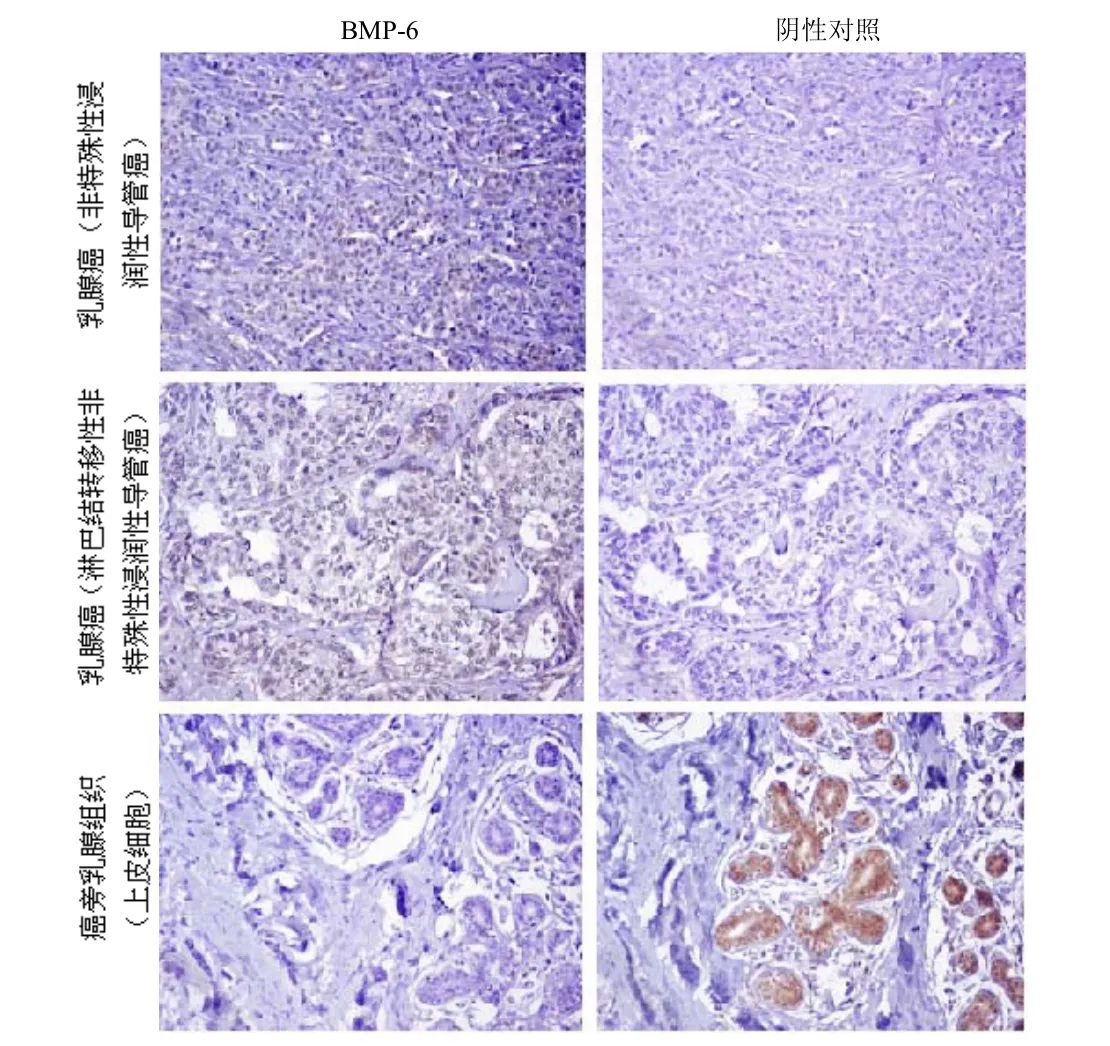
图2 不同乳腺癌发病组织及癌旁组织中BMP-6的免疫组化检测结果
3.2 BMP-6表达与乳腺导管癌临床分期的关系
表1为BMP-6的表达与乳腺导管癌临床分级的关系。BMP-6在13例非特殊性侵润性导管癌I级中的阳性表达率为84.6%;在13例非特殊性侵润性导管癌Ⅱ级中的阳性表达率为63.8%;在8例非特殊性侵润性导管癌Ⅲ级中的阳性表达率为87.5%。
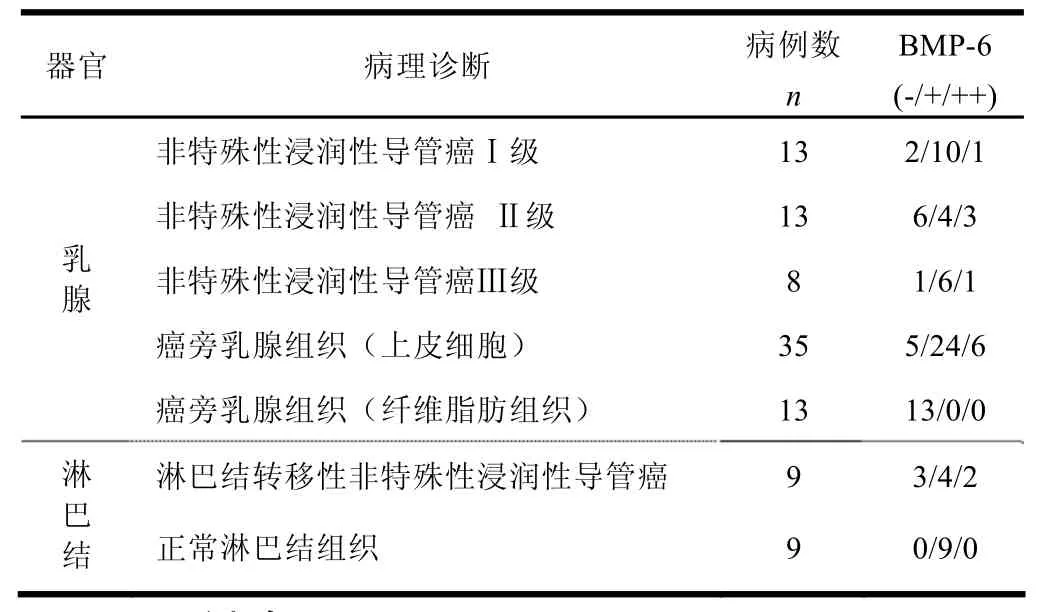
表1 BMP-6在乳腺癌临床标本及癌旁乳腺组织中的表达统计表
4 讨论
乳腺癌是女性最常见的恶性肿瘤之一,通常发生在乳腺上皮组织[7]。它严重影响妇女身心健康甚至危及生命。本研究发现BMP-6在乳腺癌旁组织(纤维脂肪组织)和乳腺癌旁组织(上皮组织)中的表达存在明显差异,BMP-6在纤维脂肪组织没有表达,但是在大多数上皮组织中均有表达,阴性表达率仅为14.3%,表明BMP-6在上皮组织中发挥着重要的功能。
目前研究表明BMP-6可以具有多种功能。BMP-6可以跟VEGF信号通路一起促进脂肪干细胞向成骨细胞的分化[10];BMP-6可促进体外腔前卵泡中的浓度和时间依赖性的成熟,并且可以在类固醇激素合成和/或分泌的调节中发挥作用[11];BMP-6减少缺血诱导的脑损伤的影响[12];此外,BMP-6还可以调节包括前列腺癌[13]、肾癌[14]、肝癌[15]、宫颈癌[16]和乳腺癌[17-18]在内的多种肿瘤进展中发挥着重要的作用。我们先前的研究发现BMP-6表现出抑制乳腺癌细胞增殖[8]、侵袭和转移的潜在作用[9]。BMP-6在MCF-7中可以通过调节HO-1抑制MMP-9的表达[9]。BMP-6还可以调节包括E- cadherin[19]、microRNA-21[20]在内的多种与乳腺癌转移相关的基因的表达。本研究表明BMP-6在癌旁组织(上皮组织)的阴性表达率明显低于非特殊性侵润性导管癌和淋巴结转移性非特殊性侵润性导管癌。临床标本的免疫组化实验结果表明BMP-6在部分乳腺癌中表达缺失,BMP-6的表达缺失可能与乳腺癌的发生和发展密切相关。
[1] Hahn G V, Cohen R B, Wozney J M, et al. A bone morphogeneticc protein subfamily: chromosomal localization of human genes for BMP5, BMP6, and BMP7[J]. Genomics, 1992, 14: 759-762.
[2] Ducy P, Karsenty G. The family of bone morphogenetic proteins[J]. Kidney Int, 2000, 57: 2207-2214.
[3] Tang S J, Hoodless P A, Lu Z, et al. The Tlx-2 homeobox gene is a downstream target of BMP signalling and is required for mouse mesoderm development[J]. Development, 1998, 125: 1877-1887.
[4] Derynck R, Zhang YE. Smad-dependent and Smad-independent pathways in TGF-beta family signalling[J]. Nature, 2003, 425: 577-584.
[5] Gitelman S E, Kobrin M S, Ye J Q, et al. Recombinant Vgr-1/ BMP-6-expressing tumors induce fibrosis and endochondral bone formation in vivo[J]. J Cell Biol, 1994, 126: 1595-1609.
[6] Gitelman S E, Kirk M, Ye J Q, et al. Vgr-1/BMP-6 induces osteoblastic differentiation of pluripotential mesenchymal cells[J]. Cell Growth Differ, 1995, 6: 827-836.
[7] Jemal A, Siegel R, Ward E, et al. Cancer statistics[J]. CA Cancer J Clin, 2009, 59: 225-249.
[8] Hu F, Meng X, Tong Q, et al. BMP-6 inhibits cell proliferation by targeting microRNA-192 in breast cancer[J]. Biochim Biophys Acta, 2011, 832: 2379-23903.
[9] Wang C, Hu F, Guo S, et al. BMP-6 inhibits MMP-9 expression by regulating heme oxygenase-1 in MCF-7 breast cancer cells[J]. J Cancer Res Clin Oncol, 2011, 137: 985-995.
[10] Li C J, Madhu V, Balian G, et al. Cross-Talk Between VEGF and BMP-6 Pathways Accelerates Osteogenic Differentiation of Human Adipose-Derived Stem Cells[J]. J Cell Physiol, 2015, 9: 10.
[11] Wang X, Su L, Pan X, et al. Effect of BMP-6 on development and maturation of mouse preantral follicles in vitro[J]. Biotechnol Biotechnol Equip, 2015, 29: 336-344.
[12] Wang Y, Chang C F, et al. Morales M, Bone morphogenetic protein-6 reduces ischemia-induced brain damage in rats[J]. Stroke, 2001, 32: 2170-2178.
[13] Lee G T, Kang D I, Ha Y S, et al. Prostate cancer bone metastases acquire resistance to androgen deprivation via WNT5A-mediated BMP-6 induction[J].Br J Cancer, 2014, 110: 1634 -1644.
[14] Lee J H, Lee G T, Woo S H, et al. BMP-6 in renal cell carcinoma promotes tumor proliferation through IL-10-dependent M2 polarization of tumor-associated macrophages[J]. Cancer Res, 2013, 73: 3604-3614.
[15] He Y, Cui Y, Xu B, et al. Hypermethylation leads to bone morphogenetic protein 6 downregulation in hepatocellular carcinoma[J]. PLoS One, 2014, 9: 87994.
[16] Liu C Y, Chao T K, Su P H, et al. Characterization of LMX-1A as a metastasis suppressor in cervical cancer[J]. J Pathol, 2009, 219: 222-231.
[17] Sangplod P, Kanngurn S, Boonpipattanapong T, et al. Expression of BMP6 is associated with its methylation status in colorectal cancer tissue but lacks prognostic significance[J]. Asian Pac J Cancer Prev, 2014, 15: 7091- 7095.
[18] Liu G, Liu Y J, Lian W J, et al. Reduced BMP6 expression by DNA methylation contributes to EMT and drug resistance in breast cancer cells[J]. Oncol Rep, 2014, 32: 581-588.
[19] Yang S, Du J, Wang Z, et al. BMP-6 promotes E-cadherin expression through repressing deltaEF1 in breast cancer cells[J]. BMC Cancer, 2007, 7: 1-13
[20] Du J, Yang S, An D, et al. BMP-6 inhibits microRNA-21 expression in breast cancer through repressing deltaEF1 and AP-1[J]. Cell Res, 2009, 19: 487-496.
(责任编辑、校对:李春香)
BMP-6 Expression in Breast Cancers and Cancer-Adjacent Tissues by Immunohistochemical Staining
ZHANG Yun-feng
(Department of Life Sciences, Tangshan Normal University, Tangshan 063000, China)
In this study, immunohistochemical staining was used to detect the BMP-6 expression in breast cancer, cancer adjacent normal breast tissue and normal lymph node tissue. The results showed that BMP-6 had a negative expression in 13 case breast tissue (fibrofatty tissue) and had a positive expression in 9 case normal lymph node tissue. BMP-6 had a 26.5% negative expression rate in 34 case breast cancer (non-specific invasive ductal carcinoma), had a 33.3% negative expression rate in 9 case breast cancer (lymph node metastatic non special invasive ductal carcinoma), and had a 14.3% negative expression rate in 35 case cancer adjacent normal breast tissue (epithelial cells). BMP-6 expression is different in breast cancer and cancer adjacent normal breast tissue, and BMP-6 expression is missing in some breast cancer tissue by immunehistochemical staining.
BMP-6; immunohistochemical staining; breast cancer
Q279
A
1009-9115(2016)02-0055-03
10.3969/j.issn.1009-9115.2016.02.016
国家自然科学基金项目(81302323),河北省自然科学基金项目(C2014209140),河北省高等学校科学技术研究项目(BJ2014027)
2016-02-11
张运峰(1982-),男,河北石家庄人,硕士,实验师,研究方向为生物化学与分子生物学。

