氯丙那林在牛血和牛尿两种易获表征样本中的消除规律研究
朱聪英,周炜,陆春波,陈慧华,应永飞,张航俊,侯轩,周志强
(浙江省畜产品质量安全检测中心,杭州 311199)
氯丙那林在牛血和牛尿两种易获表征样本中的消除规律研究
朱聪英,周炜*,陆春波,陈慧华,应永飞,张航俊,侯轩,周志强
(浙江省畜产品质量安全检测中心,杭州 311199)
利用液相色谱-串联质谱法对肉牛血清和尿液两种易获表征样本中氯丙那林消除规律进行了研究。选取4只雌性健康育肥期肉牛(500±25)kg,其中1只作为对照,3只作为试验组,每日将氯丙那林按1 mg/kg·bw 经基础日粮拌饲试验组肉牛一次,连续饲喂30 d后停止给药,继续饲喂基础日粮45 d。牛血清样品中于首饲后第2小时,即出现100 ng/mL左右氯丙那林,随后血药浓度逐步上升,并于持续给药20 d达到峰值。在停止给药后第3天,牛血清样品中氯丙那林残留量已低于方法检测限。牛尿样本中于首饲当天,即检出358~1456 ng/mL氯丙那林,连续给药期牛尿中氯丙那林残留量个体差异较大,在停止给药后21 d时,牛尿中仍有低浓度氯丙那林检出,在休药后45 d,牛尿中未检出氯丙那林。血清及尿液样本可较为准确地反映养殖过程氯丙那林非法使用情况,尿液样本的监测对活体肉牛无害化处理过程具有指导意义。
氯丙那林;牛血;牛尿;表征样本;消除
氯丙那林(Clorprenaline,CLO),是一种选择性β2-受体激动剂,有明显的支气管扩张作用,因而被应用于临床治疗支气管炎、喘息性支气管炎等。尽管氯丙那林对β2-受体的选择性和作用强度弱于沙丁胺醇,但是适当剂量的氯丙那林能促进动物生长并提高瘦肉率[1],因而,近年来,作为一种新的“瘦肉精”替代品,被发现非法添加于饲料、动物饮水[2]以及兽药制剂中[3]。氯丙那林也可用作运动员的“兴奋剂”,但医学实验已证明其残留会严重影响人类健康,人如果长期食用含有β-受体激动剂残留的猪肉,会增加致癌和致畸风险。与此同时,由于同为β-受体激动剂的克伦特罗会引起人体急性中毒,甚至死亡,因而中国、欧盟和国际奥委会(the International Olympic Committee,IOC)等国家和国际组织明令禁止现役运动员赛前使用β-受体激动剂[1],也不得将其用于食品动物[4]。现采用农业部1025号公告-18-2008[5]、农业部1063号公告-3-2008[6]和农业部1063号公告-6-2008[7],分别对动物源性食品中、动物尿液中和动物饲料中的氯丙那林浓度进行测定。
然而,迄今为止,国内外尚无关于氯丙那林在动物体内吸收与排泄速度的报道,在监测靶组织的选取、无害化处理活体家畜方案的制订等方面均无可靠数据支撑。本研究旨在通过肉牛饲喂试验,并监测牛血清和牛尿两种动物养殖环节易获表征样本中氯丙那林的浓度,以摸索氯丙那林在牛体内的消除规律,以期为农业、公安等行政执法部门提供科学依据与基础数据。
1 材料与方法
1.1 实验动物与样品采集
1.1.1 实验动物与试验方案 为便于尿样采集,选取4只体重约500±25 kg雌性健康育肥期肉牛,分圈饲养,其中1只作为对照(标记为0号牛),另3只作为试验组(标记为1~3号牛),预饲一周。试验肉牛每日8:00饲喂精料(杭州市正平生物科技有限公司提供)各1.75 kg/只,精料组成:玉米、豆粕、棉籽粕、菜籽粕、麦麸、鱼粉、饲料级磷酸氢钙、石粉、食盐及各类维生素、微量元素。营养成份(%):粗蛋白≥18.0,粗纤维≤9.5,粗灰分≤10.0,钙0.7~1.8,总磷≥0.40。肉牛自由采食青贮牧草(营养成分(%):粗蛋白≥17.25,粗脂肪≥3.35,粗纤维≤12.8,钙1.34,磷0.66,赖氨酸0.89,含硫氨基酸0.67),保证充足饮水。
试验开始后,于每日8:00补饲时,将氯丙那林按1 mg/kg·bw 经基础日粮拌饲试验组肉牛一次,连续饲喂30 d,第31天停止给药,继续饲喂基础日粮45 d(备注:饲喂第30天,宰杀3号牛,以作它用)。
1.1.2 样品的采集与处理 血液样品分单剂量给药24 h、连续单剂量给药期、休药期三阶段,采集牛尾静脉血液,血液经离心分离制备血清,-20 ℃冷冻保存。单剂量给药24 h样品共收集首次给药开始前(记为0 h)和首次给药后2、4、6、8、10、12、24 h(即第2 天样品)共八个时间点。连续单剂量给药样品分别于饲喂第3、5、7、10、15、20和25 天饲喂开始前血液。休药期样品分别于休药后第3、7、14、21、45 天饲喂基础日粮开始前血液。
考虑到牛尿次数与总量大小等因素,尿液样本分给药期、休药期二阶段采样,采集到的尿液样品,记录采集时间点,并立即-20 ℃冷冻保存。给药期分别采集给药第1、2、3、5、10、15、20和25天的一份牛尿样。休药期分别采集休药后第3、7、14、21和45天的一份牛尿样品。
1.2 仪器与材料 Agilent 1290N 高效液相色谱仪(美国Agilent公司);AB 5500 Q-Trap质谱仪(美国AB公司),配电喷雾离子源(ESI);电子天平(瑞士Mettler,精度十万分之一);SLS固相萃取小柱(400 mg/6 mL,杭州福裕科技服务有限公司);离心机(德国Sigma公司);氮吹仪(美国Organomation Associates, JNC)。氯丙那林、D9-克伦特罗标准品,均购自Wigega Laboratorien Berlin-Adlershof GmbH公司。
氯丙那林标准工作液:精密称取氯丙那林适量对照品,用甲醇制备成为100 ng/mL的标准工作液,-20 ℃保存。内标工作液:精密称取D9-克伦特罗标准品适量,用甲醇分别制备成为100 ng/mL的内标工作液,-20 ℃保存。
试验用甲醇、盐酸、乙酸乙酯、氨水均为分析纯,甲酸及作为流动相的甲醇均为色谱纯,水为超纯水。
1.3 样品预处理方法
1.3.1 血清样品 准确移取血清样品[5,8]1.00 mL于50 mL离心管中,加入内标工作液100 μL后,再加入5.0 mL乙酸铵缓冲液(0.2 moL/L,pH=5.2)和盐酸葡萄糖醛苷酶/芳基硫酸酯酶(β-Glucuronidase/aryl sulfatase)40 μL,涡旋混匀,于37 ℃避光酶解16 h。酶解后,加入高氯酸适量使其pH值在2.0左右,涡旋混匀,12000 r/min离心10 min。将全部上清液倒入依次经3 mL甲醇和3 mL 0.01 mol/L盐酸溶液活化好的SLS固相萃取小柱中,待供试液流尽后,以3 mL水和3 mL甲醇依次淋洗小柱。用9 mL 5%氨化乙酸乙酯(临用新制,并超声使其成乳浊液)洗脱,收集全部洗脱液于10 mL具塞玻璃管中,60 ℃水浴条件下,用氮气吹干。加入1.0 mL 0.2% 甲酸水溶液后,超声1 min,充分涡旋混匀后,过0.22 μm 水系滤膜。滤液供HPLC-MS/MS检测。
1.3.2 尿液样品 准确移取尿样[8]5.00 mL于50 mL离心管中,加入内标工作液100 μL后,经高氯酸调pH至2.0左右。后续操作同血清样品处理。
1.4 检测条件
1.4.1 色谱条件 色谱柱:Waters Atlantis dC18柱(3.0 mm×150 mm,粒径3 μm);流动相见表1;柱温35 ℃;进样量5 μL;流速300 μL/min。
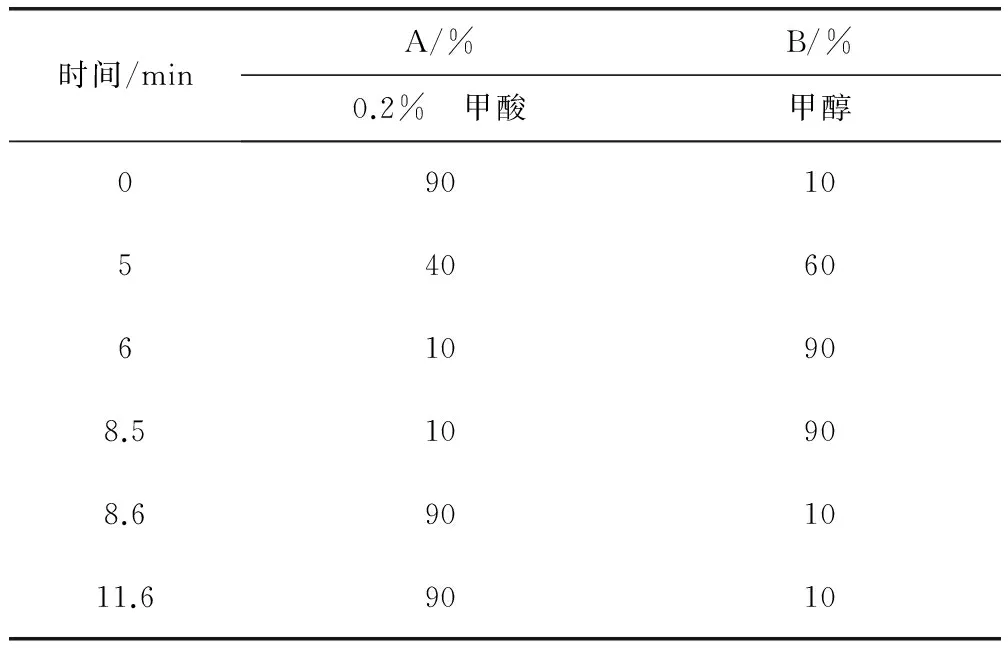
表1 流动相组成
1.4.2 质谱条件 电喷雾离子源;正离子扫描;多反应监测;离子源电压:5500 V;辅助加热气温度:500 ℃;气帘气流速(Curtain Gas):40 L/h;脱溶剂流速:中等(Medium);离子源气流速:雾化气(Gas 1)为45 L/h,辅助气(Gas 2)为25 L/h;驻留时间(dwell time):20 ms;多反应监测离子的定性、定量离子对及锥孔电压等质谱参数见表2。

表2 多反应监测离子对及质谱条件
注:*:定量离子
2 结果与分析
2.1 氯丙那林在牛血中的代谢规律
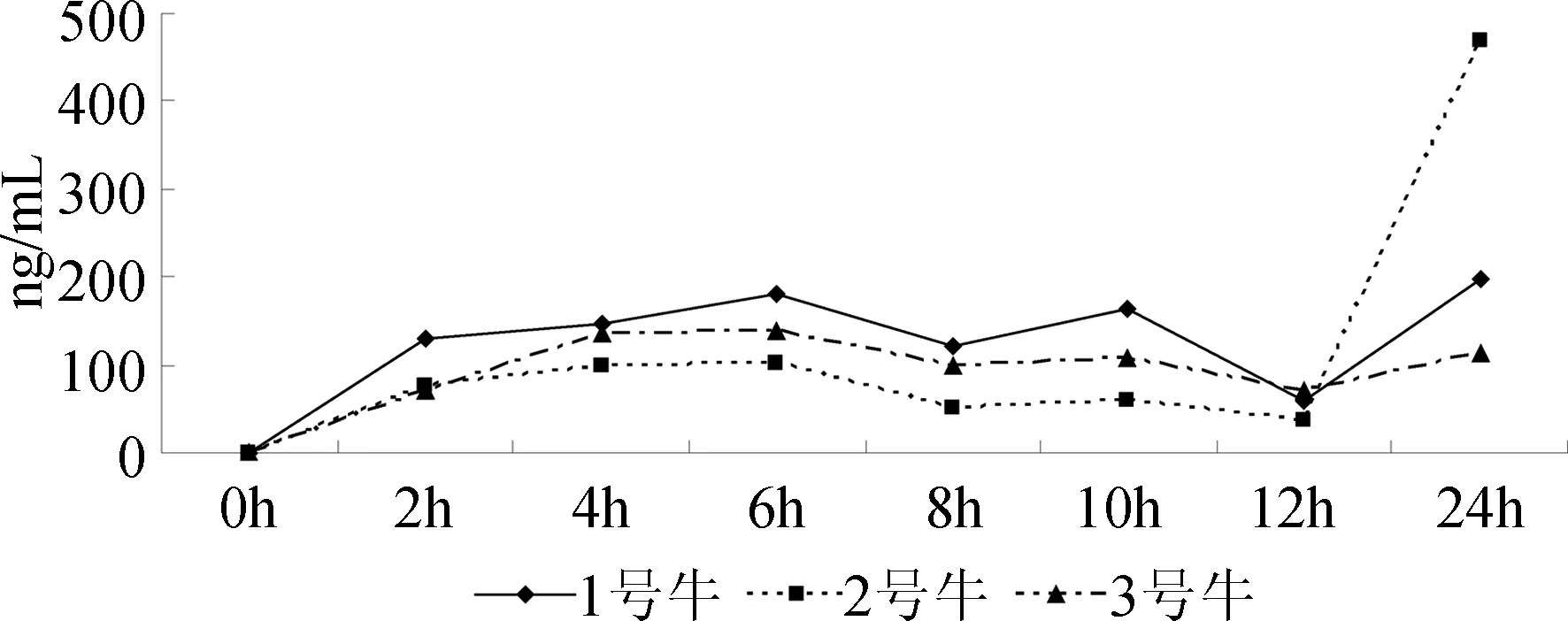
图1 单剂量给药24 h牛血清中氯丙那林的含量变化曲线
2.1.1 单剂量给药时的代谢规律 从图1中可以看出,3头试验用牛均在饲喂氯丙那林后2 h血液中即出现了氯丙那林(1号牛:129.0 ng/mL;2号牛:77.17 ng/mL;3号牛:70.58 ng/mL),并逐步升高,且均在给药后第6小时浓度达到峰值,随后略呈下降趋势。在饲喂后第10小时时,血清中氯丙那林浓度又略现升高趋势,结合3头牛在首次给药后的12 h和24 h时血清中氯丙那林浓度比:1号牛升高2.3倍,2号牛升高11.5倍,3号牛升高0.6倍,推测这可能与夜间牛群反刍有关。
2.1.2 连续单剂量给药期的代谢规律 从图2中不难看出,3头试验用牛血清中氯丙那林浓度随给药时间的延长而不断升高,随后略呈下降趋势。由于缺少后续数据支撑,20 d时牛血清中氯丙那林浓度是否即为饱和浓度,仍需后续深入研究。
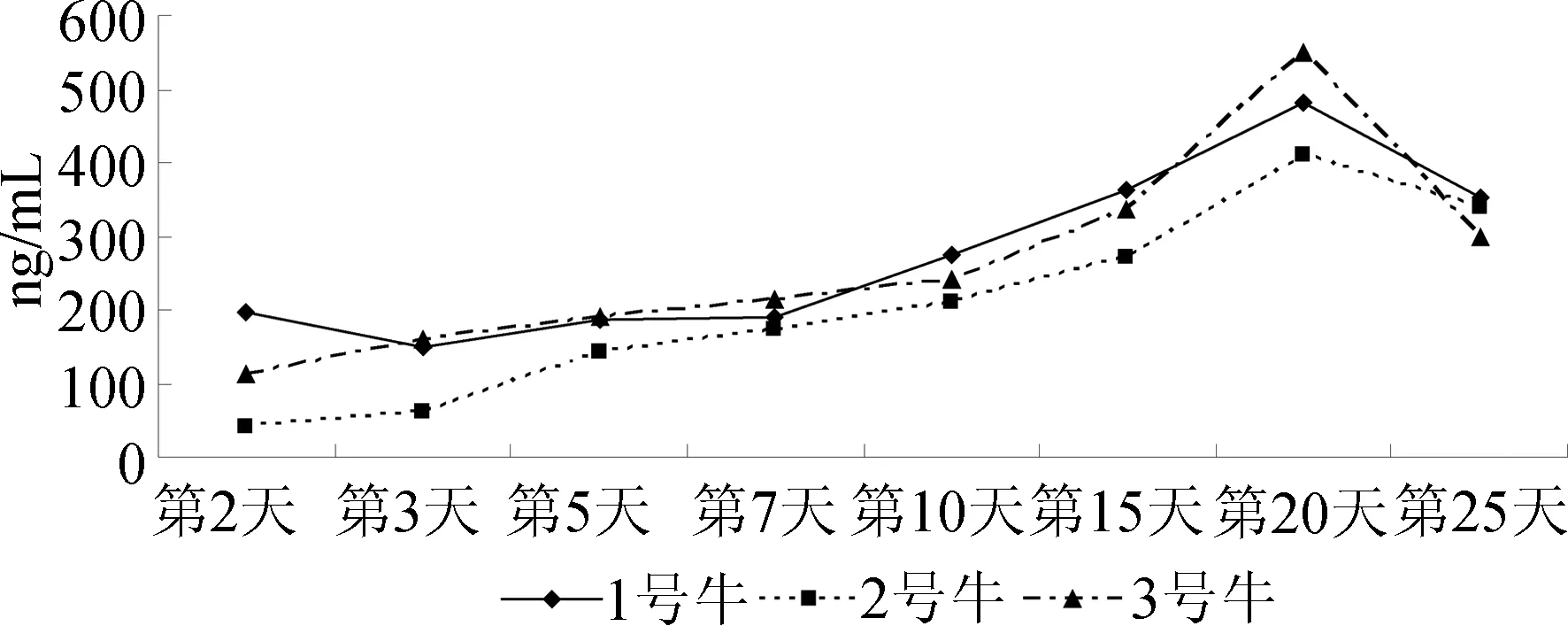
图2 连续单剂量给药牛血清中氯丙那林的含量变化曲线
2.1.3 休药期的消除规律 在停止给药后第3天开始所收集到的牛血中氯丙那林浓度已低于检测限(0.1 ng/mL),表明氯丙那林在牛血中的代谢速率很快,或全部转入组织中,或全部经尿/粪排泄,或全部转化为其他代谢产物。
2.2 氯丙那林在牛尿中的消除规律 给药期内,如图3所示,在饲喂氯丙那林当日,牛尿中即出现高浓度氯丙那林,其中1号牛达到1460 ng/mL(收集于给药后3 h),2号牛达到865.2 ng/mL(收集于给药后2 h),3牛则为358.4 ng/mL(收集于给药后3 h)。王丽娜等对克伦特罗在绒山羊尿液中的代谢规律研究显示[9],羊群在给药剂量分别为150 μg/kg·bw和300 μg/kg·bw时,单剂量给药24 h内羊尿中克伦特罗浓度分别达到289 ng/mL和1323 ng/mL。其研究结果与本试验结果相仿。受饮水量/排尿量比值、排尿时间等诸多因素影响,在连续给药期间,牛尿中氯丙那林浓度个体差异很大且未呈现出特定变化规律,这一结果亦与王丽娜等的研究结果相近[9]。
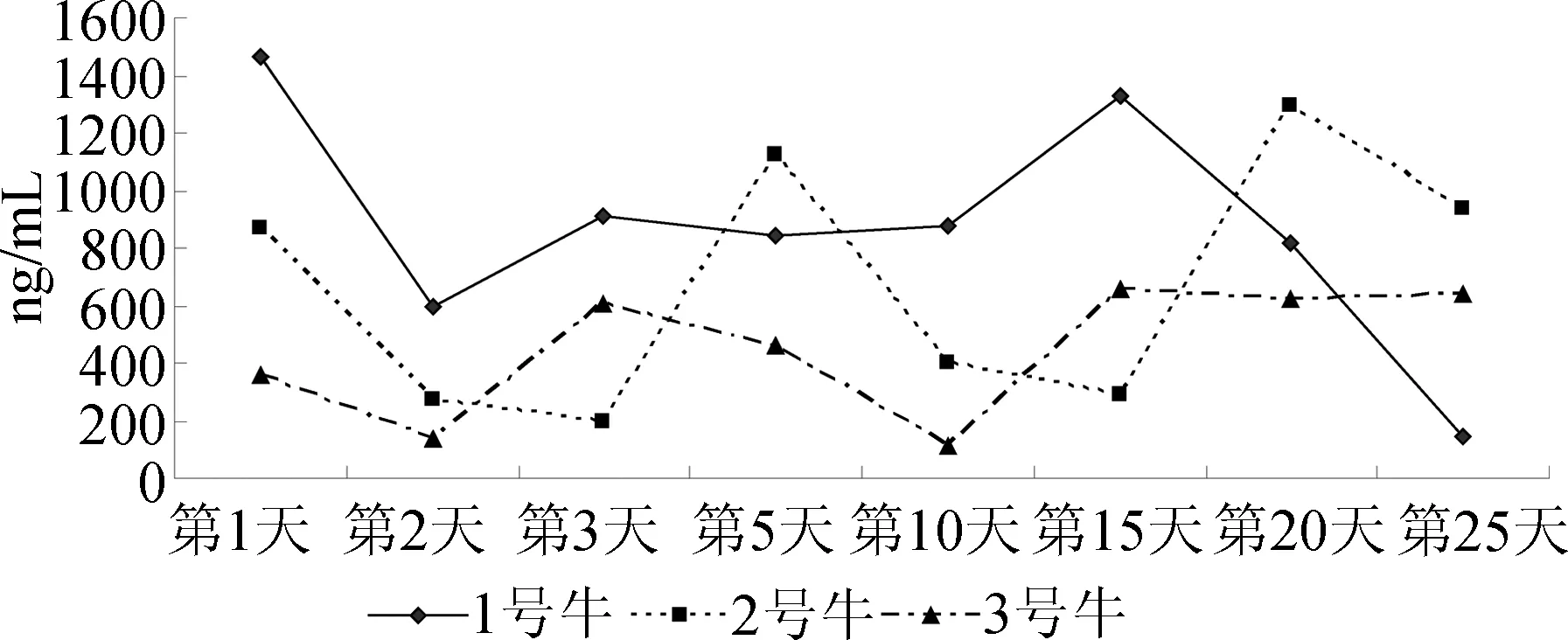
图3 连续给药期牛尿中氯丙那林的含量变化曲线
如图4所示,2头牛在休药期表现出相近的浓度变化曲线,牛尿中氯丙那林在休药第3天明显大幅下降,至在停止给药后的第21天时,1号(0.8 ng/mL)和2号牛尿(0.4 ng/mL)中仍含低浓度氯丙那林,在停止给药后的第45天时,牛尿中未检出氯丙那林。王丽娜等的研究结果显示[9],在停止给药40 d后,羊尿中仍有6~9 mg/mL克伦特罗检出,表明这两种β-受体激动剂在反刍动物体内均有较长的分解代谢过程。
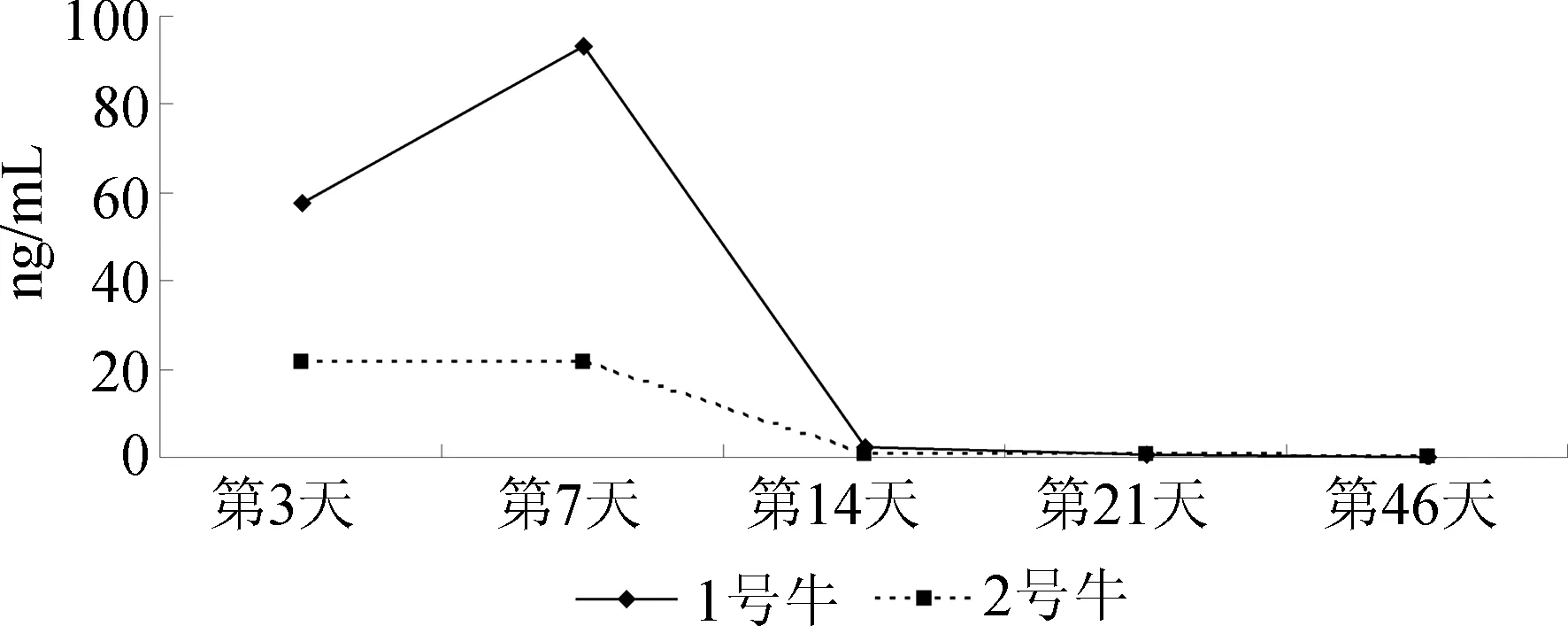
图4 停止给药后牛尿中氯丙那林的含量变化曲线
3 讨论与小结
3.1 从牛尾静脉采血而获得血清样品,可作为肉牛养殖、运输环节和屠宰前监测肉牛是否受氯丙那林污染 氯丙那林(1 mg/kg·bw 经基础日粮拌饲)给药后2 h,牛血清样品中即出现100 ng/mL左右氯丙那林,随后血药浓度逐步上升。在持续给药20 d左右,出现峰值。在停止给药后第3天,牛血清样品中氯丙那林残留量已低于方法检测限。整体而言,血清样品中氯丙那林残留量不受其他因素影响,较为准确地反映养殖过程用药情况。
0号牛,即对照组肉牛血清中氯丙那林浓度全程低于检出限。关于活体动物血清中β-受体激动剂的代谢研究鲜有报道,氯丙那林及其代谢物在牛血清中的代谢研究有待进一步深入。经过先前的方法学考察,本研究中所建立的牛血清中氯丙那林残留检测方法,简便易行、重现性和准确性能满足日常检测要求。同时,综合单剂量给药24 h、连续单剂量给药期、休药期三阶段研究结果,从牛尾静脉采血而获得血清样品,可作为肉牛养殖、运输环节和屠宰前监测肉牛是否受氯丙那林污染的易获表征样本。
3.2 牛尿可作为饲养、运输环节氯丙那林使用情况监测用样品,以及肉牛活体无化害处理过程监测的有效的易获表征样本 氯丙那林(1 mg/kg·bw 经基础日粮拌饲)给药当天,牛尿中即检出358~1456 ng/mL氯丙那林,受饮水量/排尿量比值、排尿时间等因素影响,连续给药期牛尿中氯丙那林残留量个体差异较大。在停止给药后21 d时,牛尿中仍有低浓度氯丙那林检出,在休药后45 d,牛尿中未检出氯丙那林。整体而言,尿液中氯丙那林残留易受总尿量影响,浓度波动幅度大,但对活体肉牛无害化处理过程具有指导意义。
0号牛,即对照组肉牛尿样中氯丙那林浓度全程低于检出限。尽管牛尿中氯丙那林浓度受排尿量等因素影响,但3头试验用牛在饲喂期间浓度波动范围在108.8~1460 ng/mL之间,能真实反映用药与否。同时,休药后21 d,仍有低浓度氯丙那林检出,表明牛尿可作为饲养、运输环节氯丙那林使用情况监测用样品。同时,由于该方法简便易行,对活体肉牛无害化处理过程具有指导意义。
值得注意的是:毕言锋等对氯丙那林在猪尿中的主要代谢产物研究显示[2],羟基化氯丙那林及其轭合物是猪尿中的主要代谢产物,其浓度约为氯丙那林原型及其轭合物的2倍左右。因而,反刍动物尿液中氯丙那林残留标示物的研究,还有待进一步深入研究。
[1] Hongyuan Yan, Suting Liu, Mengmeng Gao,etal. Ionic liquids modified dummy molecularly imprinted microspheres as solid phase extraction materials for the determination of clenbuterol and clorprenaline in urine[J]. Journal of Chromatography A, 2013,(1294): 10-16.
[2] 毕言锋, 王亦琳, 叶妮, 等. 超高效液相色谱-四极杆-飞行时间质谱检测和鉴定猪尿中氯丙那林的主要代谢产物[J]. 色谱, 2015, 33(7):704-710.
[3] 周炜, 陈慧华, 应永飞, 等. 高效液相色谱-四级杆/线性离子阱质谱法筛查兽药中非法添加物的研究[J]. 中国兽药杂志, 2014, 48(4):24-28.
[4] 农业部1519号公告.禁止在饲料和动物饮水中使用苯乙醇胺A等11种物质[S].
[5] 农业部1025号公告-18-2008. 动物源性食品中β-受体激动剂残留检测 液相色谱-串联质谱法[S].
[6] 农业部1063号公告-3-2008. 动物尿液中11种β-受体激动剂的检测 液相色谱-串联质谱法[S].
[7] 农业部1063号公告-6-2008. 饲料中13种β-受体激动剂的检测 液相色谱-串联质谱法[S].
[8] 周炜, 朱聪英, 应永飞, 等. 高效液相色谱-串联质谱法测定动物尿液中23种β-受体激动剂的检测[J]. 中国兽药杂志, 2013,47(9):46-52.
[9] 王丽娜, 刘凯, 李延山, 等. 超高效液相色谱-串联质谱法研究克伦特罗在绒山羊体内消除规律[J]. 中国兽药杂志, 2014,48(3):42-46.
(编辑:侯向辉)
Metabolism of Clorprenaline in Serum and Urine of Beef Cattles
ZHU Cong-ying, ZHOU Wei*, LU Chun-bo, CHEN Hui-hua, YING Yong-fei, ZHANG Hang-jun, HOU Xuan, ZHOU Zhi-qiang
(AnimalProductsQualityTestingCenterofZhejiangProvince,Hangzhou311199,China)
The metablism of Clorprenaline (CLO) in serum and urine, which are two kinds of characteristic samples could be easy acquired were investigated in 4 female fattening beef cattle by LC-MS/MS.Three cattles were supplied with CLO, mixed with concentrated feed, once perday at 1 mg/kg·bw level and last 30 days,then a 45 days off-drug period was followed. In serum, 100 ng/mL CLO were detected at 2 h after the single dose of exposure, then the blood concetration were increased progressively untill 20 days. But just after 3-day drug withdrawal, the levels of CLO were under detecion limit. In urine, the concentrations of CLO were between 358 ng/mL and 1456 ng/mL after the single dose of exposure. Due to various reasons, sharp fluctuation of the CLO level in urine were observed during the continuous exposure. Till 3-week drug withdrawal, low level of CLO could aslo be found, which were under detecion limit at 45th day. The serum and urine could be used to monitor the illegal using of CLO, and the monitoring of CLO in urine have directive significance to the innocent treatment of live beef cattles.
clorprenaline; cattle serum; cattle urine; characteristic samples; metabolism
公益性农业行业专项(201203023-4)
朱聪英,高级畜牧师,从事畜产品及投入品质量安全检测与质量管理研究。
周炜。E-mail: zhouwei0732@sohu.com
2016-02-27
A
1002-1280 (2016) 05-0034-05
S859.79

