外源病毒检验用抗鸭瘟病毒特异性阳性血清的制备与检定
李翠,张秀英,蒋卉,戴志红,杨承槐,孙淼,王在时
(中国兽医药品监察所,北京 100081)
外源病毒检验用抗鸭瘟病毒特异性阳性血清的制备与检定
李翠,张秀英,蒋卉,戴志红,杨承槐,孙淼,王在时*
(中国兽医药品监察所,北京 100081)
为制备鸭瘟种毒和鸭瘟活疫苗检验用抗鸭瘟病毒特异性阳性血清,对6个月龄左右的山羊进行五次免疫。最后一次免疫后2周采血并分离血清,血清经混合、分装、冷冻真空干燥后,对其进行了无菌检验、外源病毒检验、剩余水分测定、中和效价测定、均匀性检验。结果表明,本研究制备的抗鸭瘟病毒阳性血清特异性良好,无菌检验、外源病毒检验和剩余水分测定均符合《中华人民共和国兽药典》(2010年版三部)规定;血清中和效价大于1∶100,均匀性良好,可满足兽药典标准中鸭瘟种毒和鸭瘟活疫苗的鉴别检验和外源病毒检验。
鸭瘟;特异性血清;检验
鸭瘟或鸭病毒性肠炎(DVE)是由鸭瘟病毒(duck plague virus, DPV)引起的鸭、鹅及多种雁行目禽类的一种急性、高致死率的传染病。目前,各主要养鸭国家均有发生该病的报道,易感鸭群初始症状通常为突发持续性高死亡现象,产蛋量明显下降[1]。鸭瘟诊断技术、诊断试剂以及疫苗等是该病防制的关键。按照世界动物卫生组织(OIE)《陆生动物诊断试验和疫苗手册》[2],病原鉴定和血清学诊断都可用抗鸭瘟病毒特异性血清进行中和试验;《中华人民共和国兽药典》(2010年版三部)[3]要求,鸭瘟活疫苗鉴别检验项中需要抗鸭瘟病毒特异性血清,但是目前国内缺乏质量稳定的抗鸭瘟病毒特异性血清。而且,由于缺乏效价较高的抗鸭瘟病毒特异性血清,目前鸭瘟活疫苗的外源病毒检验项是通过鸡检查法进行的,检验周期长,检验成本高。本研究首次以鸭瘟病毒AV1221株灭活液和鸭瘟病毒鸡胚弱毒AV1222株对山羊进行免疫,获得具有高中和效价的特异性阳性血清,并使得血清的纯净性更易控制和可靠,满足了鸭瘟毒种和鸭瘟活疫苗的检验。
1 材料与方法
1.1 材料
1.1.1 种毒 鸭瘟病毒AV1221株和鸭瘟病毒鸡胚弱毒AV1222株均由中国兽医药品监察所鉴定、保管和供应。
1.1.2 试验动物 田间6个月龄左右未得并未免疫口蹄疫的山羊。
1.1.3 SPF鸡胚 均购自北京梅里亚维通试验动物技术有限公司。
1.1.4 试剂和试剂盒 布鲁氏菌病虎红平板凝集试验用抗原由中国兽医药品监察所制备、提供;猪伪狂犬病毒gB抗体检测试剂盒、牛病毒性腹泻抗体检测试剂盒、PrioCHECK口蹄疫病毒O型抗体检测试剂盒,购自IDEXX公司;PPR Competitive ELISA试剂盒购自ID.vetScreenR;Ruminant Bluetongue Advanced Ⅱ - Serum试剂盒购自法国LSIVetTM。
1.2 方法
1.2.1 山羊筛选 选择田间6~12个月龄、未得且未免疫口蹄疫的山羊,并按照表1中列出的检验方法对支原体、布鲁氏菌病、牛病毒性腹泻/粘膜病BVDV、伪狂犬病、蓝舌病、小反刍兽疫、羊痘和口蹄疫抗体进行检测。

表1 病源抗体及其检验方法
1.2.2 抗原的制备[4]鸭瘟病毒AV1221株灭活液用灭菌生理盐水将鸭瘟病毒AV1221株毒种作50~100倍稀释,接种9~10龄鸭胚绒毛尿囊膜,每胚0.2 mL。选择接种后48~120 h内死亡的鸭胚,分别收取绒毛尿囊膜和胚液,匀浆后加入适量双抗制成鸭胚毒,冷冻保存。鸭胚毒作5000倍稀释,用9~10日龄鸭胚10个接种于绒毛尿囊膜上,每胚0.2 mL,接种后鸭胚应60~168 h内全部死亡且胎儿有明显病痕;纯净性应无细菌、霉菌、支原体及外源病毒污染。鸭胚毒满足以上标准经甲醛灭活后可作为免疫原。
鸭瘟病毒鸡胚弱毒AV1222株用灭菌生理盐水将鸭瘟病毒鸡胚弱毒AV1222株毒种作50~100倍稀释,接种9~10龄SPF鸡胚绒毛尿囊膜,每胚0.2 mL。选择接种后48~120 h内死亡的鸡胚,分别收取绒毛尿囊膜和胚液,匀浆后加入适量双抗制成鸡胚毒,冷冻保存。鸡胚毒作5000倍稀释,用9~10日龄SPF鸡胚10个接种于绒毛尿囊膜上,每胚0.2 mL,接种后鸡胚应60~168 h内全部死亡且胎儿有明显病痕;纯净性应无细菌、霉菌、支原体及外源病毒污染。鸡胚毒满足以上标准可作为免疫原。
1.2.3 免疫程序 按照表2免疫程序对山羊进行免疫。
1.2.4 血清采集与分离 最后一次免疫后2周,山羊颈动脉采血,分离血清。
1.2.5 分装冻干 将混合均匀的血清以瓶顶分装器(灭菌)在无菌条件下定量分装至洗涤干净、且经过150 ℃干烤灭菌30 min的安瓿中,每支安瓿装量1 mL,冻干后抽真空封口。
1.2.6 无菌检验、支原体检验、外源病毒检验、真空度测定和剩余水分测定 按文献3进行。
1.2.7 中和效价测定 将血清56 ℃灭活30 min后2倍系列稀释,选取适宜稀释度与鸭瘟病毒AV1222株100 ELD50/0.1 mL的病毒液等量混合,室温下作用60 min后,经绒毛尿囊膜接种9~10日龄SPF鸡胚5枚,每胚0.2 mL。同时设病毒对照鸡胚5枚(每胚接种100 ELD50/0.1 mL的病毒液0.1 mL)、血清毒性对照鸡胚5枚(每胚接种血清原液0.1 mL),阴性血清对照鸡胚5枚(每胚接种阴性血清中和病毒液0.2 mL),37 ℃孵育168 h,观察鸡胚死亡数,根据中和组鸡胚死亡情况,按照Reed-Muench方法计算血清的中和抗体效价。

表2 鸭瘟高免血清免疫程序
1.2.8 均匀性检验 从冻干血清中随机选取10支进行中和效价测定,采用方差分析法统计样品均匀性。
1.2.9 3批鸭瘟活疫苗及种毒外源病毒检验 按文献[3]将3批疫苗稀释至200羽份/2 mL和20羽份/2 mL,种毒稀释至103.0ELD50/0.1 mL,分别与等体积56 ℃灭活30 min的抗鸭瘟病毒特异性血清混合,置室温作用60 min后,分别接种鸡成纤维细胞和10日龄SPF鸡胚,进行外源病毒检验。
2 结果与分析
2.1 无菌检验、支原体检验、外源病毒检验和真空度测定 从冻干血清中随机选取5支按文献3分别进行无菌检验、支原体检验、外源病毒检验和真空度测定,均无菌生长,且无外源病毒污染,检验合格。
2.2 剩余水分测定 按文献3进行,剩余水分含量为0.7%、1.1%、0.8%、0.7%,均小于3%,检验合格。
2.3 中和效价测定 随机抽取10支冻干血清,无菌生理盐水复溶后56 ℃灭活30 min,10倍稀释后再2倍倍比稀释至1∶80、1∶160、1∶320和1∶640,测定其中和100ELD50/0.1 mL的鸭瘟病毒AV1222株的中和效价。结果见表3。
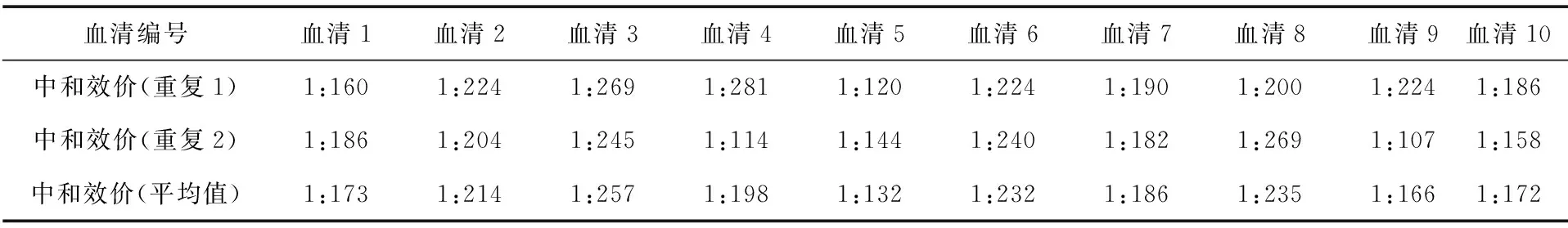
表3 10支冻干阳性血清中和效价测定结果
2.4 均匀性检验 采用方差分析法统计样品均匀性。此方法是通过组间方差和组内方差的比较来判断各组测量值之间有无系统性差异,如果两者的比小于统计检验的临界值,则认为样品是均匀的。经检验,10个样品组内与组间无明显差异,样品是均匀的。
2.5 3批鸭瘟活疫苗和种毒外源病毒检验 3批疫苗样品和种毒的外源病毒检验结果见表4,结果表明,1 mL血清能完全中和病毒含量为104.0ELD50/mL的种毒;2 mL血清能完全中和200羽份病毒含量为103.5ELD50/羽份的疫苗样品,以及20羽份病毒含量为104.17ELD50/羽份和104.5ELD50/羽份的疫苗样品。
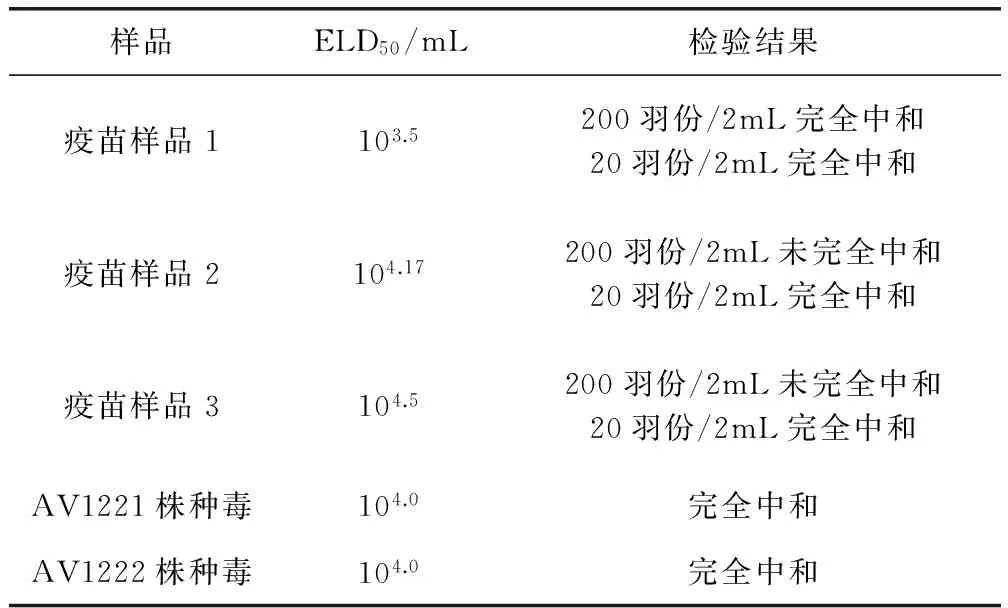
表4 三批鸭瘟活疫苗和种毒外源病毒检验结果
3 讨论与小结
本研究旨在为鸭瘟诊断技术、诊断试剂以及疫苗质量监控提供满足要求的鸭瘟阳性血清,这要求阳性血清应具有良好的特异性和足够高的中和效价。袁明龙等[5]免疫山羊制备了羊抗鸭IgG,琼扩效价达1∶64,蔡铭升等[6]免疫家兔制备了兔抗VP26血清,琼扩效价达1∶32。鉴于山羊对疱疹病毒的敏感性,本研究以山羊作为免疫动物,并优化了免疫程序,以鸭瘟病毒AV1221株灭活液基础免疫后再以鸭瘟病毒AV1221株灭活液和鸭瘟鸡胚弱化毒AV1222株活病毒协同免疫,最终获得了中和效价大于1∶100倍的鸭瘟阳性血清,可满足兽药典标准中鸭瘟活疫苗及毒种的外源病毒检验和鉴别检验;以山羊作为免疫动物,其不含有禽源病原体,在试验动物纯净度上容易控制,保证了阳性血清具有良好的特异性。另外,免疫原为鸭瘟病毒AV1221株灭活液和鸭瘟病毒鸡胚弱毒AV1222株,容易获得且避免使用鸭瘟强毒免疫,降低了生物安全风险;免疫程序共经过五次免疫,简便易行,适合大规模制备。
本研究制备的抗鸭瘟病毒特异性血清可满足兽药典标准中鸭瘟活疫苗及毒种的外源病毒检验和鉴别检验,有望将兽药典标准中鸭瘟活疫苗的外源病毒检验方法修改为鸡胚检查法,以缩短检验周期,降低检验成本。
[1] 殷震,刘景华. 动物病毒学[M]. 第二版. 北京: 科学出版社, 1997:1073-1077.
[2] 世界动物卫生组织著, 农业部兽医局/中国动物卫生与流行病学中心译. 陆生动物诊断试验和疫苗手册[M]. 第五版. 北京:中国农业科学技术出版社, 2007: 828-834.
[3] 中国兽药典委员会. 中华人民共和国兽药典三部(二〇一〇年版)[M]. 北京: 中国农业出版社, 2011: 65-66.
[4] 范书才, 李虹, 朱良全, 等. 鸭瘟灭活疫苗种毒筛选及生产用种毒种子批的建立[J]. 中国预防兽医学报, 2009, 31(6): 458-461.
[5] 袁明龙, 杨永纪, 诸奎龙, 等. 鸭瘟抗体检测方法研究[J]. 中国预防兽医学报, 2001, 23(2): 140-143.
[6] 蔡铭升. 鸭瘟病毒UL35基因的原核表达、蛋白纯化、转录时相、表达时相及亚细胞定位[D]. 雅安: 四川农业大学, 2009.
(编辑:侯向辉)
Preparation and Identification of Specific Antiserum against Duck Plague Virus for Test
LI Cui, ZHANG Xiu-ying, JIANG Hui, DAI Zhi-hong, YANG Cheng-huai, SUN Miao, WANG Zai-shi*
(ChinaInstituteofVeterinaryDrugControl,Beijing100081,China)
To prepare the specific antiserum against duck plague virus (DPV) for test, goats with about 6 months old were inoculated with live and inactivated DPV. 2 weeks after the last immunity, serums were collected and mixed thoroughly. After lyophilization, the serum was used for sterility test, exogenous virus test, residual moisture test, neutralization titer determination and uniformity test. The results of sterility test, exogenous virus test, residual moisture testcomplied with China veterinary pharmacopoeia. The neutralization titer was higher than 1∶100. The antiserum against DPV was prepared with high specificity and good uniformity for the identifying inspection and exogenous virus test of duck plague live vaccines and virus seeds.
duck plague virus; specific antiserum; test
“十二五”农村领域国家科技计划课题(2015BAD12B03-07),948项目(2011-G14(4))
李翠,从事兽用标准物质管理与研究。
王在时。E-mail:wangzaishi@ivdc.org.cn
2015-12-31
A
1002-1280 (2016) 05-0007-04
S852.65

