大肠杆菌菌体O抗原单因子定型血清的制备
张媛,刘博,王秀丽,张磊,李建,彭国瑞,辛凌翔,蒋玉文
(中国兽医药品监察所,北京 100081)
大肠杆菌菌体O抗原单因子定型血清的制备
张媛,刘博,王秀丽,张磊,李建,彭国瑞,辛凌翔,蒋玉文*
(中国兽医药品监察所,北京 100081)
为研制大肠杆菌菌体O抗原单因子定型血清,以大肠杆菌参考菌株CVCC1345(O2)、CVCC1350(O7)、CVCC1414(O74)为菌种制备抗原免疫家兔,获得了定型原血清,并通过比较不同免疫程序及剂量优化了定型原血清的制备工艺。进而按照优化后的定型原血清制备工艺,以大肠杆菌参考菌株CVCC1343(O1)、CVCC1345(O2)、CVCC1350(O7)、CVCC1405(O64)、CVCC1414(O74)、CVCC1439(O100)、CVCC1442(O103)、CVCC1455(O116)、CVCC1466(O128)、CVCC3801(O154)为菌种制备抗原免疫家兔,获得了10种O抗原型定型原血清。将定型原血清分别与180种微量凝集试验抗原逐一反应,明确各原血清与非特异性抗原的交叉凝集价,通过用吸收抗原对原血清进行吸收及稀释的方法消除非特异性凝集,最终制备成大肠杆菌菌体O抗原单因子定型血清。血清质量评价结果表明,新制备的单因子定型血清性状为无色、淡黄色或黄色澄明液体,个别有少量絮状物;无菌生长;特异性良好;凝集效价为1︰2。研究结果显示,制备的大肠杆菌O抗原单因子定型血清具有较好的特异性,可以用于对临床分离大肠杆菌进行O抗原血清型鉴定。
大肠杆菌;菌体抗原;单因子血清
大肠杆菌病是一类重要的人畜共患病,每一株大肠杆菌只具有单一菌体抗原型(O抗原型),其O抗原型与菌株致病性相关,多项关于致病性大肠杆菌检测的国家标准及行业标准中都要求对其O抗原进行血清学凝集试验,以确定其O抗原型[1-2]。目前丹麦国家血清研究院(SSI)等国外研究机构可提供大肠杆菌O抗原单因子定型血清,但由于其血清产品在国内售价昂贵限制了应用。尤其是在兽医领域进行动物源大肠杆菌O抗原型的鉴定,广大兽医工作者仍是使用国内的血清产品[3-6]。但是,现今国内相关产品由于制备工艺粗糙,产品质量与国外血清仍有较大差距,用国内血清往往鉴定不出菌株的单一血清型,以致目前许多养殖场及兽医科研机构面临着国内血清定不出型,国外血清买不起的尴尬局面。本课题组拟改进大肠杆菌O抗原定型血清制备工艺,制备出可达到国外同类产品水平的定型血清。
1 材料与方法
1.1 材料
1.1.1 菌株 大肠杆菌参考菌株CVCC1343(O1)、CVCC1345(O2)、CVCC1350(O7)、CVCC1405(O64)、CVCC1414(O74)、CVCC1439(O100)、CVCC1442(O103)、CVCC1455(O116)、CVCC1466(O128)、CVCC3801(O154),由中国兽医微生物菌种保藏管理中心提供;大肠杆菌临床分离菌株,由中国兽医药品监察所细菌制品检测室提供。
1.1.2 培养基 普通肉汤、普通琼脂、硫乙醇酸盐、酪胨、葡萄糖蛋白胨汤,购自北京中海动物保健科技公司。
1.1.3 试剂 大肠杆菌O抗原定型血清、180种大肠杆菌菌体微量凝集试验抗原,由中国兽医药品监察所细菌制品检测室提供;大肠杆菌O抗原单因子定型血清,购自丹麦国家血清研究院(SSI);206佐剂,由金宇保灵生物药品有限公司惠赠;含0.5%石碳酸生理盐水,购自北京中海动物保健科技公司。
1.1.4 实验动物 健康家兔,1.5~2.0 kg,购自北京维通利华实验动物技术有限公司。
1.1.5 主要仪器设备 GNP-9270型隔水式恒温培养箱购自上海精宏实验设备有限公司;THZ-C型恒温振荡器购自太仓市实验设备厂;Herasafe KS生物安全柜购自德国Heraeus公司;离心机购自美国BIO-RAD公司。
1.2 方法 本试验利用大肠杆菌参考菌株CVCC1345(O2)、CVCC1350(O7)、CVCC1414(O74)制备免疫抗原,开展了免疫程序的研究,明确了定型原血清制备工艺。进而按照定型原血清制备工艺,以大肠杆菌参考菌株CVCC1343(O1)、CVCC1345(O2)、CVCC1350(O7)、CVCC1405(O64)、CVCC1414(O74)、CVCC1439(O100)、CVCC1442(O103)、CVCC1455(O116)、CVCC1466(O128)、CVCC3801(O154)为菌种制备免疫抗原免疫家兔,制备了10种定型原血清。将定型原血清分别与180种微量凝集试验抗原逐一反应,明确各原血清与非特异性抗原的交叉凝集价,通过制备吸收抗原对血清进行吸收及稀释的方法消除非特异性凝集,制备成大肠杆菌菌体O抗原单因子定型血清。并对新制备的血清进行了质量评价,具体试验方法如下:1.2.1 抗原浓度的确定 将大肠杆菌CVCC1345、CVCC1350、CVCC1414株冻干菌种接种普通肉汤培养基复壮后,划线接种普通琼脂平皿,37 ℃培养20 h后,取单菌落接种普通肉汤100 mL,37 ℃ 200 r/min培养24 h后,通过活菌计数计算菌液浓度。每株菌均制备3批菌液,通过计算3株菌共9批菌液的浓度对数值的平均值及标准差确定抗原浓度。
1.2.2 抗血清的制备 免疫抗原的制备:将大肠杆菌CVCC1345、CVCC1350、CVCC1414株菌种制备的菌液的浓度调整至确定的抗原浓度范围内,121 ℃高压1 h,待其恢复室温后,按0.1%加入甲醛溶液,置2~8 ℃保存备用。油佐剂抗原的制备:免疫抗原与206佐剂按1∶1(V/V)进行乳化后置2~8 ℃保存备用。免疫程序的优化:每种抗原免疫8只健康非免兔,免疫前采血,分离血清,将血清与180种反应抗原进行微量凝集试验,反应体系为80 μL血清+80 μL抗原,反应条件为51±1 ℃过夜。由于与180种抗原反应需要约15 mL血清,为了不影响兔体健康状况,每只兔仅采集少量血液,提取的血清进行16倍稀释后再与抗原反应。而后将8只兔随机分为2组,4只/组,其中第1组耳静脉注射免疫抗原,免疫5次,每次间隔7 d,首免剂量为1 mL/只,以后逐次递增1 mL,每次注射后第7天采血,分离血清,将血清进行16倍稀释后测血清效价;第2组皮下注射油佐剂抗原两次,间隔21 d,第1次免疫1 mL/只,第2次免疫2 mL/只,第2次免疫后第14天起按照与第1组相同的免疫程序用免疫抗原进行静脉注射,分别于第1次免疫后7 d、14 d、21 d、第2次免疫后7 d、14 d及每次注射免疫抗原后第7天采血,分离血清,将血清进行16倍稀释后测血清效价。分别计算每组4只兔血清效价的几何平均值,确定定型血清制备的免疫程序。
1.2.3 制备10种定型原血清 按照定型原血清制备工艺制备。
1.2.4 定型原血清交叉凝集素及交叉凝集效价的测定 使用U底96孔板将O1、O2、O7、O64、O74、O100、O103、O116、O128、O154 10种未进行稀释的定型原血清分别与180种反应抗原进行微量凝集试验。孔底出现白色扣状沉积为阴性,即血清与抗原不凝集;反之,未出现白色扣状沉积为阳性,即血清与抗原凝集;若孔底白色扣状沉积与凝集颗粒同时出现,结果判为可疑。将与多于60种非特异性抗原发生交叉凝集的原血清淘汰,测定剩余原血清与非特异性抗原发生交叉凝集的效价。在U底96孔板的第1列每孔中加入血清原液160 μL,其余列每孔中加入含0.5 %石碳酸生理盐水80 μL,然后从第1列吸出80 μl血清加入第2列中进行对倍稀释,混匀后再从第2列吸出80 μL加入第3列中,以此方法进行对倍系列稀释至第11列,即稀释210倍,从第11列中吸出80 μL弃去。第12列作为抗原对照。在每行的12个孔中加入与之发生非特异性凝集的抗原80 μL,振荡均匀后盖上板盖,放置于湿盒中,于51 ℃反应过夜。反应完成后,取出96孔板,对光观察结果。以出现阳性反应的血清最高稀释倍数作为定型原血清与非特异性抗原的交叉凝集价。
1.2.5 定型原血清交叉凝集素的吸收 选用交叉凝集价最高的非特异性抗原的生产菌株制备吸收抗原。取冻干菌种分别接种普通肉汤10 mL复苏,37 ℃静置培养20 h,再各划线接种普通琼脂平板2付,37 ℃培养20 h。从平板上挑取光滑圆整菌落分别密集划线接种普通琼脂中管斜面数支,37 ℃培养 24 h。每支中管斜面培养物用3 mL 0.5 %石炭酸生理盐水洗下,分别混合置分装瓶中,121 ℃高压1 h后作为吸收抗原,待其恢复室温后置2~8 ℃保存备用。将待吸收血清用0.5 %石炭酸生理盐水进行5倍稀释后,按20 %(V/V)加入吸收抗原,置37 ℃ 200 r/min吸收3 h,然后置2~8 ℃继续吸收24 h,3000 r/min离心15 min后吸取上清,作为待检血清。取80 μL待检血清与80 μL非特异性抗原通过微量凝集试验方法,测定待检血清与非特异性抗原的交叉凝集情况,若非特异性交叉凝集情况已完全消除,则该血清为单因子血清;若待检血清仍与部分非特异性抗原发生交叉凝集,但凝集价远远低于其与特异性抗原的凝集价,则将血清进行适当稀释至非特异性交叉凝集情况完全消除;若待检血清仍与部分非特异性抗原发生交叉凝集,且凝集价和血清与特异性抗原的凝集价很接近,则需再次选取吸收抗原并再次进行交叉凝集素的吸收,直至制备出单因子血清。将制备好的单因子血清效价稀释至1︰2,过滤除菌后进行无菌检验[7]。检验合格的血清定量分装至玻璃瓶中,1 mL/瓶,置2~8 ℃保存。
1.2.6 单因子血清质量检验 常规方法进行性状及无菌检验[7]。采用微量凝集试验方法进行特异性检查及效价测定。
1.2.7 鉴定临床分离菌株血清型 用原有库存定型血清、新制备的单因子定型血清、丹麦国家血清研究院生产的单因子定型血清同时对6株E.coli临床分离菌株进行O抗原血清型鉴定。原有库存定型血清采用平板凝集与试管凝集相结合的方法;新制备的单因子定型血清与丹麦国家血清研究院生产的单因子定型血清采用微量凝集试验方法。
2 结果
2.1 抗原浓度的确定 3株大肠杆菌制备的9批菌液的浓度对数值的平均值为9.902,标准差为0.112,因此,抗原浓度确定为6.2×109~1.0×1010CFU/mL(表1)。
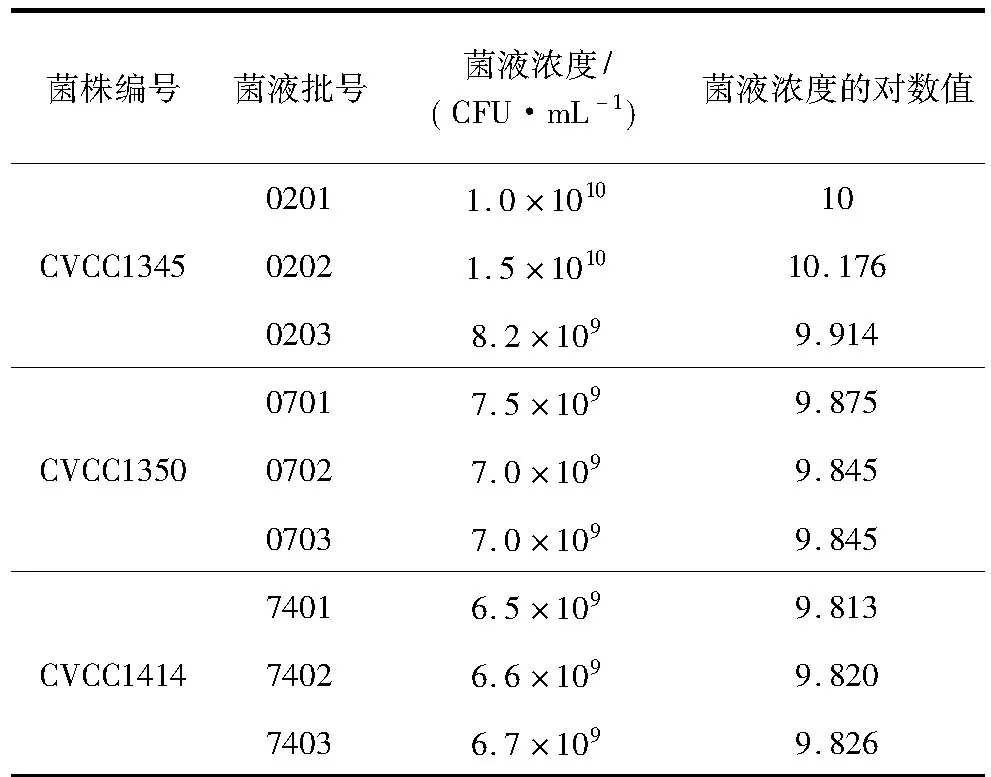
表1 大肠杆菌菌液活菌计数结果
2.2 免疫前后家兔血清效价检测结果 免疫前24只家兔血清16倍稀释液与180种反应抗原均不凝集。仅注射免疫抗原及先用油佐剂抗原免疫再注射免疫抗原两种免疫程序制备的血清效价差异不明显,但仅注射免疫抗原免疫周期仅为35 d,而先注射油佐剂抗原再注射免疫抗原的免疫周期需要70 d,况且免疫抗原静脉免疫4次后,血清效价即可满足生产需要(表2)。

表2 免疫后家兔血清效价几何平均值
免疫程序Ⅰ为仅注射免疫抗原;免疫程序Ⅱ为先注射油佐剂抗原再注射免疫抗原;“/”表示未进行检测;“-”表示血清与抗原不凝集
将冻干菌种接种普通肉汤培养基37 ℃培养20 h,取肉汤培养物划线接种普通琼脂平皿,37 ℃培养20 h,取单菌落接种普通肉汤100 mL,37 ℃ 200 r/min培养24 h后,进行活菌计数。将菌液浓度调整至6.2×109~1.0×1010CFU/mL 范围内,121 ℃高压1 h,待其恢复室温后,按0.1 %加入甲醛溶液,此为免疫抗原,置2~8 ℃保存备用。耳缘静脉注射免疫抗原4次,免疫剂量分别为1 mL、2 mL、3 mL、4 mL,每次免疫间隔7 d。最后一次免疫后第4天试血,若血清效价不低于1∶64对免疫兔进行心脏采血致死,提取血清;若血清效价低于1∶64,则用相同的抗原5 mL以相同的注射途径加强免疫一次,并于加强免疫后第4天试血,若血清效价不低于1∶64则采血;若血清效价仍低于1∶64则淘汰该兔。
2.3 制备10种定型原血清 按照定型原血清制备工艺,每种抗原免疫2只家兔,免疫CVCC1405(O64)、CVCC1414(O74)及CVCC1442(O103)抗原的家兔各有1只在加强免疫后血清效价仍低于1∶64予以淘汰。制备了O1、O2、O7、O64、O74、O100、O103、O116、O128、O154共10个血清型的大肠杆菌菌体O抗原定型原血清。
2.4 定型原血清交叉凝集素及凝集价的测定 不同原血清与非特异性抗原交叉凝集情况不一,最少仅与1种非特异性抗原发生交叉凝集,而最多与168种抗原发生交叉凝集。即使同一抗原免疫不同家兔获得的原血清与非特异性抗原的交叉凝集情况也不一致。将与多于60种非特异性抗原发生交叉凝集的原血清淘汰,测定剩余原血清与非特异性抗原发生交叉凝集的效价(表3)。

表3 原血清与180种反应抗原微量凝集试验结果

续表
加下划线的抗原表示同一血清型的2份原血清共有的交叉凝集抗原;黑体突出显示的抗原表示为吸收抗原
2.5 单因子定型血清的制备 采用吸收与稀释相结合的方法制备了10种大肠杆菌菌体O抗原单因子定型血清(表4)。

表4 单因子定型血清制备
2.6 单因子血清质量检验 大肠杆菌菌体O抗原单因子定型血清性状为无色、淡黄色或黄色澄明液体,个别有少量絮状物;无菌生长;特异性良好;凝集效价为1∶2(表5)。
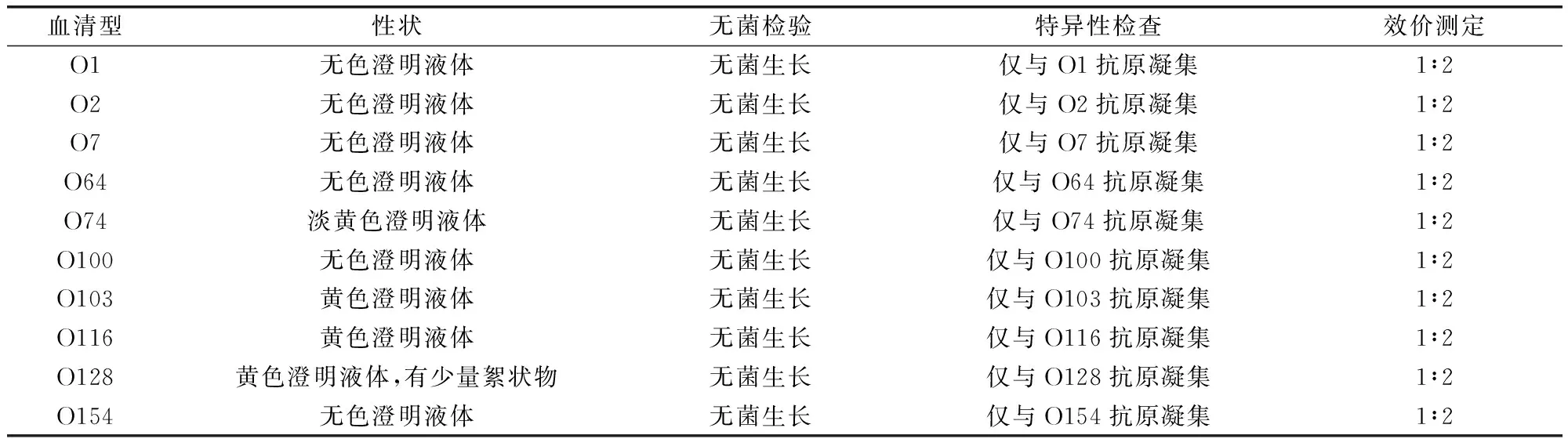
表5 单因子定型血清检验结果
2.7 鉴定临床分离菌株血清型 用原有库存血清对6株临床分离菌株进行O抗原血清型鉴定,鉴定结果分别为O2和O74混合型、O103和O154混合型、O7和O116混合型、O1和O128混合型、O2和O64混合型、O100和O154混合型,用新制备的单因子定型血清和丹麦国家血清研究院生产的单因子定型血清对6株临床分离菌株进行O抗原血清型鉴定,鉴定结果均为O2、O103、O116、O1、O2、O100(表6),表明新制备的定型单因子血清可用于大肠杆菌的O抗原定型,并具有良好的特异性,定型结果与丹麦血清完全一致。

表6 临床分离菌株O抗原血清型鉴定结果
3 讨论
典型的脂多糖分子(lipopolysaccharide,LPS)由O特异性多糖链、核心多糖和类脂A三个部分共价连接而成。O特异性多糖链又称O抗原多糖链,简称O抗原。O抗原结合在核心多糖上,位于脂多糖分子的最外层,是细菌细胞主要的表面抗原。O抗原由寡糖单位组成,每个重复单位通常由4~6个糖组成。这些糖通常为中性糖、氨基糖,有时为罕见的脱氧糖。单糖的不同,单糖数量的不同,单糖间键的不同,和寡糖单位之间联接键的不同构成了多糖的多样性[8]。大肠杆菌有180种不同结构的O抗原。O抗原构成革兰氏阴性菌的菌体抗原,可以刺激机体产生特异性免疫反应。一般合成O抗原的基因成簇分布在细菌的基因组上,在大肠杆菌中O抗原基因簇位于galF和gnd基因之间[9]。在O抗原基因簇中,一般含有三种基因:单糖合成酶基因,糖基转移酶基因,寡糖单位处理酶基因。寡糖单位处理酶基因带有特定的序基,或有特殊的拓扑结构,从而决定了O抗原定型血清的特异性。但是,单糖合成酶基因较高的同源性,又导致了不同型O抗原免疫动物制备的抗血清间存在交叉凝集[10]。本研究对临床分离菌株O抗原血清型鉴定时,使用了原有库存血清、新制血清和丹麦血清进行了比较,其中原有库存血清为未进行非特异性凝集消除的原血清,用其对临床菌株进行O抗原血清型鉴定时常无法确定单一血清型,而新制备的血清以及丹麦血清均为去除抗血清的非特异凝集后的单因子血清,试验结果表明用此二种血清对用原有库存血清无法定型的菌株进行O抗原血清型鉴定,可以鉴定出单一血清型。
抗血清的特异性是决定试验方法可靠性的重要因素,这也是众多研究者试图解决的问题。吸收是消除抗血清非特异性凝集的经典方法,稀释的方法也常被应用到细菌抗血清的制备中[11-12]。本研究采用吸收与稀释相结合的方法去除抗血清的非特异性凝集,从而获得特异性较高的单因子血清。
本研究确定了大肠杆菌O抗原定型血清的制备工艺,所制备的O抗原定型血清各项指标经检测均合格,无菌、特异,达到国外同类产品水平,可用于大肠杆菌O抗原血清型的鉴定。
[1] GB/T 4789.6-2003. 食品卫生微生物学检验致泻大肠埃希氏菌检验[S].
[2] WS/T 8-1996. 病原性大肠艾希氏菌食物中毒诊断标准及处理原则[S].
[3] 马长宾,陈文武,陈海军,等. 规模化猪场仔猪源大肠杆菌血清型调查及耐药性检测[J]. 畜牧与兽医,2016,48(3):27-32.
[4] 韦丽莉. 廊坊地区鸡大肠杆菌的血清型鉴定及药敏试验[J]. 黑龙江畜牧兽医,2015,1:79-81.
[5] 杨彩霞,张冰,宁鹏飞,等. 辽宁地区奶牛临床型乳房炎大肠杆菌的血清型及耐药性调查[J]. 中国兽医杂志,2016,52(6):92-94.
[6] 伍莉,陈鹏飞. 鸭致病性大肠杆菌的血清型鉴定及敏感药物的临床应用[J]. 中国兽医杂志,2015,51(12):41-43.
[7] 中华人民共和国兽药典二〇一〇年版三部[S].
[8] Caroff M. Structural and functional analyses of bacterial lipopolysaccharides[J]. Microbes and Infection, 2002, 4: 915-926.
[9] Reeves P R. Role of O-antigen variation in the immune response[J]. Trends in Microbiology, 1995, 3: 381-386.
[10]Reeves P R, L Wang. Genomic organization of LPS-specific Loci[J]. Current Topics in Microbiology and Immunology, 2002, 264(1): 109-350.[11]Mittal K R, Higgins R, Lariviere S. Quantitation of serotype-specific and cross-reacting group-specific antigens by coagglutination and immunodiffusion tests for differentiatingActinobacillus(Haemophilus)pleuropneumoniaestrains belonging to reacting serotypes 3, 6 and 8[J]. J Clin Microbiol, 1988, 26: 985-989.
[12]Mittal K R, Higgins R, Lariviere S. Identification and serotyping ofHaemophiluspleuropneumoniaeby coagglutination[J]. J Clin Microbiol, 1983, 18:1351-1354.
(编辑:李文平)
Preparation of Mono-specific Anti-O-antigen Serum ofE.coli
ZHANG Yuan, LIU Bo, WANG Xiu-li, ZHANG Lei, LI Jian,PENG Guo-rui, XIN Ling-xiang, JIANG Yu-wen*
(ChinaInstituteofVeterinaryDrugControl,Beijing100081,China)
Mono-specific anti-O-antigen serum ofEscherichiacoli(E.coli) was developed and prepared in this research. Firstly, antigens were prepared usingE.coli
trains of CVCC1345 (O2), CVCC1350 (O7) and CVCC1414 (O74) respectively and raw sera were obtained from rabbits immunized with the antigens above separately. Productive technology of raw serum was optimized by comparing different immune procedures and doses of the three antigens. Then ten raw sera were harvested using the optimized productive technology by immunizing rabbits with antigens prepared from 10E.colireference strains CVCC1343(O1),CVCC1345(O2),CVCC1350(O7),CVCC1405(O64),CVCC1414(O74),CVCC1439(O100),CVCC1442(O103),CVCC1455(O116),CVCC1466(O128),CVCC3801(O154). Cross-agglutination was detected by reacting sera with 180 micro-agglutination test antigens respectively and eliminated by absorption with non-specific antigens and dilution. Finally mono-specific anti-O-antigen sera ofE.coliwere obtained. Quality evaluation of sera showed that newly prepared mono-specific anti-O-antigen sera were colorless, pale yellow or yellow clear sterilized liquid with good specificity. Only a few had a little floccule. Agglutination titer was 1∶2. All the results suggested that newly prepared mono-specific anti-O-antigen sera could be applied in serotype identification of clinical isolatedE.colistrains with their good specificity.
Escherichiacoli; somatic antigen; mono-specific serum
张媛,副研究员,从事需氧菌类生物制品检测工作。
2016-09-18
A
1002-1280 (2016) 11-0009-08
S855.1

