猪肺炎支原体S株的分离与鉴定
魏晶晶,李聪研,孙亚波,李秋菊,宋潇婷,刘富东,史文艳,宁宜宝,孙晔,,沈青春,*
(1.北京中海生物科技有限公司,北京 100081;2.中国兽医药品监察所,北京 100081;3.吉林和元生物工程股份有限公司,吉林松原138000)
猪肺炎支原体S株的分离与鉴定
魏晶晶1,李聪研1,孙亚波1,李秋菊3,宋潇婷1,刘富东1,史文艳1,宁宜宝2,孙晔1,2,沈青春1,2*
(1.北京中海生物科技有限公司,北京 100081;2.中国兽医药品监察所,北京 100081;3.吉林和元生物工程股份有限公司,吉林松原138000)
从典型猪肺炎支原体病变肺组织传代分离到一株支原体,经培养特性、血清学鉴定、生化鉴定、PCR检测及测序分析证明其为猪肺炎支原体,纯化后命名为S株。将S株P46基因和P97基因R1区的氨基酸序列与其他菌种的相应序列进行同源性分析,该菌株P46基因氨基酸序列与其他菌种同源高达99%以上,P97基因R1区的氨基酸重复数为11个,不同于其他菌株;免疫原性试验结果表明该菌株具有良好的免疫原性。
猪肺炎支原体;分离;检测;鉴定
猪支原体肺炎,又称猪地方流行性肺炎(EPS),俗称猪喘气病,是由猪肺炎支原体引起的一种慢性、消耗性呼吸道传染病。主要的临床特征表现为咳嗽、气喘、生长迟缓,一般不引起猪的死亡,但有时感染率可达90%以上,容易与其他疾病(如蓝耳病、传染性胸膜肺炎、猪瘟等)协同感染,对我国养猪业造成了重大的经济损失。该病分布十分广泛,世界各地均有发生,也被认为是危害各国养猪业的重要疫病之一[1]。由于猪肺炎支原体的生长繁殖对营养和培养条件的要求极其苛刻,而其田间分离时其常和细菌性疾病混合感染(如猪传染性胸膜肺炎放线杆菌[2-3]、副猪嗜血杆菌[3-4]、猪鼻支原体[5-7]等),导致分离到纯净的猪肺炎支原体相当困难。本研究通过从吉林的发病猪场采集病变肺组织,进行分离,培养,并对其进行培养特性、生化鉴定、血清学和分子生物学鉴定,并对其特征性基因序列与国内外所发表的序列进行比对[8-9]。
1 材料与方法
1.1 材料1.1.1 病料与菌毒种来源 10份具有典型猪支原体肺炎病变特征的猪肺组织,来自吉林的2家商品代猪场。猪肺炎支原体强毒JN株、猪肺炎支原体232株和猪鼻支原体BST-7,来自中国兽医药品监察所。
1.1.2 试剂和培养基 PPLO与猪血清购自GIBCO公司;PCR相关试剂购自全式金公司;引物由上海生工生物工程技术服务有限公司合成;兔抗Mhp特异性阳性血清(琼扩效价1∶16)由中国兽医药品监察所提供。LPS液体培养基(含PPLO、葡萄糖、MEM等)和猪肺炎支原体间接血凝(IHA)抗原(批号:201305)由北京中海生物科技有限公司自制。IMS 1313水性佐剂,法国赛比克公司提供。进口猪支原体肺炎复合佐剂灭活疫苗,批号为BH14011,市场购买。
1.1.3 试验动物 清洁级健康家兔,来自北京维通利华实验动物技术有限公司。7~14日龄健康仔猪,购自吉林松原市商品代猪场,母猪免疫猪支原体肺炎疫苗,仔猪猪肺炎支原体抗原、抗体阴性,猪瘟、猪伪狂犬与猪蓝耳病抗原阴性。
1.2 方法
1.2.1 病原分离培养 将无菌采集病变肺组织置于一次性平皿中,撕去筋膜,经含一定浓度青霉素的PBS反复清洗后,剪碎后用高速匀浆机处理,取1.0 mL匀浆液接种于含19.0 mL LPS液体培养基的盐水瓶中,(37±1) ℃培养10~14 d,每天观察记录培养基颜色变化情况。对待分离病料匀浆液使用猪肺炎支原体16s RNA特异性引物进行PCR检测。
7 d以内培养基颜色明显变化的小管进行PCR检验,结果为阴性的样品放弃分离;14 d内出现颜色变化的小管经PCR检测结果为阳性的,立即传代培养;14 d后如仍未变色则对其进行忙传,同时进行PCR检测。
1.2.2 菌落形态和生化鉴定 对分离物使用LPS培养基进行传代培养,待其生长时间和活菌滴度稳定后进行菌落形态和生化鉴定。
菌落形态:将新鲜培养物稀释100倍后,接种LPS固体培养基,置5% CO2的培养箱中,(37±1)℃培养7 ~14 d,7 d后开始每日使用低倍显微镜观察支原体菌落一次。
生化鉴定:取单菌落纯化后的培养物,分别接种含0.5%葡萄糖、尿素、精氨酸的液体培养基中,(37±1)℃培养7 d,观察培养基颜色变化情况以确定培养物对其是否发酵。
1.2.3 血清学鉴定 代谢抑制试验:使用液体培养基对分离株进行10倍比稀释至10-7,在10-5、10-6、10-7三个稀释度分别取1 mL,加入到装有1 mL含20%兔抗Mhp阳性血清的液体培养基的小管中混匀,取10-5、10-6、10-7三个稀释度各2 mL作为对照组。另设2 mL液体培养基作空白对照组,于(37±1)℃培养14 d后判定结果。空白对照不变色,对照组3个滴度都变黄,试验组至少10-6、10-7两个滴度不变色即可判定为分离物只含有猪肺炎支原体。
生长抑制试验:将直径6 mm滤纸片用兔抗Mhp阳性血清浸湿后干燥待用。将培养物稀释成含104CFU/mL,取0.5 mL涂布于LPS固体培养基表面,取2片含兔抗Mhp阳性血清的滤纸片,均匀贴于琼脂表面,设猪肺炎支原体232株培养物作为对照。(37±1)℃培养14 d,在低倍镜下观察,当滤纸片周围出现抑菌圈大于1.0 mm者表示该菌种与抗血清系免疫原同种。
1.2.4 分子生物学鉴定
1.2.4.1 PCR鉴定 采用猪肺炎支原体的16 s RNA特异性引物[10]进行筛查和鉴别检验,其扩增条带大小分别为649 bp,反应条件:预变性后94 ℃/30 s、56 ℃/30 s、72 ℃/45 s,30个循环后72 ℃延伸5 min。使用可同时鉴别猪肺炎支原体、猪鼻支原体和猪絮状支原体多重PCR引物[11]检验,其扩增片段大小依次分别为1000 bp、1129 bp和754 bp,反应条件:预变性后94 ℃/30 s、54 ℃/30 s、72 ℃/60 s,30个循环后72 ℃延伸5 min。多重PCR可以确定培养物为猪肺炎支原体,而且可以判定是否有其他两种猪源支原体的污染。
1.2.4.2 特异性基因的克隆 P46、P97蛋白基因是猪肺炎支原体的具有较强种特异性的基因,根据国内外文献[8, 10, 12]和NCBI上公布的猪肺炎支原体232株的P46、P97基因全序列各设计一对特异性引物。P46基因引物为P46-F:5'-CGGGATCCACTTCAGATTCTAAACCACAA-3',P46-R:5'-CCAAGCTTTTAGGCATCAGGATTATCAAC-3',目标片段大小为1105 bp;P97蛋白R1区扩增引物为P97-F:5'-GGTATATTGCCTCAGCCC-3', P97-R:5'-GTGAAAAGCCAGTATTAGTA-3,R1区是一个高变重复区,不同菌种的重复数量不同,因此扩增片段大小会有较大的差别,Mhp 232株的扩增片段大小预计为为344 bp。DNA模板采用热裂解法制备[13],根据两对引物各自的反应条件进行PCR后,取5 μL扩增产物进行电泳检测。1.2.4.3 序列分析 对分离株的P46和P97 R1区的PCR扩增产物分别进行双向测序,并同GENEBANK和现有的其他菌种进行序列同源性分析和比对,并依此对其进行了分子进化上的亲缘关系分析。
1.2.5 免疫原性测定 将猪肺炎支原体S株使用LPS培养基培养扩大后,收获、灭活菌液,再将其与法国赛比克公司IMS 1313水佐剂按(V/V)1:1的比例混合,搅拌均匀后制备水剂灭活疫苗。
对家兔的免疫原性:1.2~1.5 kg健康家兔15只,5只为空白对照,2个实验组各5只,各组分别前腿部肌肉注射试验苗和进口灭活疫苗0.2 mL,14 d后后腿肌肉注射0.2 mL。首免后21 d检测各组家兔的猪肺炎支原体IHA抗体效价。
本动物免疫攻毒试验:用7~14日龄健康易感仔猪15头,其中5头对照,2个实验组各5头,分别用于S株试验苗和进口灭活疫苗的免疫,每头左颈部肌肉注射1.0 mL,14 d后右侧颈部肌肉注射1.0 mL。首免后30 d,连同对照组使用猪肺炎支原体JN株肺组织毒进行气管内攻毒,5 mL/头(含肺组织量0.1 g)。观察28 d后剖检,猪支原体肺炎病变指数评分标准5.5分法进行评分和计算[14]。
2 结果与分析
2.1 分离结果 10份分离样品中的7份在培养3~5 d即发生显著的颜色变化,经无菌和支原体检验结果表明其中2个样品有细菌污染,5个样品污染了疑似猪鼻支原体。3份到14 d仍未变色,其中2份样品传代后经猪肺炎支原体特异性PCR检测结果为阴性。1份样品的分离物在传代后13 d发生了明显的颜色变化,经检测PCR检测分离物中含猪肺炎支原体。
将分离菌株连续传递至第5代后,10%接种量生长时间在3 d左右,活菌数CCU稳定在109CCU/mL。
2.2 菌落形态和生化鉴定 分离物在LPS固体培养基上培养10 d后,针尖大小的菌落,显微镜下观察为表面略有颗粒状,大多数菌落边缘不整齐的菌落,挑取形态较为典型的中等大小菌落进行克隆纯化,纯化后的菌株命名为猪肺炎支原体S株。
生化鉴定结果为培养物能发酵葡萄糖,不发酵尿素和精氨酸,符合猪肺炎支原体的代谢特性。
2.3 血清学鉴定 代谢抑制试验:各试验小管于37 ℃培养14 d后,空白对照不变色,阴性对照组3个滴度10-5、10-6、10-7都变黄,试验组相应的三个滴度均未变色,表明培养物可被兔抗Mhp高免血清完全抑制,由此表明待检分离物为猪肺炎支原体。
生长抑制试验将分离株接种LPS固体培养基,培养10 d后,肉眼可见针尖大小的菌落,显微镜下观察为露滴状圆形菌落,表面略有颗粒状,但在含Mhp特异性血清滤纸片周围1.0 mm内无支原体菌落出现,结果表明待检分离物为猪肺炎支原体。
2.4 PCR扩增结果 通过16s RNA特异性引物对分离菌种、猪肺炎支原体232株和猪鼻支原体BTS-7进行PCR,扩增产物经1%琼脂糖凝胶电泳,结果如图1。使用多重PCR对分离菌株的F10、F15和F20代培养物进行检测,结果如图2。
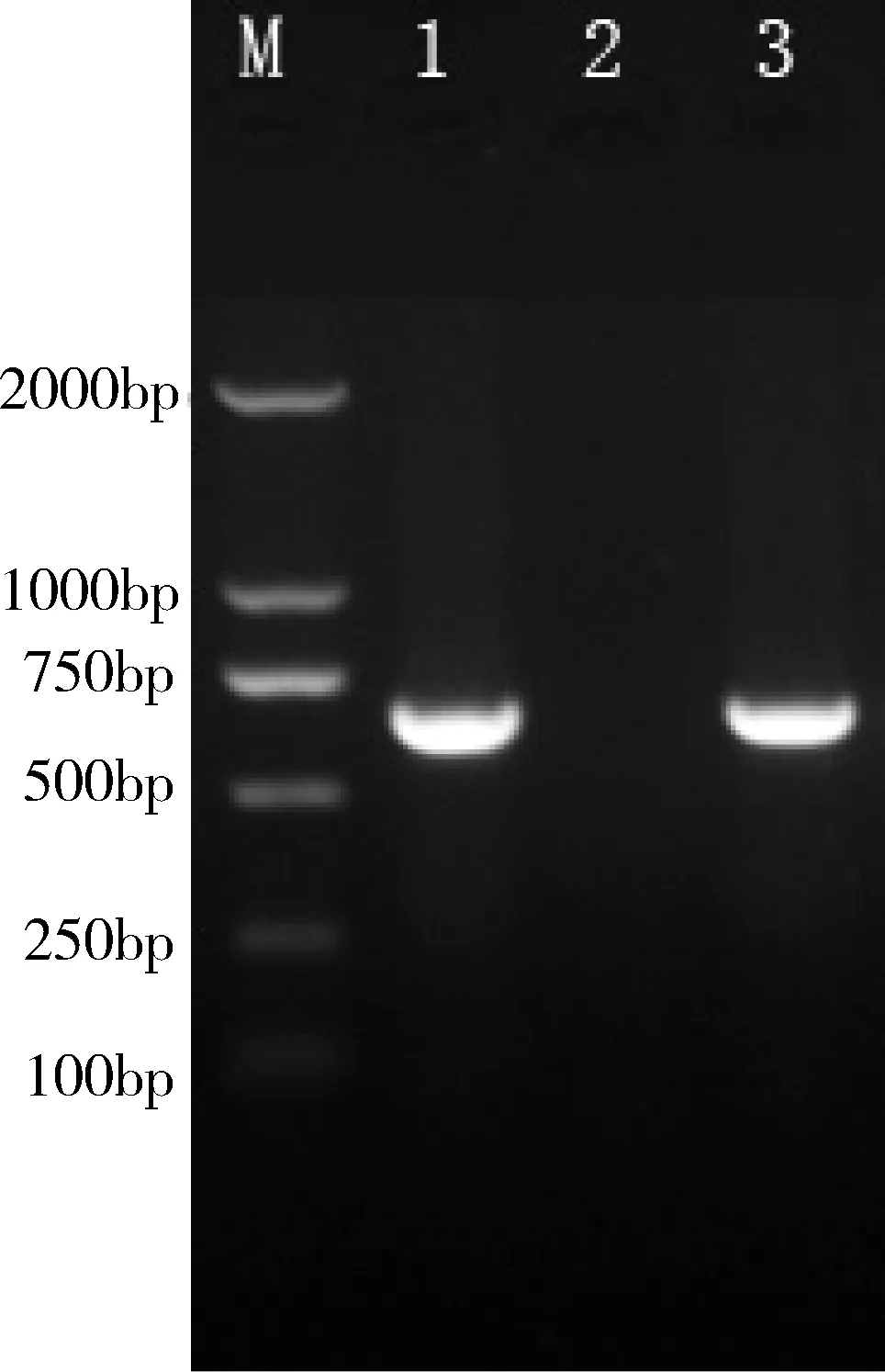
M.DL2000 marker; 1. Mhp 232(阳性对照);2. Mhr BTS-7(阴性对照);3. S株图1 使用猪肺炎支原体特异性引物的PCR扩增结果
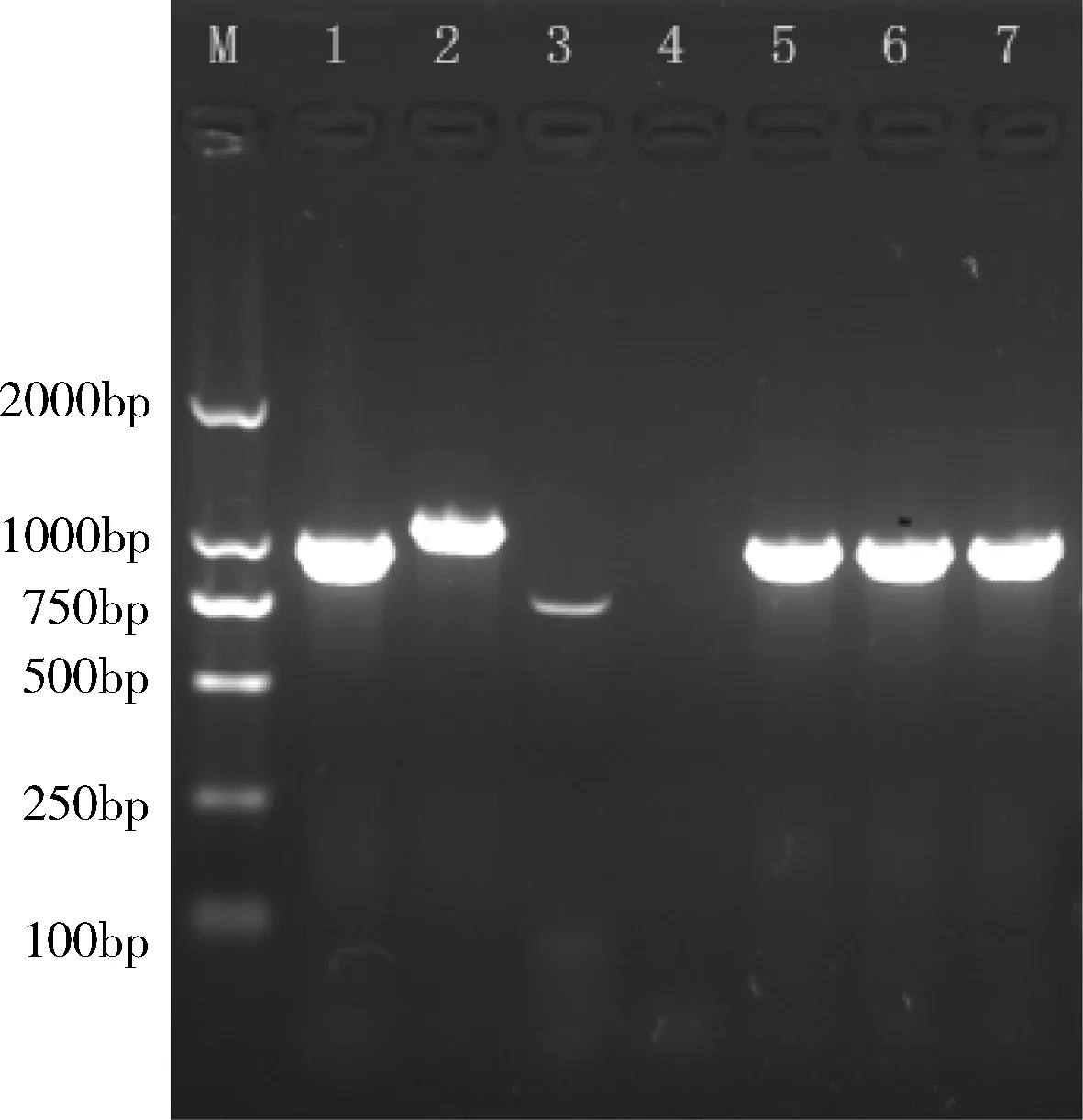
M.DL2000 marker; 1. Mhp 232;2. Mhr BTS-7;3. Mfc SJ株;4.空白对照;5-7.分离株的F10、F15和F20培养物。图2 使用多重PCR对培养物的鉴定电泳图结果
从图1可以看出,分离物经16 s RNA特异性引物检测可以扩增出预计大小的特异性条带,表明培养物中含有猪肺炎支原体。图2采用猪肺炎支原体、猪鼻支原体和猪絮状支原体多重PCR检测,结果显示分离株的F10、F15和F20代培养物均只能扩增出1000 bp大小的特异条带,表明分离物中含有猪肺炎支原体,不含猪鼻支原体和猪絮状支原体。
2.5 P46基因和P97基因R1区检测 使用P46基因引物和P97基因R1区引物对猪肺炎支原体S株的扩增结果见图3。

1. DL2000 DNA Marker;2. S株 ;3. Mhp 232株(阳性对照);4.Mhr BTS-7株(阴性对照);图3 对猪肺炎支原体S株的P46基因(图A)和P97基因的R1区(图B)的扩增结果
上图结果显示,P46基因扩增出1100 bp的条带,与对照完全一致。P97基因R1区引物对S株的扩增条带大小270 bp左右,与232株的344 bp差异显著,初步推断为S株的R1区的重复数量比232株的数量要少,可通过序列分析进行确认。
2.6 测序结果分析比对 将图2的PCR产物连接T载体后进行序列分析,结果表明目标序列与猪肺炎支原体完全符合,进一步确认了分离物为猪肺炎支原体。使用DNA Star基因序列分析软件对纤毛粘附蛋白P97基因-R1区扩增的猪肺炎支原体S株与GENEBANK及国内文献上的其他菌种进行氨基酸序列比对,结果如图4。

图4 P97基因R1区氨基酸序列比对结果
P97基因-R1区是猪肺炎支原体特有的氨基酸水平上的重复序列区,也同时是一个高变区。AA(V/T)PKE(V)重复序列数目因菌株的不同而不同,其中232株的重复数为15个,新分离S株的为11个,这正好解释了图3B中其P97 R1区扩增片段大小不一致的原因。将R1区的序列作为依据,划出各菌株的进化树和同源性关系图,如图5所示。
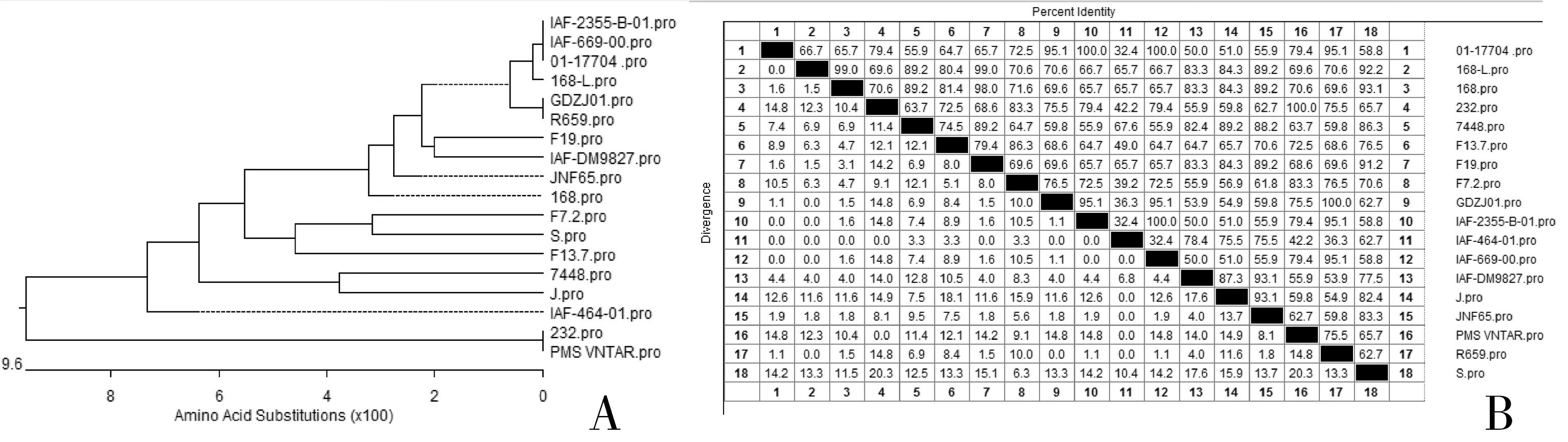
图5 依照不同菌种的P97基因R1区氨基酸序列分析得出的进化树(A)和同源性比对表(B)
从进化树和同源性关系表可知,S株与F7.2株的情缘关系较近,与来自江苏农科院的168株和168L株的同源性也最高,而且AA(V/T)PKE/V重复数均为11个,但在第2、5、10、25、32、45、50位氨基酸上不同。
猪肺炎支原体S株的P46基因扩增产物连接T载体后,进行序列分析,并将其翻译成氨基酸序列后,使用Lasergene 7.0软件对其相应序列与GENEBANK及国内文献上的其他菌种进行氨基酸序列比对,结果如图6所示。
通过对表面抗原P46基因的扩增的新分离S株与其他12个菌种的相应序列比对,碱基序列和氨基酸序列均具有高度同源性达99%以上,各菌株相互间氨基酸序列中有5处不同,分别为120、165、174、204和212位,其中S株在204位编码的是谷酰胺(gln,Q),而其他菌株均编码丙氨酸(gla,A),为S株所独有。将P46基因的氨基酸序列作为依据,划出各菌株的进化树和同源性关系图,如图7所示。
从进化树和同源性关系表可知,S株与7448株、IAF-2355-B-01株、IAF-669-00株、JNF65株等的情缘关系较近,同源性也最高。由于P46基因比较保守,菌株间的同源性均高达99%以上。
2.7 免疫原性测定 对家兔的免疫原性实验结果显示对照组应全部阴性(<1:5),免疫组试验兔的IHA抗体效价不低于1∶20,结果见表1。
从上表可以看出,猪支原体肺炎S株试验疫苗免疫家兔后,IHA抗体效价可达到1∶40以上,与对照组差异显著,综合抗体水平略高于同类进口疫苗抗体水平。

表1 家兔免疫后抗体IHA效价测定结果表
对猪的免疫原性攻毒后第14天对照组个别猪开始出现咳嗽症状,到剖检前有3头咳嗽、气喘明显;试验组攻毒后均未出现明显的咳嗽。攻毒后28 d后剖检,各组的猪支原体肺炎病变指数评分和保护力计算结果如表2。

图6 S株Mhp P46基因推导的氨基酸序列与代表毒株比对分析
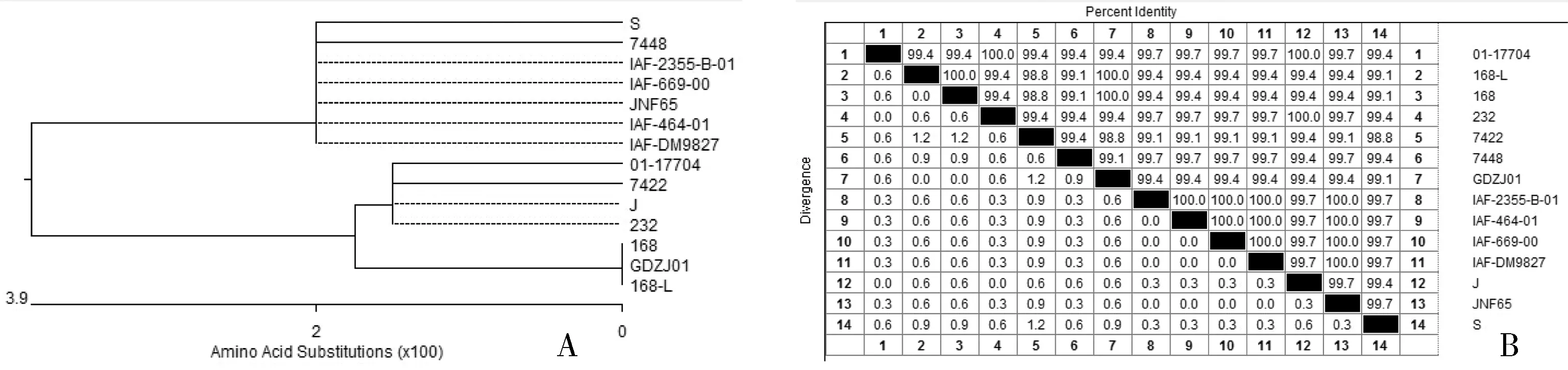
图7 依照不同菌种的P46基因R1区氨基酸序列分析得出的进化树(A)和同源性比对表(B)

表2 仔猪攻毒后肺部病变情况
免疫攻毒试验结果显示猪支原体肺炎S株试验疫苗具有较强的免疫保护力,达80%以上的水平,与进口同类疫苗差别不明显。由此表明猪肺炎支原体S株具有较好的免疫原性。
3 讨论与小结
猪肺炎支原体是当前最难分离的支原体种类之一,其对营养和培养条件要求极其苛刻,而且可能受极易生长的猪鼻支原体和猪絮状支原体的干扰,导致其分离率极低而不易成功。支原体鉴定方法中,除了菌落形态和生化鉴定外,最具排它性鉴别意义的是血清学鉴定,因为支原体具有类似于病毒中和特性的代谢抑制特性,其为细菌所不具有的特殊性质[15]。支原体的代谢抑制特性具有很强的种属特异性,即针对一种支原体的高免血清只能抑制该种支原体的生长繁殖,而对其他种类的支原体不具有抑制作用,因而代谢抑制试验和生长抑制试验成为支原体鉴定中的金标准[16-18]。
在PCR检测方面,16s RNA特异性引物PCR具有很强的特异性和较高的敏感性,适合于进行筛查和鉴别检验[13];多重PCR采用了4条引物,通过共用下游引物,同时检测三种猪源支原体(包括猪肺炎支原体、猪鼻支原体和猪絮状支原体),适合于鉴别检验,也可确定培养物是否污染其他两种或一种支原体[10]。
P46是Mhp具有较强的种特异性蛋白,不存在于其他种类的支原体或其他微生物中,是猪肺炎支原体诊断试剂常用的备选蛋白。P46基因具有很强的保守性,不同菌株的核酸和氨基酸序列同源性均高达98%以上,适合用于猪肺炎支原体的鉴别[19-20]。P97蛋白是Mhp重要的表面粘附因子,及主要抗原蛋白,对造成机体支气管上皮细胞和纤毛损伤有着重要的作用。P97蛋白的氨基酸序列中有两个特殊的重复序列区,即由五个氨基酸[AA(V/T)PKE(V)]组成的R1区(位于N末端)和由10个氨基酸(GTPNQGKKAE)组成的R2区(位于C末端),R1区的重复序列的数目因不同菌株而异,因此R1区重复数和其序列特征可作为辨别不同菌株的依据[21- 22]。猪肺炎支原体S株的R1区数目为11个,与国内168株的数目相同,同源性也最高,是否可以说明该重复数存在地域上的关系,则需通过更多国内分离株相应数据加以说明。
本研究成功分离和鉴定了一株猪肺炎支原体菌株,通过对P46和P97 R1区进行序列分析,并将其与GenBank及国内文献上的其他菌种氨基酸序列进行比对,表明该菌株明显区别于其他菌株。猪肺炎支原体S株在LPS生长滴度可稳定可达109CCU/mL,通过免疫原性测定证明其具有较好的免疫原性,有望作为灭活疫苗株的备选菌种进行后续研发。
[1] 沈青春, 宁宜宝, 覃青松. 猪肺炎支原体的研究进展[J]. 中国兽药杂志, 2003,(6):26-30.
[2] 文希震, 山本孝史, 舆水馨, 等.猪肺炎支原体选择分离培养的研究[J]. 兽医科技资料, 1979,(3):56.
[3] 陈祝三, 陈竹兰, 陈廷和, 等.从冻结和冻干病肺中分离猪肺炎支原体的试验[J]. 家畜传染病, 1981,(4):19-21.
[4] 韦艳娜, 白昀, 孔猛, 等. 猪肺炎支原体的分离方法[J]. 江苏农业学报, 2012,(1):104-107.
[5] 猪气喘病病原体——猪肺炎支原体的分离和培养研究[J]. 兽医科技资料, 1978,(1):17-20.
[6] 廖永洪, 张许科, 孙进忠, 等.一株猪肺炎支原体HN0613株的分离鉴定[J]. 中国兽药杂志, 2013,47(3):4-6.
[7] 何正礼, 储静华, 金洪效, 等.培养猪肺炎支原体新的价廉培养基[J]. 畜牧兽医学报, 1979,(1):59-66.
[8] 卢会英, 沈青春, 宁宜宝. 猪肺炎支原体p97 R1区基因和大肠杆菌LTB基因的重组和表达[J]. 中国兽医杂志, 2010,(4):3-6.
[9] 覃青松, 宁宜宝, 沈青春. 猪肺炎支原体表面蛋白P46基因的克隆与序列比较[J]. 中国预防兽医学报, 2004,(4):266-269.
[10]Stakenborg T, Vicca J, Butaye P,etal. A multiplex PCR to identify porcine mycoplasmas present in broth cultures[J]. Vet Res Commun, 2006,30(3):239-247.
[11]沈青春, 王芳, 韩明远, 等.猪肺炎支原体P46基因的原核表达与间接ELISA方法的建立[J]. 畜牧兽医学报, 2012,(3):431-437.
[12]高玉花, 张映. 猪肺炎支原体三种抗原蛋白基因的克隆、序列分析及原核表达. In; 2010; 中国云南昆明; 2010.
[13]沈青春, 覃青松, 王琴, 等.PCR方法测定猪肺炎支原体培养物菌数[J]. 中国预防兽医学报, 2006,(1):55-57.
[14]沈青春, 吴思杰, 范学政, 等.猪支原体肺炎活疫苗(RM48株)的最小免疫剂量测定及活菌滴度与免疫保护率平行关系试验[J]. 中国兽药杂志, 2014,48(12):1-4.
[15]Purcell R H, Wong D, Chanock R M,etal. Significance of antibody tomycoplasmaas measured by metabolic-inhibition techniques[J]. Ann N Y Acad Sci, 1967,143(1):664-675.
[16]Poveda J B, Nicholas R. Serological identification ofmycoplasmasby growth and metabolic inhibition tests[J]. Methods Mol Biol, 1998,104:105-111.
[17]Poveda J B. Biochemical characteristics in mycoplasma identification[J]. Methods Mol Biol, 1998,104:69-78.
[18]Assuncao P, Diaz R, Comas J,etal. Evaluation ofMycoplasmahyopneumoniaegrowth by flow cytometry[J]. J Appl Microbiol, 2005,98(5):1047-1054.
[19]Okada M, Asai T, Futo S,etal. Serological diagnosis of enzootic pneumonia of swine by a double-sandwich enzyme-linked immunosorbent assay using a monoclonal antibody and recombinant antigen (P46) ofMycoplasmahyopneumoniae[J]. Vet Microbiol, 2005,105(3/4):251-259.
[20]Futo S, Seto Y, Mitsuse S,etal. Molecular cloning of a 46-kilodalton surface antigen (P46) gene fromMycoplasmahyopneumoniae: direct evidence of CGG codon usage for arginine[J]. J Bacteriol, 1995,177(7):1915-1917.
[21]Deutscher A T, Jenkins C, Minion F C,etal. Repeat regions R1 and R2 in the P97 paralogue Mhp271 ofMycoplasmahyopneumoniaebind heparin, fibronectin and porcine cilia[J]. Mol Microbiol, 2010,78(2):444-458.
[22]Hsu T, Minion F C. Molecular analysis of the P97 cilium adhesin operon ofMycoplasmahyopneumoniae[J]. Gene, 1998,214(12):13-23.
(编辑:侯向辉)
Isolation and Identification of Strain S of Mycoplasma hyopneumoniae
WEI Jing-jing1, LI Cong-yan1, SUN Ya-bo1, LI Qiu-ju3, SONG Xiao-ting1,LIU Fu-dong1, SHI Wen-yan1, NING Yi-bao2, SUN Ye1,2, SHEN Qing-chun1,2*
(1.BeijingZhonghaiBiotechCoLtd,Beijing100081,China;2.ChinaInstituteofVeterinaryDrugControl,Beijing100081,China;3.JilinHeyuanBioengineeringCoLtd,Songyuan,Jiiin138000,China)
10 lesioned lung tissues from typical swine mycoplasmosis were grinded, cleaned, and subjected to isolation, and a mycoplasma strain was obtained. The mycoplasma was proved to beMycoplasmahyopneumoniae(Mhp) by culture character, serological identification, biochemical identification, PCR test and sequencing. The purefied isolated strain was named Mhp strain S. Afterwards, Homology comparison was performed on genetic sequence and amino acid sequence of P46 and P97 R1 region with the available sequence of other strains, the results show that the amino acid sequence of P46 gene is more than 99% homology with other strains, the number of P97 R1 region amino acid repeat sequence of the Mhp strain S is 11, different from other strains. The immunogenicity test results showed that the isolation strain had good immunogenicity.
Mycoplasmahyopneumoniae; isolation; test; identification
魏晶晶,从事兽用生物制品的科研和管理工作。
沈青春。E-mail:shenqingchun@ivdc.org.cn
2015-12-28
A
1002-1280 (2016) 02-0015-07
S852.62

