骨髓间充质干细胞移植对大鼠癫痫海马神经炎症的抑制作用研究
王涛 罗强 张世荣 龙乾发
·论著·
骨髓间充质干细胞移植对大鼠癫痫海马神经炎症的抑制作用研究
王涛 罗强 张世荣 龙乾发
目的 探讨骨髓间充质干细胞(BMSCs)移植对大鼠癫痫海马神经炎症的抑制作用。方法 体外分离纯化SD大鼠BMSCs,BMSCs处理的无血清αMEM和单纯无血清αMEM分别设为实验组和对照组,而后应用ELISA检测BMSCs培养基中抗炎细胞因子单核细胞趋化蛋白-1(MCP-1)和肿瘤坏死因子-α-刺激基因-6(TSG-6)的表达。匹罗卡品腹腔注射诱导大鼠癫痫模型,侧脑室注射5×106个BMSCs和同体积生理盐水分别设为实验组和对照组,未经处理的SD大鼠设为正常对照,4 d后免疫组织化学检测各组海马小胶质细胞或活化的小胶质细胞表达变化。单因素方差分析检测各组数据差异,组间数据比较采用独立 t检验。结果 BMSCs条件培养基中MCP-1(61.8 ±15.64)pg/ml和TSG-6(1.3±0.12)ng/ml的表达较对照组明显上升(P < 0.01)。匹罗卡品诱导癫痫模型后,小胶质细胞胞体和突起所占面积百分比(39.2%± 7.68%)较正常对照组(11.7%±3.47%)明显增多(P < 0.01),且ED1染色发现小胶质细胞明显活化。BMSCs移植4 d后,小胶质细胞和活化的小胶质细胞表达较癫痫对照组明显下降(P <0.01)。结论 BMSCs具有旁分泌抗炎细胞因子的潜能,其移植对大鼠癫痫海马神经炎症具有明显抑制作用。
脑炎; 骨髓; 间质干细胞; 旁分泌; 癫痫
癫痫是大脑神经元突发性异常放电引起的慢性神经功能障碍综合征,危害世界约5 000万人口的生命健康,其中我国约900万人受影响,因此癫痫已成为我国乃至全球范围内最常见的神经系统疾病之一[1]。随着医学科学的发展,抗癫痫药物、手术、神经刺激等使60%~ 70%的癫痫患者病情得以控制,但仍有约1/3的患者对药物不敏感或手术等治疗作用有限[2]。骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)源于发育早期中胚层和外胚层,因其具有多向分化潜能、低免疫原性、旁分泌功能等生物学特性,已成为目前研究最为广泛的干细胞之一,且被发现在癫痫中具有重要的治疗潜能[3]。前期研究证实BMSCs移植对癫痫海马中间神经元损伤具有明显保护作用,但移植细胞在海马中的分化替代作用并不明显[4-5],越来越多的证据表明BMSCs治疗疾病的基础主要源于其旁分泌作用特别是免疫调节功能[6]。尽管癫痫的病理机制不清,可能包括神经炎症、线粒体损伤、氧化应激、血脑屏障受损等,其中以小胶质细胞活化为代表的神经炎症被认为是癫痫海马中间神经元损伤的重要原因[7-8]。但国内外关于BMSCs移植对癫痫海马神经炎症的治疗作用未见报道,因此本研究假设BMSCs移植对癫痫模型海马神经炎症具有抑制作用。
材料和方法
一、材料
1.实验动物:35只4 ~ 6周雄性SD大鼠购于西安交通大学医学部实验动物中心,动物饲养及操作均遵循实验动物伦理学标准。
2. BMSCs准备:BMSCs准备参照参考文献[9]报道的方法。主要方法如下:4只SD大鼠充分麻醉后,无菌条件下取股骨和胫骨骨髓,加入等体积的Histopaques-1077(美国Sigma-Aldrich公司)分离液,400×g离心25 min收集交界面单核细胞,阿尔法最小基本培养基(α-Minimum Essential Medium, αMEM)+10%FBS培养(37℃,5% CO2)7~10 d,细胞融合达70%~ 80%传代,以此类推。BMSCs表面抗原CD105、CD90、CD73、CD34和 CD11b(相应抗体购于北京博奥森公司,使用浓度1∶100)检测应用流式细胞术;成骨(美国Gibco公司,A1007201)、成软骨(美国Gibco公司,A1007101)或成脂肪(美国Gibco公司,A1007001)分化试剂盒用于检测BMSCs的多能分化潜能。第3代BMSCs应用于细胞移植。
3. ELISA检测:第3代BMSCs用无血清αMEM培养48 h,收集培养基,而后用0.22 μm小滤器(millipore)过滤待检,同时未经细胞培养的αMEM为阴性对照。根据单核细胞趋化蛋白-1(monocyte chemotactic protein 1,MCP-1)(ERMCP1,美国Thermo公司)和肿瘤坏死因子-α-刺激基因-6(tumor necrosis factor-α-stimulated gene 6,TSG-6)(MBS705965,美国Biocompare公司)ELISA试剂盒说明分别加入样品、酶结合物和底物,37℃孵育2 h后洗涤显色,酶标比色仪(美国Thermo公司)比色分析。
二、方法
1. 大鼠癫痫模型建立及BMSCs移植:匹罗卡品诱导癫痫模型建立如参考文献[4]所报道,25只SD大鼠分别腹腔注射127 mg/kg的氯化锂(美国Sigma-Aldrich公司),18 h后,1 mg/kg的甲基东莨菪碱皮下注射以降低毛果芸香碱的外周胆碱能作用,30 min后,腹腔注射40 mg/kg的匹罗卡品诱发癫痫,癫痫4 ~ 5级发作(抽搐不能站立或摔倒)后2 h,予以10 mg/kg地西泮皮下注射终止。30 min后癫痫大鼠分别接受10 μl生理盐水稀释的BMSCs(2次,共计5×106BMSCs)(实验组,n = 9)和10 μl生理盐水(2次,共计20 μl)(对照组,n = 8)侧脑室注射(中线旁开1.5 mm前囟后1 mm,进针深度距硬膜4.5 mm),癫痫造模死亡率32%(8/25)。剩余6只未经处理的SD大鼠设为正常对照。
2. 免疫组织化学:各组SD大鼠接受细胞或生理盐水处理4 d(基于该时间点为炎症高峰期)后死亡率为12%(3/25),而后实验组(n = 8)、对照组(n = 6)和正常对照(n = 6)分别断头取脑组织,4%多聚甲醛固定并石蜡包埋,横向石蜡切片(厚度30 μm),组织切片染色选择前囟后2.64 mm ~ 5.40 mm海马显著部位[9],二甲苯脱蜡和酒精水化后,柠檬酸高温高压修复抗原。3%过氧化氢处理20 min后,0.1% Triton-X 100和10%的马血清封闭30 min,而后添加山羊抗Iba1(CD68)(Catalog # ab5076,Abcam)或小鼠抗ED-1(Catalog # MACA341R,Bio-Rad Laboratories)孵育24 h(4℃)。过氧化物酶反应应用相应二抗(均购于Vector)室温孵育1 h和ABC试剂(Vector)处理后,DAB或vector SG(Cat#SK-4700,Vector)显色,脱水透明处理后封片观察。免疫荧光反应应用驴抗山羊CY3(Cat#118790,Jackson)或驴抗小鼠CY2(Cat#55046,Jackson)孵育2 h,DAPI封片照相。阴性对照用PBS替代一抗。Image-Pro plus 6.0软件分析各阳性细胞所占面积百分比,每组取8或6只大鼠,每只随机选取5个海马切片(×20)。
三、统计学分析方法
采用SPSS 16.0统计学软件进行数据分析,细胞因子浓度和阳性细胞所占面积百分比表达采用± s表示,使用单因素方差分析合并Bonferroni和 LSD检验,组间数据比较采用独立 t检测。以P <0.05为差异有统计学意义。
结 果
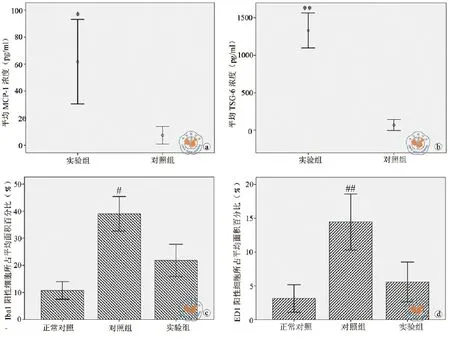
图1 抗炎细胞因子分泌和小胶质细胞表达
一、BMSCs培养鉴定
骨髓单核细胞经贴壁培养7 ~ 10 d即可达70%~ 80%融合,传第2代后细胞基本纯化,多呈纺锤形或梭形,第3代细胞经流式细胞术检测显示CD105(98.8%),CD73(96.5%)和CD90(97.2%)强表达,CD34(0.24%)和CD11b(0.92%)基本不表达。同时多能诱导显示细胞具有成骨、成软骨和成脂肪分化特性。
二、BMSCs旁分泌结果
ELISA结果显示,相比阴性对照,αMEM经BMSCs培养48 h后,所含抗炎性细胞因子MCP-1(61.80±15.64 pg/ml,图1a)和TSG-6(1331.00± 116.53 ng/ml,图1b)浓度明显升高(*P < 0.05;**P <0.001,图1a,b),尤其是TSG-6增高的浓度显著。
三、BMSCs抑制小胶质细胞活化
免疫组织化学结果显示,SD大鼠经匹罗卡品腹腔注射诱导癫痫后,经小胶质细胞特异性抗体Iba1染色发现(图2b,e),细胞胞体明显增大,突起增多,阳性细胞所占面积百分比(39.2%±7.68%)明显多于正常对照(11.7%±3.47%)(图2a,d)(P <0.01,图1c)。同时活化的小胶质细胞特异性抗体ED1染色结果显示,正常对照组中ED1(图3a,d)表达不明显,癫痫海马ED1明显增多(图3b,e)(P <0.01,图1d)。BMSCs移植后,癫痫海马Iba1(图2c,f)和ED1(图2c,f)的表达均出现明显下降(P < 0.01,与癫痫对照比较;图1c,d)。同时免疫荧光染色结果显示(图4),癫痫对照组ED1(图4b)完全与Iba1阳性细胞(图4a)共定位(图4c),且较多表达于海马CA1区。BMSCs移植后,Iba1阳性细胞(图4d)除胞体明显收缩外,只见较少ED1(图4e)与Iba1共存(图4f)。
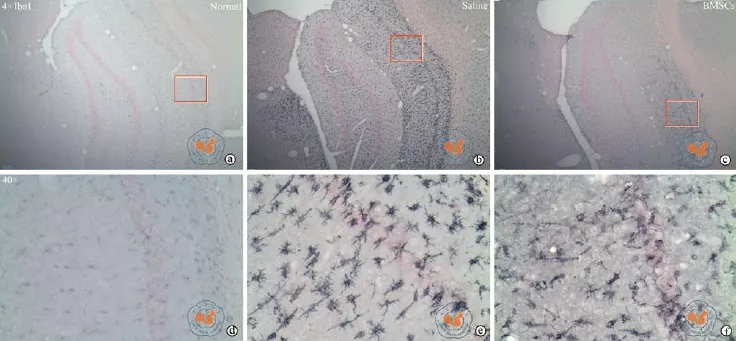
图2 倒置显微镜下观察BMSCs经Iba1免疫组化后细胞形态

图3 倒置显微镜下观察BMSCs经ED1免疫组化后细胞形态

图4 荧光显微镜下观察Iba1和ED1细胞形态 (免疫荧光染色×40)
讨 论
癫痫海马小胶质细胞活化可释放炎性细胞因子如白介素-1/6、肿瘤坏死因子受体-α或细胞毒性物质如一氧化氮、活性氧等[8],这些物质一方面可通过阻断N-甲基-D-天冬氨酸受体(N-methyl-D-aspartate receptor,NMDAR)介导的谷氨酸盐重吸收功能产生谷氨酸毒性[8],另一方面可与海马神经细胞表面受体如Toll样受体等结合激活NMDAR引发Ca2+内流导致神经元过度兴奋,因此越来越多的研究支持海马炎症是癫痫形成的重要原因[9-10]。Iba1和ED1分别为小胶质细胞和活化的小胶质细胞特异性抗体,且都在神经炎症中具有重要表达意义[11]。结合本研究ED1和Iba1在癫痫模型的表达变化,再次证实海马炎症是癫痫形成的重要病理过程。
间充质干细胞在再生医学领域中占有重要地位,特别是其旁分泌相关的免疫调节功能。尽管研究表明BMSCs具有分泌MCP-1、TSG-6、前列腺素E2、转化生长因子-β等旁分泌功能[6],但是不同来源、代数、生长条件的BMSCs生物学特性各异[12]。因此本实验为证实BMSCs的旁分泌潜能,同时基于MCP-1可增强调节性T细胞活性[13],TSG-6能促进白介素-10和诱生型一氧化氮合酶表达抑制免疫反应[14]等,挑选MCP-1和TSG-6作为抗炎检测因素,实验通过条件培养基ELISA检测证实大鼠BMSCs培养可显著提高抗炎性细胞因子MCP-1和TSG-6的表达,尤其是TSG-6的高表达提示其潜在的旁分泌-免疫调节功能。进而通过体内研究发现BMSCs移植后,Iba1和ED1阳性细胞在癫痫海马的表达效率明显下降,特别是ED1作为活化的小胶质细胞抗体,通常也为神经炎症的标记物[8],因此结果表明BMSCs明显抑制以小胶质细胞活化为代表的癫痫海马神经炎症。此外国内外研究显示,BMSCs移植后在癫痫海马内不发挥细胞分化替代作用[3-5],结合本实验中BMSCs条件培养基中抗炎细胞因子的表达变化,综合提示BMSCs的旁分泌作用可能是细胞发挥抗癫痫海马神经炎症的主要原因。但MCP-1或TSG-6是否为BMSCs抗癫痫海马神经炎症的确定因素还待进一步探明,如利用siRNA降解BMSCs中的MCP-1或TSG-6观察其治疗潜能,将在后续试验中继续验证。总之,本研究证实BMSCs具有旁分泌抗炎细胞因子的特性和抑制癫痫海马神经炎症的功能。
1 秦兵, 廖卫平, 臼井直敬, 等. 癫痫∶全球重点防治的神经精神疾病[J]. 实用医学杂志, 2012 (13)∶2109-2111.
2 Moshé SL, Perucca E, Ryvlin P, et al. Epilepsy∶ new advances[J]. Lancet, 2015, 385(9971)∶884-898.
3 Agadi S, Shetty AK. Concise review∶ prospects of bone marrow mononuclear cells and mesenchymal stem cells for treating status epilepticus and chronic epilepsy[J]. Stem Cells, 2015, 33(7)∶2093-2103. 4 Long Q, Qiu B, Wang K, et al. Genetically engineered bone marrow mesenchymal stem cells improve functional outcome in a rat model of epilepsy[J]. Brain Res, 2013, 1532∶1-13.
5 Long Q, Qiu B, Liu W, et al. Functional recovery and neuronal regeneration of a rat model of epilepsy by transplantation of Hes1-down regulated bone marrow stromal cells[J]. Neuroscience, 2012, 212∶214-224.
6 Wang Y, Chen XD, Cao W, et al. Plasticity of mesenchymal stem cells in immunomodulation∶ pathological and therapeutic implications[J]. Nat Immunol, 2014, 15(11)∶1009-1016.
7 Dey A, Kang X, Qiu J, et al. Anti-infammatory small molecules to treat seizures and epilepsy∶ from bench to bedside[J]. Trends Pharmacol Sci, 2016, 37(6)∶463-484.
8 Devinsky O, Vezzani A, Najjar S, et al. Glia and epilepsy∶ excitability and infammation[J]. Trends Neurosci, 2013, 36(3)∶174-184.
9 Amini E, Rezaei M, Mohamed Ibrahim N, et al. A molecular approach to epilepsy management∶from current therapeutic methods to preconditioning efforts[J]. Mol Neurobiol, 2015, 52(1)∶492-513.
10 Maroso M, Balosso S, Ravizza T, et al. Toll-like receptor 4 and highmobility group box-1 are involved in ictogenesis and can be targeted to reduce seizures[J]. Nat Med, 2010, 16(4)∶413-419.
11 Walter HL, Walberer M, Rueger MA, et al. In vivo analysis of neuroinfammation in the late chronic phase after experimental stroke [J]. Neuroscience, 2015, 292∶71-80.
12 Siddappa R, Licht R, Van Blitterswijk C, et al. Donor variation and loss of multipotency during in vitro expansion of human mesenchymal stem cells for bone tissue engineering[J]. J Orthop Res, 2007, 25(8)∶1029-1041.
13 Akiyama K, Chen C, Wang D, et al. Mesenchymal-stem-cell-induced immunoregulation involves FAS-ligand-/FAS-mediated T cell apoptosis [J]. Cell Stem Cell, 2012, 10(5)∶544-555.
14 Sala E, Genua M, Petti L, et al. Mesenchymal stem cells reduce colitis in mice via release of TSG6, independently of their localization to the intestine[J]. Gastroenterology, 2015, 149(1)∶163-176.
Bone marrow mesenchymal stem cells inhibite rat epilepsy-induced hippocampal neuroinflammation
Wang Tao, Luo Qiang, Zhang Shirong, Long Qianfa. Department of Neurosurgery, Xi'an Central Hospital, School of Medicine, Xi’an Jiao Tong University, Xi'an 710003, China
Long Qianfa, Email: lonva@live.cn
Objective To explore the inhibitory effects of transplanted bone marrow mesenchymal stem cells (BMSCs) on neuroinflammation in a rat model of epilepsy. Methods BMSCs were isolated from SD rats. The concentrations of anti-inflammatory cytokines such as monocyte chemotactic protein 1 (MCP-1) and tumor necrosis factor-α-stimulated gene 6 (TSG-6) in BMSCs conditioned medium were measured using ELISA. Epileptic model was induced by intraperitoneal injection of Pilocarpine, the experimental group and control group received tralateroventricular injection of 5×106BMSCs and same volume of saline respectively. 4 days later, immunohistochemistry was employed to detect the expression of microglia and activated microglia in hippocampus of different groups. One way ANOVA was used to test the variance of the data and the differences between groups were compared using Student's t-test. Results Both MCP-1 (61.8±15.64)pg/ml and TSG-6 (1.3±0.12)ng/ml in BMSCs conditioned medium were remarkably higher than the control medium (P < 0.01). After SD rats were induced by pilocarpine for 4 days,the area fractions of soma and processes of hippocampal microglia (39.2%±7.68%)increased signigicantly in comparison to the normal control (11.7%±3.47%)(P < 0.01), and the activatation of ed microglia was confirmed by ED1 staining as well. Nevertheless, after BMSCstransplantation, microglia and activated microglia significantly decreased (P < 0.01) in comparison to the epileptic model. Conclusion BMSCs transplantation is capable of inhibiting the epilepsyinduced hippocampal neuroinflammation.
Encephalitis; Bone marrow;Mesenchymal stem cells ; Paracrine;Epilepsy
2016-07-05)
(本文编辑:李少婷)
10.3877/cma.j.issn.2095-1221.2016.06.003
陕西省科学技术研究发展计划项目(2014KJXX-29)
710003 西安市中心医院神经外科
龙乾发,Email:lonva@live.cn
王涛,罗强,张世荣,等. 骨髓间充质干细胞移植对大鼠癫痫海马神经炎症的抑制作用研究[J/CD].中华细胞与干细胞杂志∶电子版, 2016, 6(6)∶339-344.

