1BL/1RS易位系小麦品质性状相关基因等位变异分析
李孟军,李亚青,张 楠,史占良
(石家庄市农林科学研究院/河北省小麦工程技术研究中心,河北 石家庄 050041)
1BL/1RS易位系小麦品质性状相关基因等位变异分析
李孟军,李亚青,张 楠,史占良*
(石家庄市农林科学研究院/河北省小麦工程技术研究中心,河北 石家庄 050041)
为了探讨1BL/1RS易位系在小麦品质育种中的潜在利用价值,利用小麦品质相关基因分子标记,明确了258份1BL/1RS易位系小麦品种(系)中5个相关基因型的分布规律。在258份1BL/1RS易位系小麦品种(系)中,Ppo-A1b和Ppo-D1a2个基因型分布频率分别为58.2%和64.0%,Ppo-A1b/Ppo-D1a基因型所占比例为36.8%。这表明1BL/1RS易位系在低PPO 活性小麦育种中具有应用价值。Psy-A1低黄色素等位变异基因型Psy-A1b仅占全部1BL/1RS易位系品种(系)的30.2%。在低黄色素小麦育种亲本组配中,应注意1BL/1RS易位系品种(系)的选择。硬质麦Pinb-D1b基因型所占比例为60.9%。在258份1BL/1RS易位系小麦品种(系)中,其中27份的基因型为Ppo-A1b/Ppo-D1a/Psy-A1b/Pind-D1b,这些品种(系)在小麦品质育种中有重要应用价值。穗发芽密切相关基因Vp1的等位基因Vp-1Ba、Vp-1Bb、Vp-1Bc所占比例分别为33.3%、3.1%、63.6%。
小麦; 1BL/1RS易位系; 品质相关基因; 分子标记
黑麦1RS染色体臂取代小麦1BS染色体臂形成的小麦—黑麦1BL/1RS 易位系,具有黑麦1RS携带的抗叶锈、秆锈、条锈和白粉病等抗病和抗虫基因[1-2],同时具有良好的丰产性和适应性,因此在世界小麦育种中被广泛使用[3-7]。1BL/1RS 易位系是继“农林10号”矮秆基因用于小麦育种后,小麦育种史上第2个开创性的成果[8]。我国20 世纪80 年代后育成的小麦品种中1BL/1RS 易位系品种约占38%,其中北方冬麦区和黄淮冬麦区频率分别为59%和42%[9]。王晓军等[10]对211 份黄淮麦区小麦品种(系)的检测显示,1BL/1RS易位系小麦占38.4%,1BL/1RS 易位杂合品种(系)占5.7%。1BL/1RS 易位系小麦在我国特别是北方冬麦区和黄淮冬麦区小麦育种和生产中占有重要地位。因此,利用分子标记分析1BL/1RS 易位系中品质相关优良等位基因,对于深入挖掘其育种潜力具有重要意义。
小麦籽粒多酚氧化酶(PPO)是造成面粉和面制品褐变的主要因素。PPO氧化籽粒中酚酸等微量营养物质,降低面粉及面制品的营养价值,因此,降低籽粒 PPO 活性是小麦品质改良目标之一[11-13]。环境因素和基因型均能影响小麦籽粒PPO的活性,但小麦基因型是主要因素[13]。控制小麦籽粒PPO活性的主效基因位于小麦第2同源群上[14-18]。标记PPO18能够检测2AL染色体上控制PPO活性的Ppo-A1的等位基因Ppo-A1a和Ppo-A1b[19];互补显性标记PPO16 和 PPO29能够检测2DL 染色体上控制PPO活性的Ppo-D1的等位基因Ppo-D1a和Ppo-D1[20]。
小麦籽粒黄色素含量与面制品颜色高度相关,八氢番茄红素合成酶(phytoene synthase,Psy)是植物类胡萝卜素合成途径中的一个关键调节酶,其活性高低影响籽粒胚乳的颜色[21]。根据小麦 7A 染色体上的Psy1-A的DNA序列多态性开发的功能标记 YP7A能够有效区分控制高、低黄色素含量的等位基因Psy-A1a和Psy-A1b,这为通过分子标记辅助选择培育低黄色素含量的小麦品种(系)提供了分子工具[22]。
籽粒硬度是小麦重要的品质性状之一。在黄淮麦区的硬质麦中,仅检测到Pinb-D1b、Pinb-D1p和Pina-D1b3种puroindoline-D1等位变异类型,其中,Pinb-D1b所占比例最高[23]。在春小麦中,Pinb-D1b类型材料的磨粉评分、馒头与面条评分均高于Pina-D1b和Pinb-D1a类型[24-25]。因此,在小麦育种中选择Pinb-D1b类型有助于提高小麦的磨粉品质和加工品质。Pinb(Puroindoline b)的单核苷酸突变导致氨基酸改变(Pinb-D1aGlycine→Pina-D1bSerine),含有Pinb-D1b类型材料籽粒硬度高于含有Pinb-D1a类型材料。Giroux等[26]根据该单核苷酸差异设计了STS引物,该引物可用于Pina-D1b基因型的分子检测。
Vp-1基因在种子的成熟、干燥及休眠过程中起关键作用[27-30]。依据Vp-1基因第3个内含子的差异开发的STS标记,在不同穗发芽抗性材料中分别扩增出3种类型的片段,分别命名为Vp-1Ba、Vp-1Bb和Vp-1Bc。在白粒小麦品种(系)中,该STS标记与其穗发芽抗性密切相关,但在红粒小麦品种(系)中无相关关系[31]。
1BL/1RS 易位系小麦在我国特别是北方冬麦区和黄淮冬麦区小麦育种和生产中占有重要地位。小麦品质相关基因功能标记的开发与应用,为更好地利用1BL/1RS 易位系小麦资源提供了新的思路。本研究选用258 份1BL/1RS易位系品种(系)进行Ppo-A1、Ppo-D1、Psy-A1、Pina-D1和Vp-1基因等位变异的分子检测,以验证这些基因分子标记的有效性,明确这些基因类型在1BL/1RS易位系小麦品种(系)中的分布规律,为1BL/1RS易位系在小麦品质育种中的应用提供参考。
1 材料和方法
1.1 供试材料
从石家庄市农林科学研究院小麦研究所和河北省农林科学院小麦资源室保存的1 850份小麦品种(系)中鉴定出1BL/1RS易位系小麦品种(系)482份[32]。在石家庄市农林科学研究院院部试验地经过连续4 a农艺性状观察,258份1BL/1RS易位系小麦品种(系)在本地区田间表现良好。本研究选用258份品种(系)用于小麦品质性状相关基因分子标记检测。
1.2 基因组 DNA 提取
258个1BL/1RS易位系小麦品种(系)分别种植于营养钵中,每个品种(系)选取3株分别提取基因组DNA。基因组DNA提取采用基因组DNA提取试剂盒(天根生化科技有限公司),操作按试剂盒说明进行。
1.3 分子标记检测
1BL/1RS易位系品质相关基因等位变异检测采用分子标记。PCR反应体系(20 μL):2×TaqPCR StarMix(GenStar)10 μL,引物(表1)各1 μL(10 μmol/L),模板基因组DNA 2 μL(100 ng/L),ddH2O 6 μL。PCR 扩增程序见文献[19,20,22,26,31,32]。PCR扩增产物采用2.0%琼脂糖凝胶电泳检测,缓冲液为 1×TAE,溴化乙锭染色观察记录。
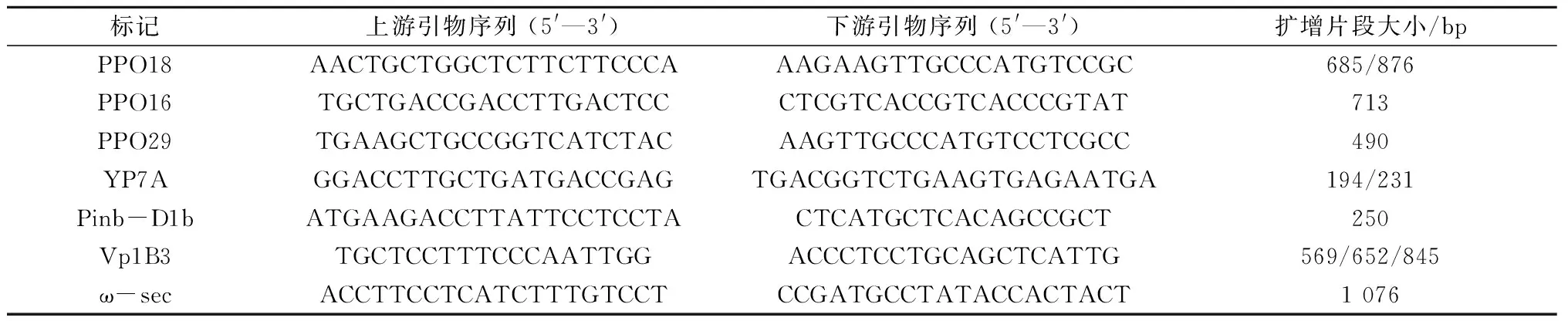
表1 1BL/1RS易位系小麦中鉴别品质相关基因型的引物
2 结果与分析
2.1PPO基因的等位变异分析
标记PPO18在Ppo-A1a和Ppo-A1b2种等位基因变异的小麦品种(系)中分别扩增出685 bp和876 bp 2种片段(图1-a)。标记PPO16和标记PPO29在检测Ppo-D1a和Ppo-D1b2种等位基因变异的小麦品种(系)中呈现互补关系,分别扩增出 713 bp和490 bp 2种片段(图1-b、图1-c),即这2个标记在品种检测中互补出现,可以相互验证。

M.DL2000 plus; 1.京冬10号; 2.陕354; 3.陕167; 4.临麦6号; 5.邯4304; 6.衡2001-6599; 7.莱州137; 8.原冬93; 9.冀麦36; 10.临8014; 11.临5090; 12.山农1455; 13.存麦1号; 14.衡05116; 15.冀9709; 16. 淮9876; 17.川育16号; 18.津强1号; 19.冀师02-1(非1BL/1RS易位系); 20.石4366(非1BL/1RS易位系); 21.ddH2O图1 利用分子标记PPO18(a)、PPO16(b)、PPO29(c)、Yp7A(d)、Pinb-D1b(e)、Vp1B3(f)、ω-sec(g)检测小麦ω-secalin和5个品质相关基因的等位变异
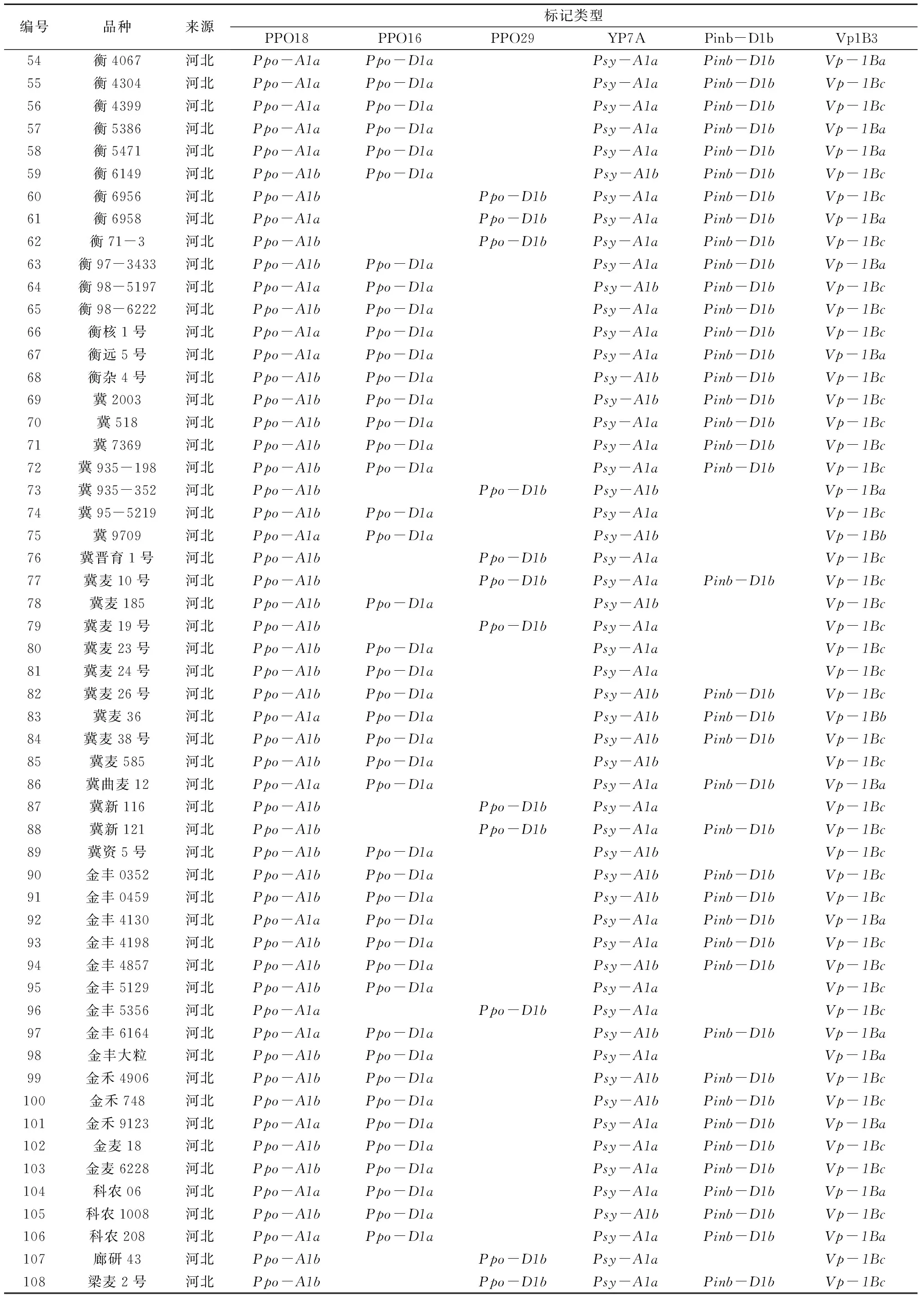
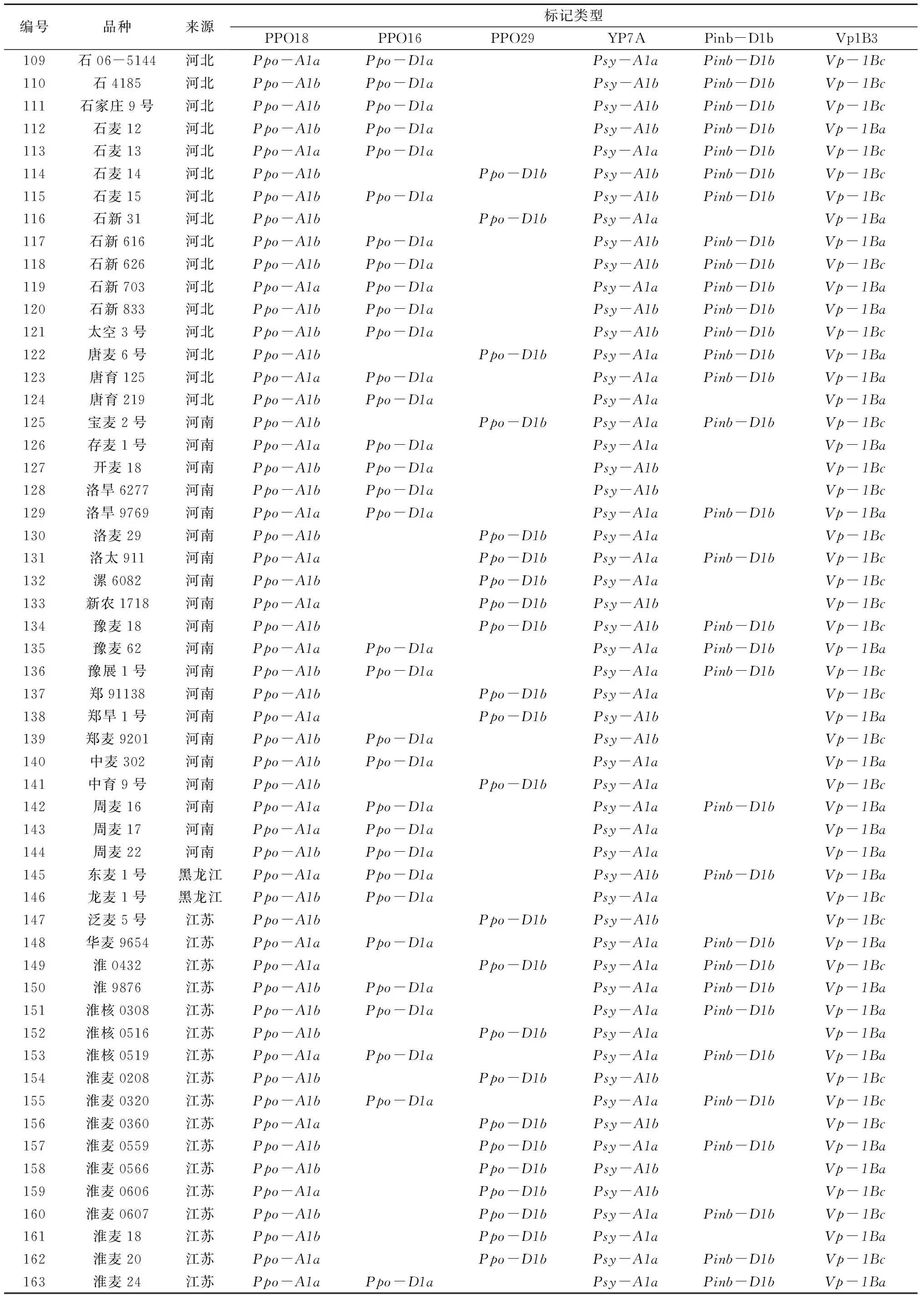
在258份1BL/1RS易位系小麦品种(系)中,Ppo-A1a和Ppo-A1b基因型分别为 100份 和158份,频率分别为 38.8%和 61.2%。Ppo-D1a和Ppo-D1b基因型分别为165份 和 93 份,各占64.0%和 36.0%。2个基因组合类型Ppo-A1a/Ppo-D1a、Ppo-A1a/Ppo-D1b、Ppo-A1b/Ppo-D1a和Ppo-A1b/Ppo-D1b分别为70份、30份、95份和63份,频率分别为 27.2%、11.6%、36.8%和24.4%(表2)。分子检测结果表明,低PPO活性基因型在1BL/1RS易位系小麦品种(系)分布频率较高,说明在低PPO活性小麦育种中亲本选择范围较广。
2.2Psy-A1基因的等位变异分析
标记YP7A在Psy-A1a和Psy-A1b2种等位基因变异的小麦品种(系)中分别扩增出194 bp和231 bp 2种片断(图1-d)。在258份1BL/1RS易位系小麦品种(系)中,Psy-A1a和Psy-A1b基因型分别为180份和78份,频率分别为69.8%和30.2%(表2)。在258份1BL/1RS易位系小麦品种(系)中,Psy-A1a基因型的高频率分布说明大部分1BL/1RS易位系小麦品种(系)黄色素含量较高,不符合馒头、面条等传统食品的白度要求,在利用1BL/1RS易位系小麦品种(系)育种时,应注意选用Psy-A1b基因型品种(系)配制杂交组合,以期降低籽粒黄色素含量,提高小麦品质。

表2 1BL/1RS易位系小麦品种(系)品质相关基因的等位变异
续表2 1BL/1RS易位系小麦品种(系)品质相关基因的等位变异
续表2 1BL/1RS易位系小麦品种(系)品质相关基因的等位变异

续表2 1BL/1RS易位系小麦品种(系)品质相关基因的等位变异

续表2 1BL/1RS易位系小麦品种(系)品质相关基因的等位变异
2.3Pinb基因的等位变异分析
Pinb等位变异有18种类型[3-8],在黄淮海麦区Pinb-D1b分布范围最广[23]。Giroux等[26]设计的STS引物在Pinb-D1b基因型的小麦品种(系)中扩增出250 bp的片断(图1-e)。在258 份1BL/1RS易位系小麦品种(系)中,Pinb-D1b基因型为157份,分布频率为60.9%(表2)。Pinb-D1b基因型在1BL/1RS易位系小麦品种(系)的高频率分布有利于其在小麦籽粒硬度育种中的应用。
2.4Vp-1基因的等位变异分析
标记Vp1B3在Vp-1Ba、Vp-1Bb和Vp-1Bc3种等位基因变异的小麦品种(系)中分别扩增出652 bp、845 bp和 569 bp 3种类型的片段(图1-f)。在258 份1BL/1RS易位系小麦品种(系)中,Vp-1Ba、Vp-1Bb和Vp-1Bc基因型分别为86份、8份和164份,频率分别为33.3%、3.1%和 63.6%(表2)。在258份1BL/1RS易位系小麦品种(系)中仅8份具有Vp-1Bb基因型,其在抗穗发芽小麦育种中的应用价值有待深入研究。
3 结论与讨论
PPO18、PPO16、PPO29、YP7A、Pinb-D1b、Vp1B3 6个STS标记检测结果表明,在258份1BL/1RS 易位系小麦品种(系)中,这些STS标记呈现不同的分布频率,每个小麦品种(系)具有优良基型的数量不同。因此,根据育种目标,选择具有特定基因型的1BL/1RS 易位系小麦品种(系)作亲本,利用该基因型的STS标记对后代进行选择,有利于充分发挥1BL/1RS 易位系小麦的育种价值。
籽粒PPO活性是影响面粉及其制品色泽稳定性的重要因素。掌握小麦品种(系)的PPO基因型,利用分子标记对后代进行选择可有效提高低PPO活性品种(系)的选育效率。在258份1BL/1RS 易位系小麦品种(系)中,具有最低PPO活性的基因型Ppo-A1b/Ppo-D1a分布频率较高(36.8%),来自河北省的118份1BL/1RS 易位系小麦品种(系)中该基因型达到了42.4%,这为面制品色泽的改良奠定了良好的基因型基础。
小麦籽粒黄色素含量对面条、馒头等食品的外观品质有重要影响。在258份1BL/1RS 易位系小麦品种(系)中,低黄色素基因型Psy-A1b所占比例仅为30.2%,该结果表明,在选用1BL/1RS 易位系小麦品种(系)配制杂交组合时,应注意选用具有Psy-A1b基因型的品种(系)。在258份1BL/1RS 易位系小麦品种(系)中,具有最低PPO活性和低黄色素含量的基因型Ppo-A1b/Ppo-D1a/Psy-A1b的分布频率为14.7%(38份)。选用这些1BL/1RS 易位系品种(系)配制杂交组合有助于提高育成品种面粉及其制品色泽稳定性和外观品质。
籽粒硬度是最为重要的小麦品质性状之一,Pinb-D1b、Pinb-D1d、Pinb-D1e、Pinb-D1g基因型小麦在磨粉、馒头、面条和面包加工品质中一项或多项略优于其他类型[10-12,28],其中Pinb-D1b基因型在黄淮海麦区分布最为广泛。在258 份1BL/1RS易位系小麦品种(系)中,Pinb-D1b基因型频率高达60.9%,这为将小麦籽粒硬度作为主要育种目标进行品质改良奠定了基因型基础。在258份1BL/1RS易位系小麦品种(系)中,基因型Ppo-A1b/Ppo-D1a/Psy-A1b/Pind-D1b的分布频率为10.5%(27份),其中22份为河北省品种(系)。这些1BL/1RS易位系小麦品种(系)可作为小麦品质育种重要的基因源,从而进一步挖掘1BL/1RS 易位系的育种价值。
Vp-1B是控制种子休眠性的一个主要基因。Vp-1Bb基因型品种具有高的穗发芽抗性,绝大部分Vp-1Bc基因型品种具有高的穗发芽抗性,而绝大部分Vp-1Ba基因型品种穗发芽敏感。本研究发现,原冬93、冀麦36、冀9709、衡2001-6599、衡05116、鲁原108、山农1455、津强1号8个1BL/1RS易位系小麦品种(系)属于Vp-1Bb基因型,这些品种(系)农艺性状良好,在抗穗发芽小麦育种中具有良好的应用前景。
[1] Singh N K,Shepherd K W,McIntosh R A.Linkage mapping of genes for resistance to leaf,stem and stripe rusts and ω-secalins on the short arm of 1R[J].Theoretical and Applied Genetics,1990,80(5):609-616.
[2] Villareal R L,Mujeeb-Kazi A,Rajaram S,etal.Associa-ted effects of chromosome 1B/1R translocation on agronomic traits in hexaploid wheat[J].Breeding Science,1994,44(1):7-11.
[3] Villareal R L,Rajaram S,Mujeeb-Kazi A,etal.The effect of chromosome 1B/1R translocation on the yield potential of certain spring wheat[J].Plant Breeding,1991,106(1):77-81.
[4] Carver B F,Rayburn A L.Comparison of related wheat stocks possessing 1B or 1RS.1BL chromosomes:Agronomic performance [J].Crop Science,1994,34(6):1505-1510.
[5] Moreno-Seville B,Baenziger P S,Peterson C J,etal.The 1B/1R translocation : Agronomic performance of F3-derived lines from a winter wheat cross[J].Crop Science,1995,35(4):1051-1055.
[6] Rabinovich S V.Importance of wheat-rye translocation for breeding modern cultivars ofTriticumaestivumL[J].Euphytica,1998,100(1):323-340.
[7] Wieser H,Kieffer R,Lelley T.The influence of 1B/1R chromosome translocation on gluten protein composition and technological properties of bread wheat[J].Journal of the Science of Food and Agriculture,2000,80(11):1640-1647.
[8] Graybosch R A.Uneasy unions: Quality effects of rye chromatin transfer to wheat[J].Journal of Cereal Scie-nce,2001,33(1):3-16.
[9] 周阳,何中虎,张改生,等.1BL/1RS易位系在中国小麦育种中的应用[J].作物学报,2004,30(6):531-535.
[10] 王晓军,冯国华,刘东涛,等.黄淮麦区部分小麦品种(系) 1BL /1RS 易位的分子检测[J].麦类作物学报,2008,28(3):381-386.
[11] Kruger J E,Hatcher D W,De Pauw R.A whole seed assay for polyphenol oxidase in Canadian prairie spring wheats and its usefulness as a measure of noodle darkening[J].Cereal Chemistry,1994,71(4):324-326.
[12] Morris C F,Jeffers H C,Engle D E.Effect of processing,formula and measurement variables on alkaline noodle color-toward an optimized laboratory system[J].Cereal Chemistry,2000,77(1):77-85.
[13] 葛秀秀,何中虎, 杨金,等.我国冬小麦品种多酚氧化酶活性的遗传变异及其与品质性状的相关分析[J].作物学报,2003,29(4):481-485.
[14] Jimenez M,Dubcovsky J.Chromosome location of genes affecting polyphenol oxidase activity in seeds of common and durum wheat[J].Plant Breeding,1999,118(5):395-398.
[15] Udall J.Important alleles for noodle quality in winter wheat as identified by molecular markers[D].Aberdeen:University of Idaho,1996.
[16] Demeke T,Morris C F,Campbell K G,etal.Wheat polyphenol oxidase:Distribution and genetic mapping in three inbred line populations[J].Crop Science,2001,41(6):1750-1757.
[17] Raman R,Raman H,Johnstone K,etal.Genetic and in silico comparative mapping of the polyphenol oxidase gene in bread wheat (TriticumaestivumL.)[J].Functional and Integrative Genomics,2005,5(4):185-200.
[18] 张立平,葛秀秀,何中虎,等.普通小麦籽粒多酚氧化酶活性的QTL分析[J].作物学报,2005,31(1):7-10.
[19] Sun D J,He Z H,Xia X C,etal.A novel STS marker for polyphenol oxidase activity in bread wheat[J].Molecular Breeding,2005,16(3):209-218.
[20] He X Y,He Z H,Zhang L P,etal.Allelic variation of polyphenol oxidase (PPO) genes located on chromosomes 2A and 2D and development of functional markers for the PPO genes in common wheat[J].Theoretical and Applied Genetics,2007,115(1):47-58.
[21] 朱长甫,陈星,王英典.植物类胡萝卜素生物合成及其相关基因在基因工程中的应用[J].植物生理与分子生物学报,2004,30(6):609-618.
[22] He X Y,Zhang Y L,He Z H,etal.Characterization of a phytoene synthase 1 gene (Psy1) located on common wheat chromosome 7A and development of a functional marker [J].Theoretical and Applied Genetics,2008,116(2):213-221.
[23] 张福彦,陈锋,董中东,等.黄淮麦区小麦新品系籽粒硬度相关基因分子鉴定及其对产量性状的影响[J].中国农业科学,2011,44(16):3289-3296.
[24] Martin J M,Frohberg R C,Morris C F,etal.Milling and bread baking traits assoiated with puroindoline sequence type in hard red spring wheat[J].Crop Science,2001,41(1):228-234.
[25] 陈锋,陈东升,钱森和,等.Puroindoline基因对春小麦磨粉及馒头、面条品质的影响 [J].作物学报,2006,32(7):980-986.
[26] Giroux M J,Morris C F.A glycine to serine change in puroindoline bis asssociated with wheat grain hardness and low levels of starch-surface friabilin[J].Theoretical and Applied Genetics,1997,95(5):857-864.
[27] Bailey P C,Mc Kibbin R S,Lenton J R.Genetic map location for orthologousVP1 genes in wheat and rice[J].Theoretical and Applied Genetics,1999,98(2):281-284.
[28] Mc Carty D R,Hattori T,Carson C B,etal. The Viviparous-1 developmental gene of maize encodes a novel transcriptional activator[J].Cell,1991,66(5):895-905.
[29] Mc Carty D R,Carson C B,Stinard P S,etal. Molecular analysis of VIVIPAROUS-1: An abscisic acid insensitive mutant of maize[J].Plant Cell,1989,1(5):523-532.
[30] Giraudat J,Hauge B M,Valon C,etal. Isolation of theArabidopsisABI3 gene by positional cloning[J].Plant Cell,1992,4(10):1251-1261.
[31] Yang Y,Zhao X L,Xia L Q,etal.Development and validation of a Viviparous-1 STS marker for pre-harvest sprouting resistance in Chinese wheats[J].Theoretical and Applied Genetics,2007,115(7):971-980.
[32] Chai J F,Liu X,Jia J Z.Homoeologous cloning of ω-secalin gene family in a wheat 1BL/1RS translocation [J].Cell Research,2005,15(8):658-664.
Analysis on Allelic Variation of Quality-related Gene in 1BL/1RS Translocation Wheat Cultivars
LI Mengjun,LI Yaqing,ZHANG Nan,SHI Zhanliang*
(Shijiazhuang Academy of Agriculture and Forestry Sciences/Wheat Engineering Research Center of Hebei Province,Shijiazhuang 050041,China)
In order to analyze utilization value of 1BL/1RS translocation in wheat quality breeding,the allelic distribution of five quality-related genotypes,Ppo-A,Ppo-D,Psy-A,Pinb-D1 andVp-1,in 258 1BL/1RS translocation wheat cultivars(lines)were detected using molecular makers of these genes.In 258 1BL/1RS translocation wheat cultivars(lines),the distribution frequency ofPpo-A1bandPpo-D1awere 58.2% and 64.0%.The allelic combination ofPpo-A1b/Ppo-D1aoccupied 36.8%.The results showed that 1BL/1RS translocation lines could be used in the low-PPO-activity wheat breeding.The frequency for the allele of low yellow pigment,Psy-A1b,was 30.2%.In low-yellow-pigment wheat breeding,1BL/1RS translocation lines should be selected carefully.The percentage ofPinb-D1ballele was 60.9%.In 258 1BL/1RS translocation wheat cultivars(lines),27 belonged to the allelic combination ofPpo-A1b/Ppo-D1a/Psy-A1b/Pind-D1b.The 27 cultivars were important in wheat quality breeding.The frequencies of ear sprouting related genesVp-1Ba,Vp-1Bb,andVp-1Bc,were 33.3%,3.1% and 63.6%.
wheat; 1BL/1RS translocation lines; quality-related gene; molecular marker
2015-11-05
河北省自然科学基金项目(C2014106075);国家转基因重大专项(2011ZX08002-005);国家科技支撑计划项目(2011BAD35B03)
李孟军(1972-),男,河北玉田人,副研究员,博士,主要从事作物分子生物学研究。 E-mail:lmj199612@aliyun.com
*通讯作者:史占良(1962-),男,河北新乐人,研究员,主要从事小麦遗传育种研究。E-mail:shizhanl@163.com
S512.1
A
1004-3268(2016)03-0024-10

