鹅毛竹叶酪氨酸酶抑制物提取工艺优化及活性评价
刘萌萌,徐志丰,鲁莹莹,张有做,王 姝,倪勤学
(浙江农林大学,浙江 临安 311300)
鹅毛竹叶酪氨酸酶抑制物提取工艺优化及活性评价
刘萌萌,徐志丰,鲁莹莹,张有做,王 姝,倪勤学
(浙江农林大学,浙江 临安 311300)
该试验研究鹅毛竹叶酪氨酸酶抑制物的最佳提取工艺及其竹叶特征性成分的含量及活性。采用响应面法优化鹅毛竹叶酪氨酸酶抑制物的提取工艺,在此基础上利用分极法制备酪氨酸酶抑制活性部位(SAE),并采用HPLC法定量分析其中绿原酸、咖啡酸、异荭草苷、荭草苷、对香豆酸、牡荆苷、异牡荆苷、山奈酚和苜蓿素9个竹叶特征性成分;通过DPPH法、ABTS法、FRAP法和酪氨酸酶催化氧化左旋多巴速率法评价SAE及竹叶特征性成分的抗氧化和酪氨酸酶抑制能力。结果显示:鹅毛竹叶酪氨酸酶抑制物的最优工艺参数为乙醇浓度70%,料液比1:16,提取温度80益,提取时间1h。以此提取物为原料制备的SAE对酪氨酸酶的抑制IC50为658.46μg/mL,含有绿原酸(0.4285mg/g)、咖啡酸(0.0463mg/g)、异荭草苷(0.2999mg/g)、对香豆酸(0.4593mg/g)、山奈酚(1.7152mg/g)及苜蓿素(2.5513mg/g)6种竹叶特征性成分。其中咖啡酸的抑制酪氨酸酶活性最强,显著高于阳性对照熊果苷,推测为鹅毛竹叶抑制酪氨酸酶的主要活性成分之一。表明鹅毛竹叶是一种来源丰富的酪氨酸酶抑制原料,具有进一步研究和开发的意义。
鹅毛竹叶;响应面;竹叶特征性成分;酪氨酸酶抑制;抗氧化
酪氨酸酶广泛存在于生物体内,是一种催化黑色素合成的关键限速酶[1],与生物体的许多重要生理过程密切相关,其活性的过量异常表达既可以导致人体色素沉着性疾病的产生,也是引起果蔬褐变的主要原因[2]。因此,抑制酪氨酸酶活性的研究,一直是调控生物体黑色素生成的重点。由于近年来人们对“回归大自然”和“组分天然化”的呼声越来越高,所以寻求高效、安全的纯天然酪氨酸酶抑制剂有着十分重要的意义。
竹子属于禾本科竹亚科,具有生长快、产量高、用途广泛、适应性强等特点,是非常有研究价值的分类群之一。竹叶里含有丰富的次生代谢物,具有抗病毒、抗氧化、抗衰老、提高免疫力和防治老年退行性疾病等作用[3]。竹叶提取物中的特征性成分主要是以绿原酸、咖啡酸、对香豆酸和阿魏酸为代表的植物酚酸和以牡荆苷、异牡荆苷、荭草苷、异荭草苷和苜蓿素为代表的黄酮类[4]。我国的竹叶资源是量大而廉价的林业潜在资源,但经化学成分分析的竹种数量仅占我国竹种总数的4%左右[5],且主要集中在杆型高大的刚竹属竹种。而地被竹种杆型矮小,叶生物量大,叶子密集,便于机械化采摘,具有开发成叶用竹林的潜在优势。课题组前期研究比较了6种地被竹叶的有效成分含量、抗氧化和酪氨酸酶抑制活性,发现倭竹属鹅毛竹(Shibataea chinen-sis Nakai)显著优于其他竹种[6],进一步研究发现鹅毛竹叶醇提物的乙酸乙酯相总酚、总黄酮、三萜含量及抗氧化能力和酪氨酸酶抑制活性显著高于其他分极相[7],推测为鹅毛竹叶的主要酪氨酸酶抑制活性部位(SAE)。
本研究在前期工作的基础上,以提取物对酪氨酸酶的抑制效应为响应值,用响应面法优化鹅毛竹叶酪氨酸酶抑制物的回流提取工艺,进一步用乙酸乙酯富集活性物质,得到鹅毛竹叶酪氨酸酶抑制活性部位(SAE)。利用HPLC外标法分析活性部位的9种竹叶特征性成分含量,并对其特征性成分进行抗氧化和酪氨酸酶抑制能力的评价。以期为天然酪氨酸酶抑制剂的研究开发和鹅毛竹叶在食品、保健品、医药和化妆品等领域的应用提供理论参考。
1 材料与方法
1.1 材料与试剂
鹅毛竹叶于2012年8月采自浙江省临安市浙江农林大学的翠竹园。
主要试剂:蘑菇酪氨酸酶、DPPH(2,2,-二苯基-1-苦味酰苯肼)、ABTS+、绿原酸、咖啡酸、异荭草苷、荭草苷、对香豆酸、牡荆苷、异牡荆苷、山奈酚、苜蓿素购自Sigma公司,纯度均大于98%;L-DOPA购自阿拉丁公司,纯度>99%;乙腈、甲醇、冰乙酸为色谱纯;石油醚、乙酸乙酯、磷酸二氢钠、磷酸氢二钠为分析纯;实验用水为去离子水。
1.2 仪器设备
QEY-1000型粉碎机(浙江屹立工贸有限公司);RE-52A型旋转蒸发仪(上海亚荣生化仪器厂);DGG-9053AD型鼓风干燥箱(上海森信实验仪器有限公司);UV-1800型紫外分光光度计(上海岛津有限公司);SevenEasy型pH计(梅特勒-托利多仪器有限公司);A60159型精密电子天平(瑞士METTLERTOLEDO公司);LC20AT高效液相色谱仪(上海岛津有限公司);MultiSkan FC酶标仪(Thermo Scientific公司)。
1.3 竹叶酪氨酸酶抑制物的提取工艺优化试验
样品前处理:采集新鲜的鹅毛竹叶,清洗,沥干,立即用WD800G微波炉加热(间隙加热3次,每次1min)。叶样放于60℃烘箱中干燥,粉碎,过40目筛,备用。
工艺流程:精密称取鹅毛竹叶粉末5.00g寅在一定条件下回流提取3次寅趁热过滤寅少量提取溶剂洗渣寅定容至一定浓度。
设置其他条件一致的基础上,分别研究乙醇浓度(30%、40%、50%、60%、70%、80%、90%)、料液比(1:5、1:10、1:15、1:20、1:25、1:30)、提取温度(50、60、70、80、90℃)、提取时间(10、30、60、90、120、150min)4个因素下竹叶提取物对酪氨酸酶活性抑制能力的影响。
根据单因素实验结果,采用Box-Behnken试验设计原理,选择对酪氨酸酶活性抑制影响较大的因素乙醇浓度(X1)、料液比(X2)和温度(X3)进行考察,因素水平编码见表1。确定浸提时间为1h,以对酪氨酸酶活性的抑制率为响应值,利用Design-Ex-pert.V8.0软件优化鹅毛竹叶酪氨酸酶抑制物的最佳提取条件。
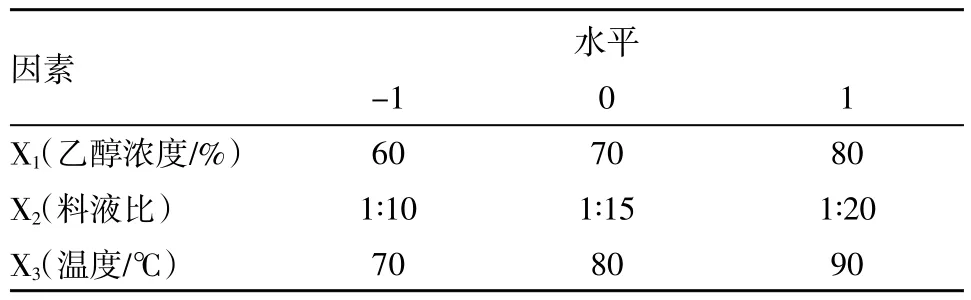
表1 Box-Behnken设计实验因素水平编码
为进一步考察上述优选工艺的稳定性,以优化的工艺条件提取竹叶酪氨酸酶抑制物,测定其酪氨酸酶抑制活性。
1.4 鹅毛竹叶酪氨酸酶抑制活性部位(SAE)的制备
根据课题组前期实验结果,称取5.00g鹅毛竹叶粉末,按照最佳提取条件提取,浸膏用一定体积的蒸馏水充分混悬,加入适量石油醚除去弱极性物质,以1:1的溶剂量用乙酸乙酯萃取3次,取乙酸乙酯萃取物旋转蒸发,浓缩干燥至恒重,得到SAE。
1.5 HPLC法测定有效成分的含量
1.5.1 色谱条件
[8]的方法并加以改进:色谱柱为Agi-lent TC-C18柱(4.6mm×250mm,5μm);流动相A为1%冰乙酸、B为乙腈;梯度洗脱,0~10min,17%B;10~15min,17%~23%B;15~35min,23%B;35~ 40min,23%~40%B;40~50min,40%B;50~52min,40%~17%B;52~60min,17%B;体积流量为0.8mL/min;检测波长为330nm;柱温为40℃;进样量10μL。
1.5.2 标准曲线的制作
精密称取绿原酸、咖啡酸、对香豆酸、异荭草苷、荭草苷、牡荆苷、异牡荆苷、山奈酚和苜蓿素标准品各2.50mg,用甲醇溶解并定容至5mL容量瓶中,摇匀,分别量取上述溶液各100μL混合摇匀,得到每个标准品浓度均为62.5μg/mL的混合标准品溶液。用甲醇稀释成6个不同浓度的混合标准品溶液(各标准品浓度为31.25、20.83、15.63、12.5、10.42μg/mL)。将上述溶液分别进样10μL,记录各个标准品峰面积。以绿原酸、咖啡酸、对香豆酸、异荭草苷、荭草苷、牡荆苷、异牡荆苷、山奈酚和苜蓿素的量为横坐标(X),峰面积为纵坐标(Y),进行线性回归。
1.5.3 分析方法学考察
精密度试验:混合标准品溶液以10μL的进样量,连续进样5次,测定峰面积,分别计算各对照品峰面积的RSD。
稳定性试验:精密吸取待测液10μL,分别于0、2、4、6、8h进样测定,计算各对照品峰面积的RSD。
1.5.4 样品的测定
各样品用50%甲醇配制成一定浓度,过0.45μm微孔滤膜后进样测定,按标准曲线计算含量。
1.6 DPPH自由基清除实验
参考文献[9]并加以改进,准确称取0.01g DPPH试剂,用甲醇定容后得0.10mmol/L DPPH溶液。分别取0.1mL待测样品溶液和3.9mL DPPH溶液混合均匀,室温下反应1h,于517nm波长下测定A值。以甲醇为空白对照,计算各样品抑制率。

以待测样品浓度为横坐标(X),抑制率为纵坐标(Y)得待测样品清除DPPH自由基的曲线。根据回归方程,计算得到待测样品清除DPPH自由基的半抑制浓度(IC50)。Vc为阳性对照。
1.7 ABTS+自由基清除实验
取浓度为140mmol/L的过硫酸钾水溶液176uL加入到10mL浓度为3.84mg/mL的ABTS+溶液中,混合均匀,避光反应12~15h后加入无水乙醇将ABTS+溶液稀释到在734nm波长处吸光值为0.700依0.02。用无水乙醇调零分光光度计。将0.1mL的待测液与3.9mL的ABTS+溶液混合摇匀,室温下反应6min,在734nm波长下测定吸光值(A样品)。用样品溶解剂代替样品测定吸光度值A空白。

以待测样品浓度为横坐标(X),抑制率为纵坐标(Y)得待测样品清除ABTS+自由基的曲线。根据回归方程计算得到待测样品的半抑制浓度(IC50)。Vc为阳性对照。
1.8 FRAP法分析铁离子还原能力
参照文献[10]方法,把样品配制成0.1mg/mL,各取0.3mL加入2.7mL工作液(0.3mol/L醋酸盐缓冲液25mL,20mmol/LFeCl3溶液2.5mL,10mmol/L TPTZ溶液2.5mL,),混匀后于37℃条件下反应10min,在593nm处测定A值。用样品溶解剂做空白对照。
准确称取6.08mg硫酸亚铁溶于适量水中,加入0.25mL硫酸溶液(18mol/L),用水稀释至50mL,得0.8mmol/L的硫酸亚铁溶液,置入小铁钉。依次配制25、50、100、200、400μmol/L标准溶液,以硫酸亚铁浓度为横坐标(X),A值为纵坐标(Y)绘制标准曲线,得回归方程:Y=0.0018X+0.0019(R2=0.9996)。
把样品反应后的吸光度值在标准曲线上获得的相应硫酸亚铁浓度(μmol/L)定义为FRAP值。Vc为阳性对照。
1.9 酪氨酸酶抑制活性的测定
1.9.1 酶活力的测定
底物L-DOPA经酪氨酸酶催化后产生多巴醌,多巴醌经过氧化生成黑色素,黑色素在475nm波长处有最大吸收峰。酶活力单位(U):反应液每分钟在475nm波长处的吸光度(OD475)增加0.001为1个酶活力单位。具体方法:在pH6.8的磷酸缓冲液中,以5mmol/L的L-DOPA为底物,37℃下测定波长为475nm的光密度值(OD475)随时间的增长直线,从斜率计算酶的活力,产物的消光系数按3700L/(mol·cm)计算[11]。
1.9.2 对酪氨酸酶抑制能力的测定
参考文献[12]的方法加以改进:配制不同浓度的样品溶液,以5mmol/L的L-DOPA为底物,反应总体系为200μL,准确吸取1、2、3、4组反应液(表2),充分混合后于37℃水浴30min,用酶标仪在475nm处测定吸光度A,按以下公式计算抑制率。

A1:指只含有底物、酪氨酸酶的测活体系的吸光度值;
A2:指只含有底物的测活体系的吸光度值;
A3:指含有底物、酪氨酸酶、抑制物的测活体系的吸光度值;
A4:指只含有底物、抑制物的测活体系的吸光度值。
以样品浓度为横坐标,抑制率为纵坐标,绘制曲线,求出各样品抑制酪氨酸酶的IC50值。熊果苷为阳性对照。
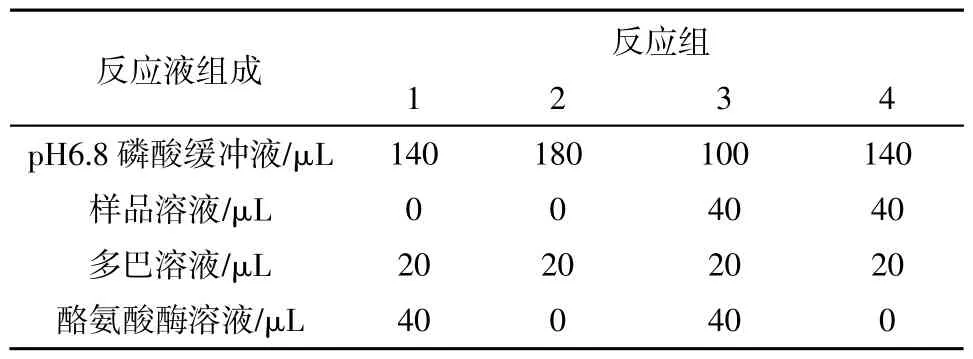
表2 反应液组成
1.10 数据处理
结果采用SPSS17.0统计软件进行数据处理,数据以X+s表示。
2 结果与分析
2.1 鹅毛竹叶酪氨酸酶抑制物提取工艺的响应面优化结果
2.1.1 响应面实验设计及结果分析
在单因素试验的基础上,采用BOX-Behnken中心组和设计原理,利用Design-Expert.V8.0软件进行实验设计及数据分析,实验结果见表3,方差分析见表4。

表3 Box-Behnken实验设计及结果
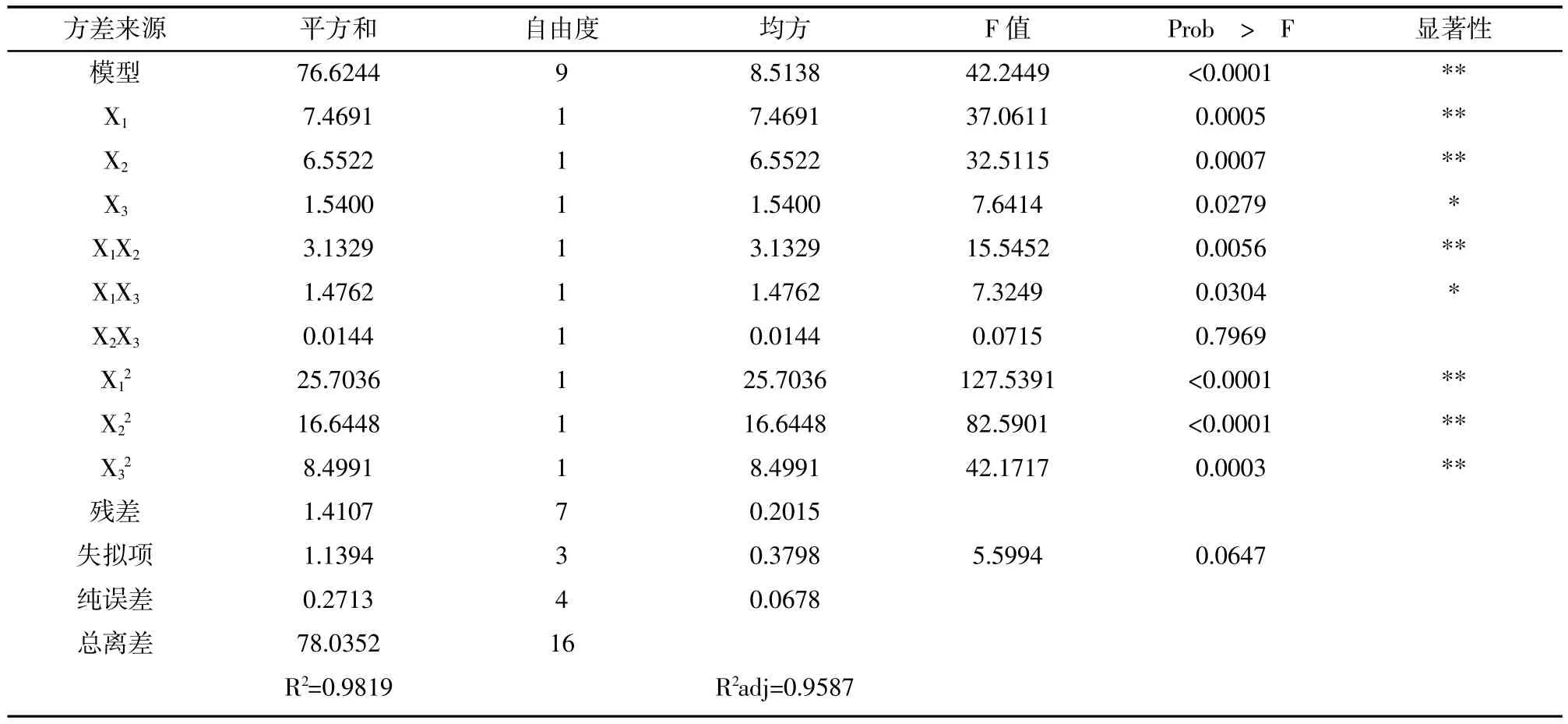
表4 响应面二次模型方差分析
由表3响应面分析得到酪氨酸酶抑制率与各因素的二次拟合回归方程:酪氨酸酶抑制率(Y)=
由表4可知:模型p<0.0001表明模型极显著,失拟项p=0.0647>0.05,在琢=0.05水平上不显著,说明未知因素对实验结果的干扰较小,实验误差主要来源于随机误差。模型的确定系数R2越0.9819,调整系数R2adj=0.9587,说明模型能解释95.87%响应值变化,因而拟合度好,可以用此模型对鹅毛竹叶酪氨酸酶抑制物的提取工艺进行分析和预测。对模型进行回归方程系数显著性检验可知,一次项X1乙醇浓度和X2料液比极显著(p约0.01),X3温度显著(p约0.05);交互项X1X2极显著(p约0.01),X1X3显著(p约0.05),X2X3不显著(p>0.05);平方项均极显著(p约0.01)。因此,各个因素对酪氨酸酶抑制活性的影响不是简单的线性关系。
通过模型优化得出鹅毛竹叶酪氨酸酶抑制物最优提取条件为:乙醇浓度71.45%,料液比1:15.99,提取温度81.28℃,提取时间为1h,此时酪氨酸酶的抑制率达到最大值46.78%。
2.1.2 响应面和等高线图分析
由方差分析可知:各因素之间有较强交互作用,根据回归方程,作出各因素之间交互作用的响应面和等高线图见图1。如图1所示,每个图均有极值点,证明回归方程模型可靠,且乙醇浓度(X1)、料液比(X2)及提取温度(X3)对酪氨酸酶抑制率的影响显著;乙醇浓度与料液比之间的等高线明显呈椭圆形,说明两者之间交互作用非常显著;乙醇浓度与提取温度之间的交互作用显著。
2.1.3 验证实验

图1 各因素之间的交互作用
为检验响应面法所得结果的准确性,采用上述优化条件进行鹅毛竹叶酪氨酸酶抑制物的制备,考虑到实际操作的局限性,为了节省时间,节约成本,将提取工艺参数修正为:乙醇浓度70%,料液比为1:16,提取温度为80℃,提取时间为1h,测得的酪氨酸酶抑制率为45.35%,与理论预测值基本相符。表明采用该模型优化的工艺参数具有可行性。
2.2 SAE的竹叶特征性成分分析
以绿原酸、咖啡酸、异荭草苷、荭草苷、对香豆酸、牡荆苷、异牡荆苷、山奈酚和苜蓿素的量对应峰面积的线性回归方程及线性范围见表5。
SAE用50%甲醇溶解,取10μL样液滤过后注入HPLC色谱仪分析测定,外标法计算绿原酸、咖啡酸、异荭草苷、荭草苷、异牡荆苷、对香豆酸、牡荆苷、山奈酚和苜蓿素的量。各成分占SAE的含量见表5,相应HPLC谱图见图2。由表5可知:SAE中含有绿原酸、咖啡酸、异荭草苷、对香豆酸、山奈酚和苜蓿素6种竹叶特征性成分,荭草苷、牡荆苷、异牡荆苷未检测到。其中苜蓿素和山奈酚含量较高。

表5 竹叶特征性成分分析方法学考察结果及在SAE的含量(n=5)

图2 混合对照品(A)、SAE(B)的HPLC色谱图
2.3 SAE及其特征性成分抗氧化活性
对SAE及其6个特征性成分的抗氧化性能进行了DPPH、ABTS+和亚铁离子还原力3个体系的测定。由表6可知:SAE具有较强的自由基清除能力和亚铁离子还原力。对香豆酸和苜蓿素的DPPH自由基清除能力较弱,其他几个单体Vc>绿原酸>咖啡酸>山奈酚>异荭草苷,均显著高于SAE(p<0.05)。山奈酚的ABTS+自由基清除能力较弱,其他单体对香豆酸>绿原酸>Vc>苜蓿素、咖啡酸>异荭草苷。亚铁离子还原力绿原酸>Vc>山奈酚>咖啡酸>异荭草苷、苜蓿素。总体上,特征性单体成分的抗氧化活性强于SAE。
2.4 SAE及其特征性成分酪氨酸酶抑制能力
以L-多巴为底物,SAE及其特征性成分酪氨酸酶抑制能力的试验结果见表6。由表6可知:SAE的酪氨酸酶抑制能力弱于咖啡酸,但显著高于其他几种单体(p<0.05)。说明粗提物中化合物之间存在着酪氨酸酶抑制的相互协同作用,以粗提物的形式存在对酪氨酸酶抑制性能更强。

表6 SAE及其特征性成分的抗氧化及酪氨酸酶抑制活性(n=3)
3 讨论
竹子含有丰富的次生代谢物,是我国重要的森林资源。以竹叶提取物为主要功能成分的一些保健品已在人类的健康事业中发挥了重要作用。地被竹因其植株矮小,萌发快,生长周期短,竹叶面积大等特点,为开发新竹叶资源铺开了新的道路。鹅毛竹是地被竹中有效成分含量较高的竹种,采用响应面法优化的提取工艺,再利用分极法制备的酪氨酸酶抑制活性部位(SAE)具有较强的抗氧化性能力和酪氨酸酶抑制性能力(IC50为658.46μg/mL)。进一步的HPLC外标法试验,表明SAE含有绿原酸、咖啡酸、异荭草苷、对香豆酸、山奈酚和苜蓿素6种竹叶特征性成分。其中咖啡酸的酪氨酸酶抑制活性最强,显著高于阳性对照熊果苷,推测为鹅毛竹叶抑制酪氨酸酶的主要活性成分之一。另外,鹅毛竹叶SAE中含有许多未知成分,有待进一步的分离,并对其结构和功能进行鉴定和检测,以期获得新物质和新的酪氨酸酶抑制剂,为丰富我国的竹叶资源和竹叶活性成分在保健品、医药和化妆品领域的应用提供依据。
参考文献
[1]Ismaya W T,Rozeboom H J,Weijn A,et al.Crystal structure of Agaricus bisporus mushroom tyrosinase:iden-tityofthetetramersubunitsandinteractionwith tropolone[J].Biochemistry,2011,50(24):5477-5486.
[2]Sehgal V N,Verma P,Srivastava G,et al.Melasma: treatment strategy[J].J Cosmet Laser Ther,2011,13(6):265-279.
[3]MantawyEM,El-BaklyWM,EsmatA,etal. Chrysin alleviates acute doxorubicin cardiotoxicity in rats viasuppression of oxidative stress,inflammationand apoptosis[J].Eur J Pharmacol,2014,728:107-118.
[4]龚金炎,吴晓琴,夏道宗,等.RP-HPLC法测定竹叶提取物中黄酮类和酚酸类成分[J].中草药,2010,41(1):63-65.
[5]赖忻,陈其兵.竹叶提取物的化学成分及其生理功能研究进展[J].福建林业科技,2013,40(1):214-220.
[6]倪勤学,刘颖坤,龚凌霄,等.6种地被竹叶有效成分及其抗氧化活性研究[J].中草药,2011,42(11):2317-2321.
[7]张蕾,王姝,倪勤学,等.鹅毛竹叶提取物抗氧化及酪氨酸酶抑制活性的研究[J].浙江林业科技,2014,34(5):8-15.
[8]李喜凤,师绘敏,陈随清.HPLC同时测定蒲公英中咖啡酸和绿原酸的含量[J].中成药,2008,30(10):1553-1556.
[9]Wu H W,Jing F,Tang L Y,et al.Quality evaluation of astragali radix based on DPPH radical scavenging activ-ity and chemical analysis[J].Chin Herb Medic,2014,6(4):282-289.
[10]赵琳静,王斌,乔妍,等.香茅叶挥发油的化学成分及其体外抗氧化活性[J].中成药,2016,38(4)841-845.
[11]刘艳杰,王倩,姜民,等.基于谱效一构效关系筛选大黄中酪氨酸酶活性抑制成分的方法研究[J].中草药,2012,43(11)2120-2126.
[12]Han P,Chen C Q,Zhang C L,et al.Inhibitory ef-fects of 4-chlorosalicylic acid on mushroom tyrosinase and its antimicrobial activities[J].Food Chem,2008,107(2):797-803.
Optimized Extraction Ttechnology of Tyrosinase Inhibitor From Leaves of Shibataea chinensis Nakai and Its Activities Evaluation
LIU Meng-meng,XU Zhi-feng,LU Ying-ying,ZHANG You-zuo,WANG Shu,NI Qin-xue
(Zhejiang A&F University,Lin'an,Zhejiang 311300)
To optimize the extraction technology of tyrosinase inhibitor from Shibataea chinensis Nakai and investigate the ef-fective components and their antioxidant and tyrosinase inhibition ability.According to the results of single factor test,the ty-rosinase inhibitor extraction from leaves of S.chinensis Nakai was optimized using response surface methodology.The S.chi-nensis Nakai active extract(SAE)was further prepared by polarization.Nine characteristic compounds(chlorogenic acid,caffeic acid,iso-orientin,Orientoside,p-coumaric acid,Vitexin,isovitexin,kaempferol and tricin)were quantitatively ana-lyzed by HPLC synchronously.The anti oxidative active of SAE and its characteristic components were assessed by DPPH,ABTS and FRAP assay.Tyrosinase inhibit ability was also estimated.The optimal technological parameters were ethanol con-centration 70%,solid-liquid ratio 1:16,extraction temperature of 80℃,extraction time of 1 h.The SAE showed an excel-lent tyrosinase inhibit ability(IC50658.46μg/mL),which contained six characteristic compounds,i.e.chlorogenic acid(0.4285mg/g),caffeicacid(0.0463mg/g),iso-orientin(0.2999mg/g),p-coumaricacid(0.4593mg/g),kaempferol(1.7152mg/g)and tricin(2.5513mg/g).Caffeic acid showed stronger tyrosinase inhibit ability then others(p<0.05),which was speculated one of the main active ingredient of leaves of S.chinensis Nakai.Leaves from S.chinensis Nakai are a rich source of tyrosinase inhibitor,that worth further research and development.
Shibataea chinensis Nakai leaves;Response surface;Characteristic components;Tyrosinase inhibition;Antioxidant
S795
A
1002-3356(2016)04-0006-07
2016-08-11
国家自然科学基金(31401497)
刘萌萌(1989-),女,硕士,研究方向为天然产物化学研究及功能性食品研发。E-mail:1035163724@qq.com.
倪勤学(1983-),女,硕士生导师,副教授,研究方向为天然产物化学研究及功能性食品研发。E-mail:niqinxue@zafu. edu.cn.

