抗白色念珠菌的海洋微生物的分离与鉴定
张静楠+聂灿玉+赵胜楠+潘登+吴达+权春善+金黎明


摘 要:本文旨在从海洋沉积物样品中分离筛选出具有抗白色念珠菌特性的细菌菌株。通过涂布平板法分离出112株菌株,通过初筛得到6株对白色念珠菌有拮抗作用的菌株,经琼脂扩散法培养复筛,最终得到1株拮抗效果最好的菌株,命名为NB04-N1,其抑菌圈直径为(30.13±0.45) mm。16S rDNA测序鉴定结果证明该菌株为绿脓杆菌(Pseudomonas)。
关键词:海洋微生物;白色念珠菌;16S rDNA鉴定
中图分类号:Q938.8 文献标识码:A DOI 编码:10.3969/j.issn.1006-6500.2016.01.017
Isolation and Identification of Marine Microorganisms against Candida albicans
ZHANG Jingnan, NIE Canyu, ZHAO Shengnan, PAN Deng, WU Da, QUAN Chunshan, JIN Liming
(College of Life Science, Dalian Nationalities University, Dalian, Liaoning 116600, China)
Abstract: The objective of this study was to isolate marine microorganisms against Candida albicans from marine mud samples. 112 kinds of marine strains were separated by the method of coated plate method. A total of 6 strains were separated against Candida albicans by primary screening. 1 strain was screened after agar well diffusion method, named NB04-N1. The inhibition zone diameter was (30.13±0.45) mm. Finally, it was identified by 16S rDNA identification. The result showed that NB04-N1 belonged to Pseudomonas.
Key words: marine microorganisms; Candida albicans; 16S rDNA identification
白色念珠菌(Canidia albicans)又称白假丝酵母菌,是一种真菌,广泛存在于自然界,也存在于正常人体皮肤、口腔,上呼吸道,肠道及阴道中。它是条件致病性真菌,当机体免疫功能下降或正常菌群相互制约作用失调,白色念珠菌就会大量繁殖并改变生长形式(芽生菌丝相)侵入细胞,引起浅表性或深部的念珠菌感染,甚至引起系统性感染危及生命[1-2]。近年来,随着临床广谱抗生素、免疫抑制剂、皮质类固醇激素及抗癌药物的使用,导致医院内条件致病性白色念珠菌感染日渐增多。与此同时,随着抗真菌药物的广泛和长期应用,导致耐药菌株大量出现,给临床治疗带来更大的困难[2-3]。
目前筛选白色念珠菌拮抗菌株的来源主要有土壤、海洋两个途径。随着人们对于陆生生物的长期研究,发现从陆生生物代谢产物中发现新菌种、新抗生素的几率越来越小。而海洋微生物由于生活环境与陆生微生物相比较为特殊,可能产生有别于陆生微生物的次生代谢产物,因此成为近年来研究的热点[4-7]。
本试验从中国第6次北极考察海洋沉积物样品中筛选能够较好地抑制白色念珠菌的海洋微生物,并对其进行鉴定,为下一步研究其抗菌物质活性,寻找可能的新的抗菌药物打下基础。
1 材料和方法
1.1. 材 料
1.1.1 试验材料 泥样为中国第6次北极考察沉积物样品,具体信息见表1。
白色念珠菌,购自中国微生物菌种网。
1.1.2 试剂与培养基 PCR试剂,购自大连宝生物公司。葡萄糖、琼脂、胰化蛋白胨、酵母浸粉,购自奥博星生物技术公司。氯化钠,乙醇,氢氧化钾等均为分析纯,购自科密欧化学试剂公司。
通用培养基:酵母膏1 g,蛋白胨2 g,葡萄糖10 g,琼脂15~20 g,60%海水1 000 mL,pH值 7~7.5。
GPA培养基:葡萄糖40 g,蛋白胨10 g,琼脂20 g,蒸馏水1 L,pH 值4~6。
1.1.3 仪器与设备 MT180B-生化恒温培养箱(新苗医疗器械制造公司);JA12002型-电子天平(精密科学仪器公司);超纯水装置(法国MILLIPORE);LX-100-手掌型离心机(其林贝尔仪器制造公司);MLS-3020-湿热高压灭菌器(日本SANYO);HWY111-恒温培养振荡器(智诚分析仪器制造公司);SW-OJ-2FD-洁净工作台(安泰安气技术公司)。
1.2 试验方法
1.2.1 微生物的分离 采用涂布平板法分离菌株[8]。取海泥样品0.5 g于试管中,加入4.5 mL 60%的海水,混匀,静置2 h,取0.5 mL加入4.5 mL海水中,按梯度依次稀释,做成7个不同的稀释浓度,10-7至10-4稀释浓度各取样50 μL滴在平板培养基中间位置,用玻璃棒涂布。将上述接种完的培养皿,放在28 ℃培养箱中培养1~2 d,用接种针挑取形态不同的细菌单菌落,在28 ℃培养箱中培养2~3 d。endprint
1.2.2 微生物的纯化 采用平板划线法纯化菌株。用记号笔将分离实验平板中待划线纯化的菌落编号,并相应地在划线纯化的平板上标明菌株编号。挑取菌落接种到培养基上,28 ℃培养箱中培养,得到纯化的菌株。
1.2.3 初筛 用微波炉加热融化灭过菌的50 mL GPA培养基,放置于50 ℃的电热恒温鼓风干燥箱中保温,待温度降到50 ℃左右时,将白色念珠菌发酵液用移液枪吸取100 μL,接入装有50 mLGPA培养基的三角瓶中轻轻晃动摇匀,迅速倒入平皿中,开盖放置待冷却凝固。用挑菌针将上述分离出的菌株挑取一块放到注有白色念珠菌的GPA培养基中,然后置于28 ℃的恒温培养箱内进行培养,观察是否有抑菌圈。
1.2.4 复筛 将初筛获得的具有拮抗作用的菌株接种到100 mL液体培养基中,28 ℃摇床培养(180 r·min-1) 3~4 d,发酵液8 000 r·min-1、4 ℃条件下离心10 min,取上清蒸浓缩,将5 mL浓缩液经0.22 μm无菌微孔滤膜过滤得到粗发酵液。
采用琼脂扩散法测定发酵液对白色念珠菌的抑菌活性。将白色念珠菌以0.1%的接种量加入GPA培养基中,平板凝固后打孔,将400 μL粗发酵液加入孔中,37 °C培养24 h后测量抑菌圈的直径。重复3次[9]。
1.2.5 菌株的鉴定 (1)形态鉴定。参考《伯杰细菌鉴定手册》,主要观察菌落在其适合的培养基上的生长状况:细菌在固体培养基上的生长形态、颜色是否均匀一致,菌落个体表面及边缘的生长状况;在液体培养基上的浑浊状况、沉淀状况、液面菌膜状况;半固体上穿刺接种后,观察细菌是否沿着接种线生长以及其生长状态是呈毛刷样生长还是均匀生长,上下生长是否一致[10]。(2)16S rDNA鉴定。将所得的菌株16S rDNA PCR扩增产物送至大连宝生物公司测序,测得序列后,利用Blast软件把所测的16S rDNA序列与GenBank数据库中所有已测定的原核生物16S rDNA序列进行比较,确定菌株的种类。
2 结果与分析
2.1 菌株的分离结果
从3份样品中共筛得112个菌落。
2.2 对峙培养初筛结果
经对峙培养,筛选出6株对白色念珠菌有抑制性的菌株。
2.3 细菌发酵液的抗菌活性测定结果
对6株菌株发酵液进行复筛,得到1株抑菌圈最大,即抑制效果最佳的菌株,命名为NB04-N1,其抑菌圈的直径为(30.13±0.45) mm,见表2和图1。
2.4 菌株的鉴定结果
2.4.1 形态鉴定结果 菌株NB04-N1的菌体有长丝状形态,有褶皱,颜色呈黄绿色。在平板上显示的形态为微隆起,边缘整齐波状的中等大菌落。
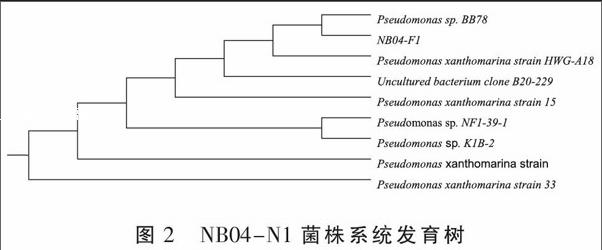
2.4.2 菌株系统发育树的构建 将序列同NCBI基因库里面记载的所有已测定生物的Nucleotide collection比较,根据供试菌株16S rDNA序列构建的系统发育树可以看出(图2),NB04-N1与标准菌株Pseudomonas聚到一起,被鉴定为绿脓杆菌(Pseudomonas)。
3 结论与讨论
本试验采用平板涂布法和对峙培养法对中国第6次北极考察海洋沉积物样品进行分离和纯化,从中得到112株菌株。用白色念珠菌作为指示菌,依照对峙培养法进行初筛,先初步选出6株对白色念珠菌具有拮抗作用的菌株。用琼脂扩散法对菌株发酵液进行筛选,筛选出对白色念珠菌抗性最强的拮抗菌,编号为NB04-N1。对其进行形态鉴定、16S rDNA测序结果,得到的序列测序同Gen Bank数据库里所记载的已测定的生物序列进行比较,最后确定其为绿脓杆菌(Pseudomonas)。
下一步将分离纯化该细菌发酵液中的抗菌活性物质,并对其结构进行确定,以期寻找可能的新型抗白色念珠菌的药物。这对于开发海洋微生物新型抗菌药物具有一定的意义[9-10]。
参考文献:
[1] 廖璞,程海平.白色念珠菌致病性研究[J].中华医院感染学杂志,2005,15(4):470-472.
[2] 李莉,苏天璐,苗翠,等.白色念珠菌对临床常用抗真菌药物的耐药性分析[J].中国实验诊断学,2011,15(1):126-128.
[3] JARVIS W R. Epidemiology of nosocomial fungal infection with emphasis on Candida species[J] .Clin Infect Dis,1995, 20(6):1526-1530.
[4] TARMAN K, LINDEQUIST U, WENDE K, et al. Isolation of a new natural product and cytotoxic and antimicrobial activities of extracts from fungi of Indonesian marine habitats [J]. Marine Drugs, 2011, 9(3): 294-306.
[5] GEBREYOHANNES G, MOGES F, SAHILE S, et al. Isolation and characterization of potential antibiotic producing actinomycetes from water and sediments of Lake Tana, Ethiopia[J]. Asian Pacific Journal of Tropical Biomedicine,2013,3(6):426-435.
[6] 韩晓,崔承斌,韩小贤.海洋微生物的分离培养与抗肿瘤活性筛选[J].国际药学研究杂志,2008,35(4):241-246.
[7] 熊枫,郑忠辉.从深海沉积物中筛选具有抗菌、抗肿瘤活性的海洋真菌[J].厦门大学学报,2006,45(3):419-423.
[8] 朱义明,洪葵.海洋动物中微生物的分离与抗金黄色葡萄球菌活性筛选[J].安徽农学通报,2007(8):36-38.
[9] 王硕,孟庆丽,武天娇,等.抗金葡菌深海真菌的分离鉴定及抑菌谱研究[J].生物技术,2015,25(2):169-172.
[10] 布坎南.伯杰细菌鉴定手册[M].北京:科学出版社,1984.endprint

