CXCR7在动脉粥样硬化模型ApoE-/-小鼠的表达及阿托伐他汀的干预作用*
涂小丽, 陈 琦, 张洪洲, 鄢瑞娟, 吴延庆
(南昌大学第二附属医院心血管内科,江西 南昌 330006)
CXCR7在动脉粥样硬化模型ApoE-/-小鼠的表达及阿托伐他汀的干预作用*
涂小丽,陈琦,张洪洲,鄢瑞娟,吴延庆△
(南昌大学第二附属医院心血管内科,江西 南昌 330006)
[摘要]目的: 研究CXC趋化因子受体7(CXC chemokine receptor 7,CXCR7)在动脉粥样硬化模型载脂蛋白E基因敲除(ApoE-/-)小鼠中的表达并探究阿托伐他汀的干预作用。方法: 8周龄ApoE-/-雄性小鼠,随机分为正常对照组、高脂组与高脂+阿托伐他汀组,实验干预12周建立动脉粥样硬化模型;油红O及HE染色观察动脉粥样硬化病变,Western blot及免疫组化法检测动脉CXCR7的表达,Western blot检测动脉eNOS和Akt的表达。结果: (1)动脉油红O及HE染色示高脂组可见有明显粥样核心及纤维帽的显著斑块,高脂+阿托伐他汀组也可见斑块,但斑块负荷较模型组减轻,正常对照组未见明显斑块形成;(2)免疫组化示高脂组动脉细胞着色浅,CXCR7表达量少,高脂+阿托伐他汀组与高脂组比较,细胞着色增加,CXCR7表达量增加,正常对照组颗粒呈深棕黄色,示CXCR7大量表达;(3)Western blot结果示高脂组CXCR7、eNOS和Akt的表达较正常对照组降低,给予阿托伐他汀干预后CXCR7、eNOS和Akt的表达较高脂组增加,较正常对照组相比CXCR7、eNOS和Akt的表达下降,但磷酸化eNOS的水平未见差异。结论: 高脂血症可损伤血管内皮,促进动脉粥样硬化的发展,下调动脉CXCR7、eNOS和Akt的表达;阿托伐他汀可改善动脉粥样硬化,缓解ApoE-/-小鼠动脉CXCR7、eNOS和Akt蛋白表达的下调。
[关键词]动脉粥样硬化; 载脂蛋白E; CXC趋化因子受体7; 阿托伐他汀
趋化因子是一类8~12 kD的小分子多肽类物质,是一种强有力的化学诱导物,能诱导成熟与未成熟造血细胞的增殖与分化,促进干细胞的增殖、生存及归巢,参与多种病理生理过程[1]。基质细胞衍生因子1(stromal cell-derived factor-1,SDF-1),也称CXC趋化因子12(CXC chemokine 12,CXCL12),是一个多效性的趋化因子并广泛表达于多种组织中,在许多重要的生命过程中发挥着作用,如在缺氧复氧性脑损伤的大鼠中,通过调节间充质干细胞CXC趋化因子受体4(CXC chemokine receptor 4,CXCR4)的表达可调控间充质干细胞的迁移,进而起到保护作用[2]。此外在动脉粥样硬化(atherosclerosis,AS)病变中,CXCL12的受体CXCR4能通过调节中性粒细胞的迁移预防AS的发展[3];在内膜损伤的修复过程中,CXCL12对平滑肌祖细胞(smooth muscle progenitor cells,SPCs)的动员聚集加重了内膜增生,但是在系统给予CXCL12药物治疗时,SPCs的动员反而能起到稳定斑块的作用,表明CXCL12及其受体CXCR4对于AS病变的保护性效应[4]。以上研究表明了CXCL12与其受体CXCR4的生物学效应,但关于CXCL12的另一个受CXCR7在AS中的作用机制却仍不明确。本研究通过动脉粥样硬化模型小鼠,探讨AS与 CXCR7 的关系以及阿托伐他汀干预的影响。
材料和方法
1实验动物
8周龄雄性ApoE-/-小鼠,SPF级,体重18~22 g,购于爱尔麦特科技有限公司。
2主要试剂
动脉粥样硬化疾病模型的诱导饲料(江苏美迪森公司);阿托伐他汀钙片(辉瑞制药有限公司);CXCR7 多克隆抗体、eNOS单克隆抗体(Abcam);phospho-eNOS抗体(Affinity);phospho-Akt多克隆抗体(CST);血清总胆固醇(total cholesterol,TC)试剂盒、甘油三酯(triglyceride,TG)试剂盒、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)试剂盒和高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)试剂盒(中生北控生物科技公司)。
3主要方法
3.1动脉粥样硬化模型的建立及实验分组36只ApoE-/-小鼠适应性喂养1周后,禁食不禁水12 h,采用眼眶后静脉丛采血0.5 mL左右,室温静置离心取上清。随后将小鼠随机分为正常对照组、高脂组和高脂+阿托伐他汀组,其中正常对照组给予常规龋齿类动物饲料,高脂组及高脂+阿托伐他汀组则给予高脂饲料,而高脂+阿托伐他汀组在给予高脂饲料4周后开始阿托伐他汀(10 mg·kg-1·d-1)灌胃干预治疗,其它组则予同体积生理盐水灌胃,连续灌胃9周,共喂养高脂饲料12周。干预结束后,给予10%水合氯醛0.07 mL腹腔注射麻醉,摘眼球取血法采血,离心分离血清。取主动脉根部至髂总动脉分叉处整条动脉,一部分经多聚甲醛固定,一部分则液氮速冻,-80 ℃冰箱冻存备用。
3.2血脂检测根据试剂盒说明书测定血清TC、TG、LDL-C和HDL-C水平,其中TC和TG检测采用酶法,LDL-C和HDL-C采用选择性沉淀法测定。
3.3动脉HE染色将标本进行常规石蜡包埋,切片,采取苏木精-伊红(HE)染色、经无水乙醇脱水、二甲苯透明、中性树胶封片。
3.4主动脉整体油红O染色分离主动脉外膜脂肪组织,4%多聚甲醛固定过夜,磷酸盐缓冲液(PBS)冲洗后,异丙醇脱水数分钟,室温下经油红O染色4 h(避光),再经70%异丙醇冲洗4次,每次5 min,PBS冲洗干净并将动脉伸展开,行数码拍照。
3.5免疫组化法主动脉组织切片脱蜡后,置于PBS中,经抗原修复液高温修复(5 min×3次),Tris-HCl缓冲盐溶液(TBS)清洗2次,3%过氧化氢溶液室温10 min,清除内源性过氧化物酶,TBS清洗3次,血清封闭液封闭1 h,滴加抗CXCR7多克隆抗体(1∶100)4 ℃过夜,添加 II 抗1 h,DAB 染色,苏木精复染,中性树胶封固。
3.6Western blot实验取出动脉组织置于冰上,加入液氮研磨,裂解液裂解60 min后离心取上清得到样品,测定蛋白浓度。蛋白在10%SDS-聚丙烯酰胺凝胶中电泳分离,并经湿转法转移到PVDF膜上,含5%脱脂奶粉的TBST封闭1 h,结合 I 抗(CXCR7多克隆抗体,浓度为1∶1 500;β-tubulin单克隆抗体,浓度为1∶1 000;eNOS单克隆抗体,浓度为1∶500;p-eNOS抗体,浓度为:1∶500;p-Akt多克隆抗体,浓度为1∶1 000),4 ℃过夜,TBST 漂洗3 次,滴加辣根酶标记的羊抗兔IgG II 抗(1∶5 000)室温孵育1 h,TBST漂洗3 次,并ECL发光显影摄片。
3.7一氧化氮的检测根据一氧化氮检测试剂盒说明书测定血清中NO的浓度。
4统计学处理
经SPSS 19.0处理数据,计量资料以均数±标准差(mean±SD)表示,多样本均数比较采用单因素方差分析,组间两两比较采用SNK-q检验,以P<0.05为差异有统计学意义。
结果
1血脂检测
3组小鼠的基础血脂水平示各组小鼠血清TC、TG、LDL-C和HDL-C无明显差异;经高脂饮食干预12周后高脂组小鼠血清TC、TG和LDL-C水平较正常对照组明显升高(P<0.05),HDL-C水平明显低于正常对照组(P<0.05);经阿托伐他汀干预后小鼠血清TC、TG和LDL-C水平较高脂组下降(P<0.05),HDL-C水平较高脂组升高(P<0.05);高脂+阿托伐他汀组与正常对照组之间血脂水平的差异无统计学意义,见表1。
表1ApoE-/-小鼠基础血脂及高脂饮食或阿托伐他汀干预后血脂水平
Table 1.Blood lipid concentration ofApoE-knockout mice before or after treated with high-fat diet (HFD) or atorvastatin (Sat). (mmol/L. Mean±SD.n=12).
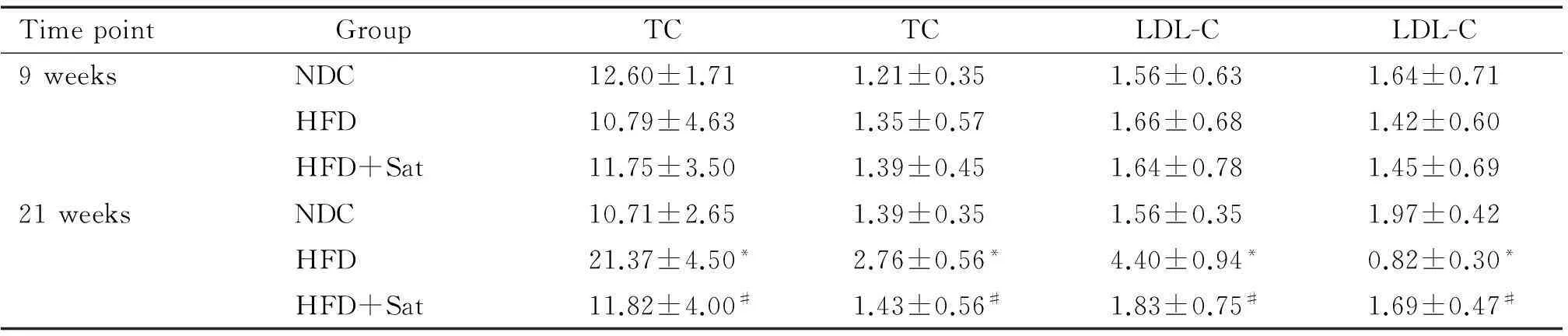
TimepointGroupTCTCLDL-CLDL-C9weeksNDC12.60±1.711.21±0.351.56±0.631.64±0.71HFD10.79±4.631.35±0.571.66±0.681.42±0.60HFD+Sat11.75±3.501.39±0.451.64±0.781.45±0.6921weeksNDC10.71±2.651.39±0.351.56±0.351.97±0.42HFD21.37±4.50*2.76±0.56*4.40±0.94*0.82±0.30*HFD+Sat11.82±4.00#1.43±0.56#1.83±0.75#1.69±0.47#
NDC: normal diet control.*P<0.05vsNDC;#P<0.05vsHFD.
2病理学形态观察
主动脉弓HE染色示高脂组小鼠主动脉内可见有粥样核心及纤维帽的显著斑块,高脂+阿托伐他汀组也可见泡沫细胞以及典型的粥样斑块,但斑块少于高脂组,正常对照组内膜完整,未见泡沫细胞的聚集及AS斑块的形成,见图1。主动脉整体油红O染色示高脂组红染脂质斑块明显,高脂+阿托伐他汀组也可见斑块,但较模型组斑块负荷轻,正常对照组内膜光滑,仅在主动脉弓处可见极少量红染斑块,各组之间斑块相对面积(斑块面积/血管整体面积)比较示高脂组及高脂+阿托伐他汀组小鼠AS斑块相对面积高于正常对照组(P<0.05),且高脂+阿托伐他汀组较高脂组也有减少(P<0.05),见图2。
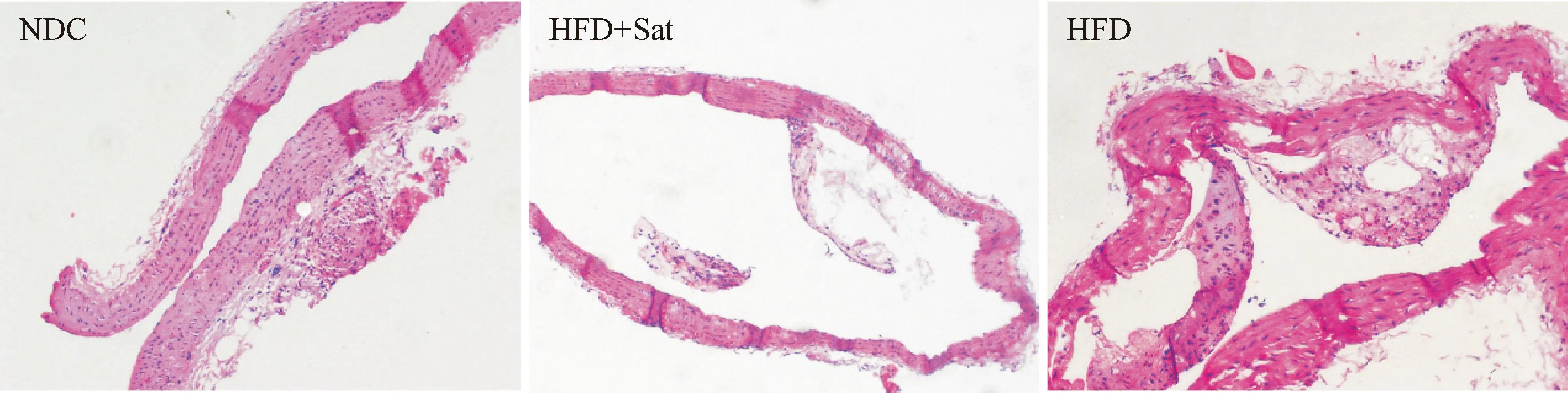
Figure 1.Representative sections ofApoE-knockout mice aortas (HE staining,×200).
图1主动脉弓HE染色
3免疫组化检测
主动脉弓免疫组化提示CXCR7表达阳性时呈棕黄色颗粒,正常对照组小鼠主动脉组织中CXCR7表达量较多,呈深棕黄色的颗粒,细胞着色较深,高脂组及高脂+阿托伐他汀组较对照组表达量减少,细胞着色较浅,平均吸光度值降低(P<0.05),经阿托伐他汀治疗后高脂+阿托伐他汀组细胞着色较高脂组增强(P<0.05),见图3。
4Western blot检测动脉组织CXCR7、p-Akt和eNOS的蛋白水平
4.1CXCR7的表达经高脂刺激后小鼠主动脉CXCR7的表达明显低于正常对照组(P<0.05),他汀药物治疗后,CXCR7的表达仍低于正常对照组(P<0.05),但与高脂组相比有所增加(P<0.05),见图4。
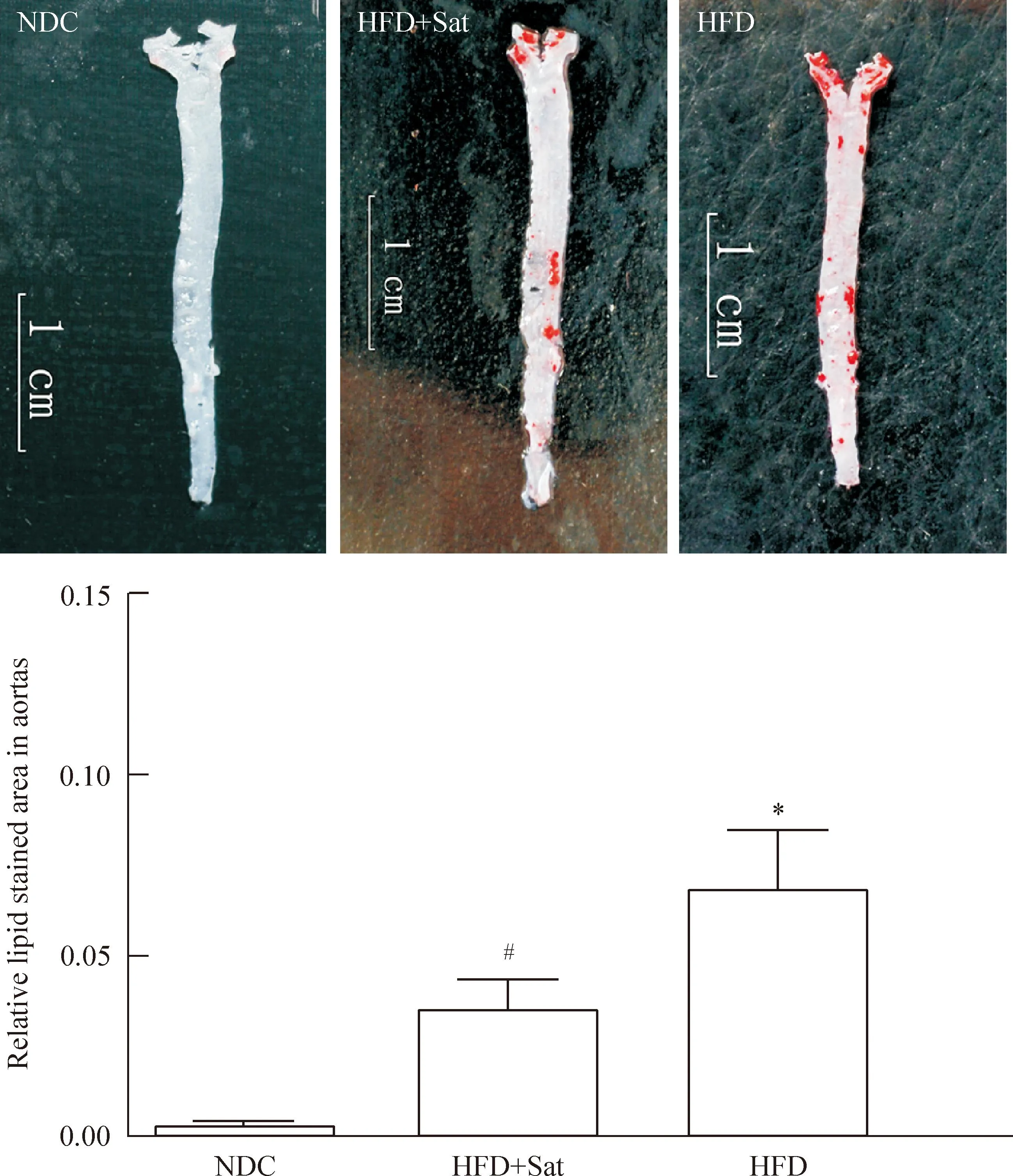
Figure 2.Oil red O staining for lipids within the wall of atherosclerotic aortas fromApoE-knockout mice and the measurement of lipid stained area in the aortas. Mean±SD.n=6.*P<0.05vsNDC;#P<0.05vsHFD.
图2主动脉整体油红O染色及相对斑块面积比
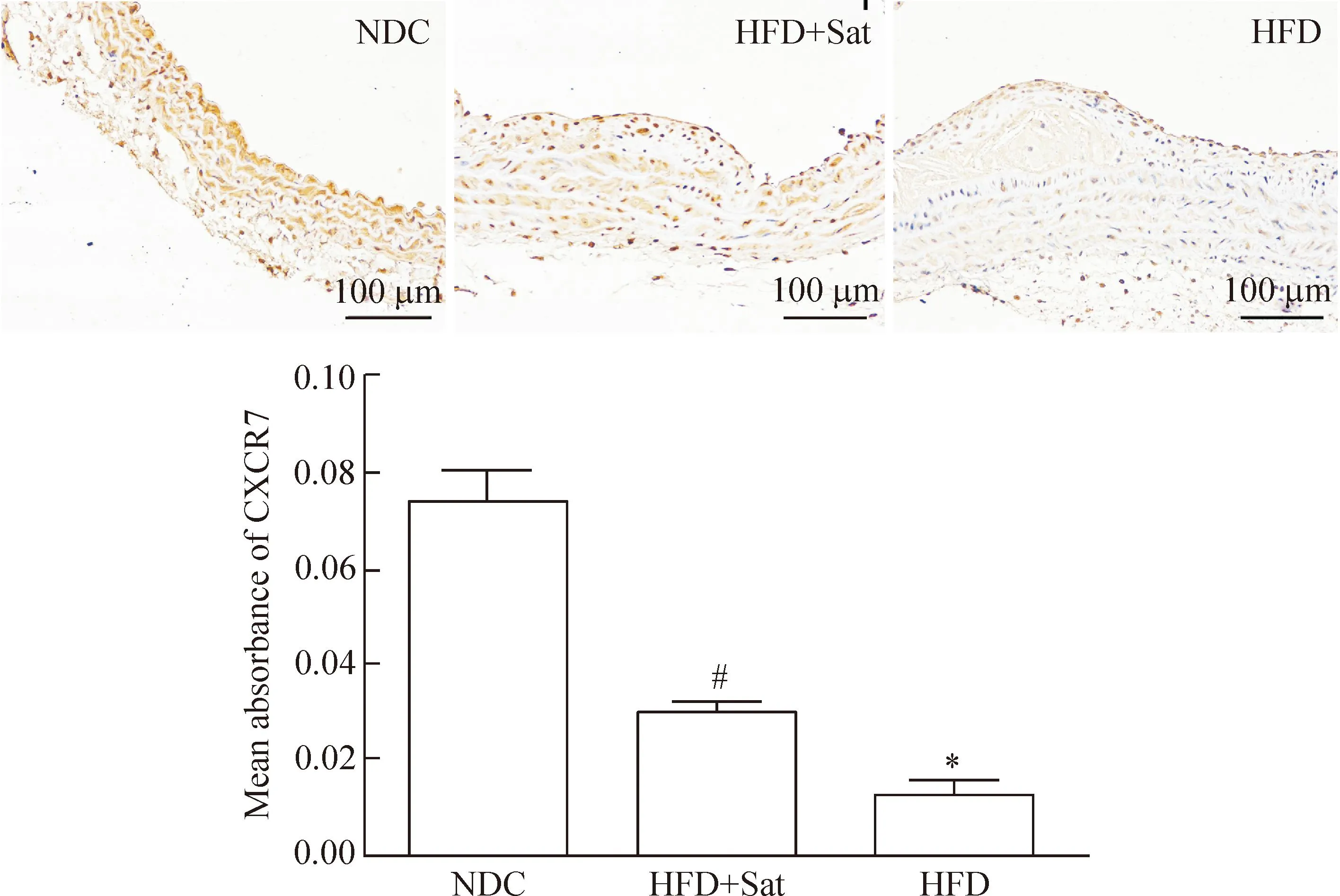
Figure 3.The protein expression of CXCR7 in the aortas ofApoE-knockout mice (immunohistochemistry,×400). Mean±SD.n=6.*P<0.05vsNDC;#P<0.05vsHFD.
图3免疫组化检测主动脉CXCR7的表达情况
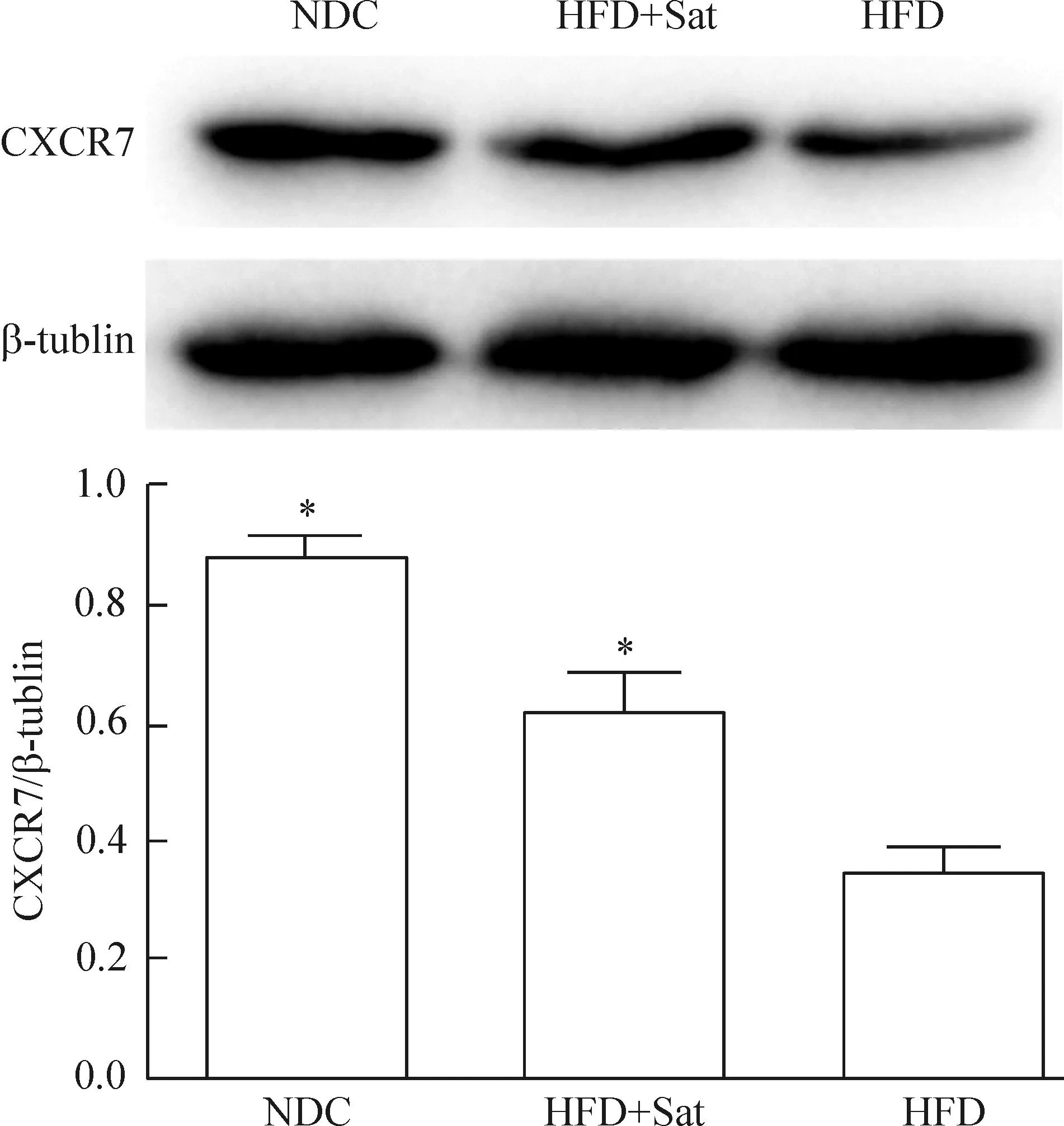
Figure 4.The protein expression of CXCR7 in the aortas ofApoE-knockout mice detected by Western blot. Mean±SD.n=6.*P<0.05vsNDC;#P<0.05vsHFD.
图4Western blot检测动脉组织CXCR7蛋白的表达
4.2p-Akt的蛋白水平经高脂干预后小鼠动脉组织p-Akt的蛋白水平明显低于正常对照组(P<0.05),阿托伐他汀药治疗后,小鼠主动脉p-Akt的蛋白水平虽低于正常对照组(P<0.05),但与高脂组相比仍有增加(P<0.05),见图5。
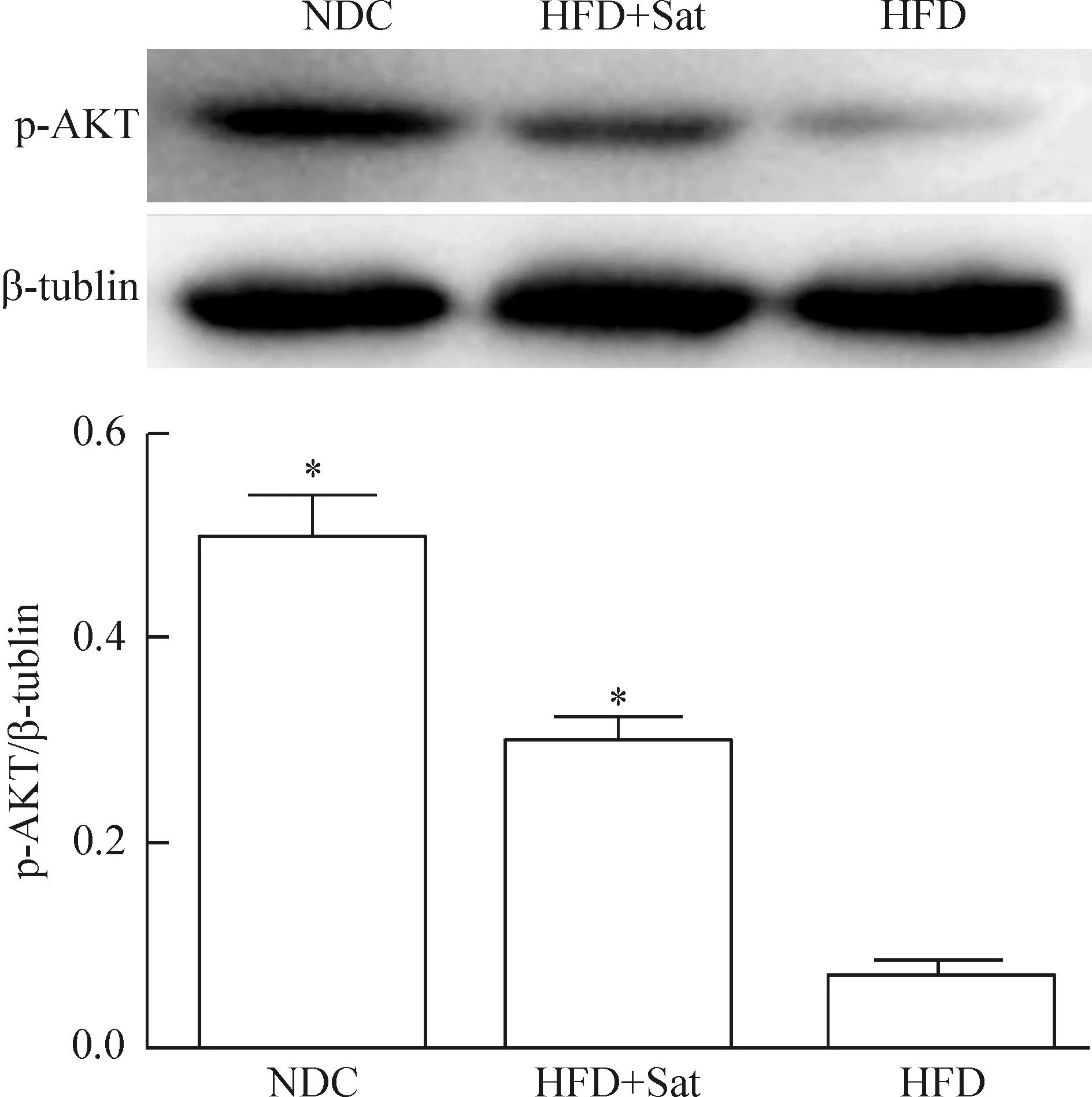
Figure 5.The protein levels of p-Akt in the aortas ofApoE-knockout mice detected by Western blot. Mean±SD.n=6.*P<0.05vsNDC;#P<0.05vsHFD.
图5Western blot检测动脉组织p-Akt蛋白的表达
4.3eNOS的蛋白水平经高脂干预后小鼠动脉组织的eNOS及p-eNOS的蛋白水平明显低于正常对照组(P<0.05),阿托伐他汀治疗后,小鼠主动脉eNOS和p-eNOS的蛋白水平较高脂组明显增加(P<0.05),但与正常对照组相比eNOS仍明显降低(P<0.05),而p-eNOS的蛋白水平与正常对照组比较差异无统计学意义(P>0.05),见图6。
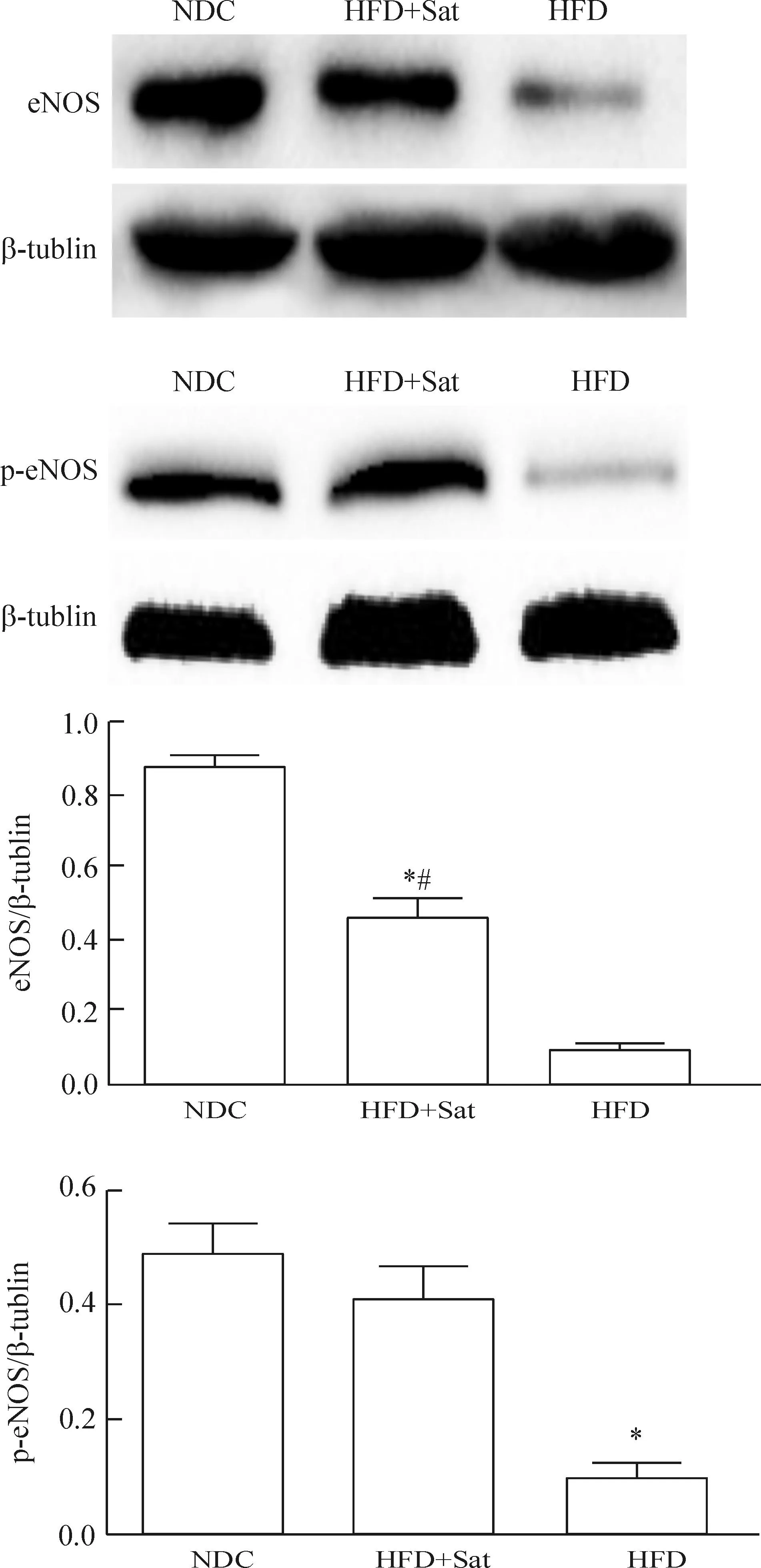
Figure 6.The protein levels of eNOS and p-eNOS in the aortas ofApoE-knockout mice detected by Western blot. Mean±SD.n=6.*P<0.05vsNDC;#P<0.05vsHFD.
图6Western blot检测动脉组织p-eNOS和eNOS蛋白的水平
5血清NO的浓度测定
高脂干预后小鼠血清NO的浓度明显低于正常对照组(P<0.05),阿托伐他汀干预治疗后,小鼠NO的生成较高脂组明显增加(P<0.05),但与正常对照组相比差异无统计意义,见图7。
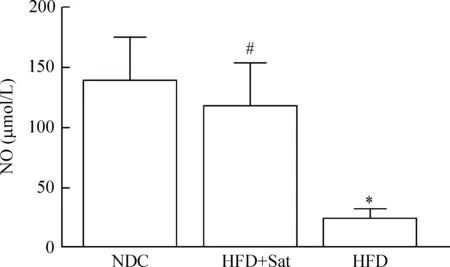
Figure 7.The concentration of NO in the plasma ofApoE-knockout mice. Mean±SD.n=12.*P<0.05vsNDC;#P<0.05vsHFD.
图7血清中一氧化氮的浓度
讨论
动脉粥样硬化性疾病是一种慢性炎症性疾病,是多因素导致的老年性疾病,其中冠状动脉粥样硬化是冠心病的病理基础,而血脂异常与其关系非常密切。研究表明ApoE基因敲除小鼠经过高脂饮食诱导后可形成严重的AS,且与人类粥样斑块的相似性较高[5]。本实验通过对ApoE-/-小鼠进行高脂饮食干预后小鼠血清血脂代谢出现明显异常,血清TC、TG和LDL-C水平升高,HDL-C降低;且小鼠动脉HE染色及油红O染色均可见粥样斑块形成,斑块负荷明显,成功建立了动脉粥样硬化动物模型小鼠。
CXCL12是一个多效性的趋化因子,既往认为其唯一受体是CXCR4,但Balabanian等[6]于2005年发现SDF-1的另一个受体CXCR7,其与配体CXCL12结合的亲和力比CXCR4高10倍左右。与CXCR4相比,CXCR7是一个非典型性趋化因子受体,其不激活细胞内的G蛋白偶联信号通路,而是通过诱导β-抑制蛋白2的聚集,导致受体的内化或者下游信号通路的激活,进而促进细胞的生长与黏附[7]。
在成年的ApoE-/-小鼠中,条件性的CXCR7基因缺陷,并给予损伤颈动脉及高脂饮食干预后,发现在受损的部位有明显的内膜增生及巨噬细胞的堆积,而给予CXCR7人工配体CCX771能够明显改善高脂血症诱导的血管损伤及斑块的形成[8]。Zhang等[9]发现高血压患者循环中CXCR7的水平较正常人低,而下调CXCR7的表达可以激活p38 MAPK信号通路,诱导内皮祖细胞caspase-3的表达,进而降低内皮祖细胞的黏附及增殖,损伤内皮祖细胞对高血压患者损伤内皮的修复作用。而在本实验中同样发现在高脂组中小鼠动脉组织在受到高脂因素损伤后,不仅促进了AS的发展,同时也下调了动脉组织CXCR7的表达,表明CXCR7在AS发展过程中起到保护性效应,可以改善高脂对血管的损伤。
阿托伐他汀被广泛用于治疗及预防高脂血症与冠心病,除可降低低密度脂蛋白胆固醇之外,许多研究表明阿托伐他汀还可以改善AS病变的炎症性改变,促进细胞生存等效应[10]。如在心肌梗死小鼠模型中发现短期服用阿托伐他汀能够增加受损心肌细胞CXCR4的表达,并进一步引起eNOS/NO信号通路的激活起到抗炎及抗凋亡效应[11],在本实验中发现小鼠动脉组织CXCR7表达与阿托伐他汀的干预呈正相关,经他汀干预后可以改善高脂损伤导致的CXCR7表达下降的情况,使其表达量较高脂组增加,推测阿托伐他汀改善AS病变可能与CXCR7的表达相关,他汀可能通过调节趋化因子受体的表达改善高脂对血管的损伤。
磷脂酰肌醇3-激酶(phosphatidyl inositol 3-kinase,PI3K)是一种胞内磷脂酰肌醇激酶,分布于多种细胞内,其可通过磷酸化产生磷脂酰肌醇,并与蛋白激酶B(protein kinase B,Akt)结合,使Akt从细胞质转移到细胞膜,进而激活下游信号通路,对细胞进行调节。在内皮细胞的研究中发现上调PI3K/Akt信号通路能够改善氧化低密度脂蛋白导致的内皮损伤,抑制氧化应激、黏附分子等的表达,而PI3K、Akt或eNOS的抑制剂能明显抑制药物对内皮细胞的保护效应[12],表明影响细胞PI3K/Akt信号通路的激活能够调节氧化低密度脂蛋白对细胞造成的损伤作用。而多数研究表明CXCR7能够调节PI3K/Akt信号通路促进细胞的存活,如T细胞中CXCL12/CXCR7通过与ERK 或Akt信号通路相互作用可以促进T细胞的存活[13];此外,血小板来源的巨噬细胞移动抑制因子也能够上调血小板表面CXCR7的表达,进而激活PI3K/Akt信号通路,延迟血小板的存活以及减少磷脂酰丝氨酸的暴露而调节血栓形成[14]。这些表明CXCR7可能通过PI3K/Akt信号通路调节细胞的凋亡,PI3K/Akt信号通路是CXCR7的一个下游调节通路机制。在本实验中高脂饮食损伤血管并下调动脉组织Akt蛋白的表达,而他汀干预后Akt的表达下调有所缓解,因此考虑动脉组织CXCR7蛋白的表达上调可能通过激活细胞PI3K/Akt信号通路,进而改善高脂血症导致的内皮损伤,氧化应激以及炎症损伤等情况,改善AS的进展,但这还需要通过进一步的研究进行论证。
内皮细胞功能障碍是AS病变形成的关键起始因素,而内皮功能在很大程度上依赖内皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS)的表达,由eNOS合成的一氧化氮(nitric oxide,NO)能抑制内皮细胞黏附分子的表达、细胞增殖、迁移,调节血管张力及血小板的激活等。因此上调eNOS表达促使NO的生成对改善AS非常重要。Akt是细胞生存的调节点,是PI3K的下游效应器。许多因素都能够通过PI3K/Akt信号通路激活eNOS活性,增加细胞NO的产生,调节细胞的增殖、迁移、存活与血管增生;既往研究证明Akt主要通过磷酸化eNOS的Ser 1177位点,提高eNOS的酶活性,进而促进NO的生成[15]。在缺氧诱导的内皮细胞凋亡中,SDF-1/CXCR4上调能够减少细胞凋亡,而PI3K或eNOS的抑制剂的加入可以阻碍其抗凋亡效应,表明SDF-1/CXCR4通过PI3K/Akt/eNOS的激活保护细胞[16]。在本实验中,高脂饲养导致ApoE-/-小鼠血管内皮损伤及AS病变的发生,使动脉CXCR7、eNOS及Akt蛋白的表达减少;而阿托伐他汀干预后缓解了ApoE-/-小鼠动脉组织CXCR7、Akt及eNOS的蛋白下降的情况,增加eNOS的活性及NO的释放,改善AS病变的进展,因此推测阿托伐他汀可能通过上调CXCR7的表达,激活PI3K/Akt/eNOS信号通路,保护细胞功能,改善动脉粥样硬化,但关于两者之间确切的因果关系仍需要进一步的研究进行证实。
综上所述,高脂饮食可提高实验ApoE-/-小鼠血脂水平,损伤血管内皮,促进AS的发展并下调动脉CXCR7、Akt和eNOS的表达;而阿托伐他汀干预后缓解了ApoE-/-小鼠动脉CXCR7、Akt和eNOS蛋白水平下降的趋势,并改善了AS病变,推测它们之间可能存在相关性。但本研究对于Akt、eNOS与CXCR7之间确切的关系并未明确,需要更进一步的研究对其进行论证。
[参考文献]
[1]Rankin SM. Chemokines and adult bone marrow stem cells[J].Immunol Lett,2012,145 (1-2):47-54.
[2]余勤,林洁,刘丽珍,等.SDF-1/CXCR4轴通过调控间充质干细胞定向分化修复缺氧缺血性脑损伤[J].中国病理生理杂志,2012,28(8):1424-1430.
[3]Zernecke A, Bot I, Djalali-Talab Y, et al. Protective role of CXC receptor 4/CXC ligand 12 unveils the importance of neutrophils in atherosclerosis[J].Circ Res,2008,102(2):209-217.
[4]Akhtar S, Gremse F, Kiessling F, et al.CXCL12 promotes the stabilization of atherosclerotic lesions mediated by smooth muscle progenitor cells inApoe-deficient mice[J].Arterioscler Thromb Vasc Biol,2013,33(4):679-686.
[5]Jawien J.The role of an experimental model of atherosclerosis: apoE-knockout mice in developing new drugs against atherogenesis[J]. Curr Pharm Biotechnol,2012,13(13):2435-2439.
[6]Balabanian K, Lagane B, Infantino S, et al. The chemokine SDF-1/CXCL12 binds to and signals through the orphan receptor RDC1 in T lymphocytes[J].J Biol Chem,2005,280(42):35760-35766.
[7]Graham GJ, Locati M, Mantovani A,et al. The biochemistry and biology of the atypical chemokine receptors[J].Immunol Lett,2012,145(1-2):30-38.
[8]Li X, Zhu M, Penfold ME, et al.Activation of CXCR7 limits atherosclerosis and improves hyperlipidemia by increasing cholesterol uptake in adipose tissue[J].Circulation, 2014,129(11):1244-1253.
[9]Zhang XY, Su C, Cao Z, et al.CXCR7 upregulation is required for early endothelial progenitor cell-mediated endothelial repair in patients with hypertension[J].Hypertension, 2014,63(2):383-389.
[10]Hu LH, Zhang T, Shao Q, et al.Atorvastatin suppresses oxidized LDL-induced dendritic cell-like differentiation of RAW264.7 cells regulated by the p38 MAPK pathway[J].Mol Cell Biochem,2012,371(1-2):105-113.
[11]Qiu R, Cai A, Dong Y, et al. SDF-1α upregulation by atorvastatin in rats with acute myocardial infarction via nitric oxide production confers anti-inflammatory and anti- apoptotic effects[J].J Biomed Sci,2012,19:99.
[12]Huang CS, Lin AH, Yang TC, et al.Shikonin inhibits oxidized LDL-induced monocyte adhesion by suppressing NFκB activation via up-regulation of PI3K/Akt/Nrf2-dependent antioxidation in EA.hy926 endothelial cells[J]. Biochem Pharmacol,2015,93(3):352-361.
[13]Kumar R, Tripathi V, Ahmad M, et al.CXCR7 mediated Giα independent activation of ERK and Akt promotes cell survival and chemotaxis in T cells[J].Cell Immunol,2012, 272(2):230-241.
[14]Chatterjee M, Borst O, Walker B, et al.Macrophage migration inhibitory factor limits activation-induced apoptosis of platelets via CXCR7-dependent Akt signaling[J].Circ Res,2014,115(11):939-949.
[15]Dou J, Li H, Ma X, et al.Osteocalcin attenuates high fat diet-induced impairment of endothelium-dependent relaxation through Akt/eNOS-dependent pathway[J].Cardiovasc Diabetol,2014,13(1):74.
[16]Zheng H, Dai T, Zhou B, et al.SDF-1α/CXCR4 decreases endothelial progenitor cells apoptosis under serum de-privation by PI3K/Akt/eNOS pathway[J].Atherosclerosis,2008, 201(1):36-42.
(责任编辑: 林白霜, 罗森)

Expression of CXC chemokine receptor 7 in atherosclerotic ApoE-deficient mice and therapeutic impact by atorvastatinTU Xiao-li, CHEN Qi, ZHANG Hong-zhou, YAN Rui-juan, WU Yan-qing
(DepartmentofCardiology,TheSecondAffiliatedHospitalofNanchangUniversity,Nanchang330006,China.E-mail:wuyanqing01@sina.com.cn)
[ABSTRACT]AIM: To evaluate the expression level of CXC chemokine receptor 7 (CXCR7) in atherosclerotic apolipoprotein E-deficient (ApoE-/-) mice induced by high-fat diet (HFD) and the effects of atorvastatin on it. METHODS: ApoE-/-male mice (8-week-old) were used and were randomly divided into 3 groups following 1-week normal rodent diet: normal diet control (NDC) group , HFD group and HFD+statins (HFD+Sat) group. HE staining and oil red O staining were used to observe the atherosclerotic lesion burdens in the aortas. The expression of CXCR7 on the aortas was detected by Western blot and immunohistochemistry. The expression of Akt and endothelial nitric oxide synthase (eNOS) in the aorta was determined by Western blot.RESULTS: Few lesions were found in the aortas in NDC group. Apparent atherosclerotic plaque burdens were seen in HFD group and HFD+Sat group, while the atherosclerotic plaque burdens in HFD+Sat group were notably reduced compared with HFD group. The protein levels of CXCR7, eNOS and Akt in aorta in HFD group and HFD+Sat group were significantly decreased compared with NDC group, while those in HFD+Sat group were increased compared with HFD group. The protein level of p-eNOS in the aorta and the concentration of NO in the plasma in HFD group were decreased compared with NDC group and HFD+Sat group. CONCLUSION: In ApoE-/-mice, HFD increases the lipid level and promotes the development of atherosclerosis by downregulating the expression of CXCR7, Akt and eNOS. Atorvastatin reverses the above effect of hypercholesterolemia on the expression of CXCR7, Akt and eNOS, thus playing the role in treating atherosclerosis.
[KEY WORDS]Atherosclerosis; Apolipoprotein E; CXC chemokine receptor 7; Atorvastatin
通讯作者△Tel: 023-63693702; E-mail:dy070306@126.com
[收稿日期]2015- 05- 28[修回日期] 2015- 08- 30
[文章编号]1000- 4718(2015)12- 2216- 05
doi:10.3969/j.issn.1000- 4718.2015.12.016
[中图分类号]R541.4; R363
[文献标志码]A

