鼠痘病毒荧光定量Taqman-PCR检测方法的建立与应用
杜江涛,戴方伟,周莎桑,宋晓明,吕 宇,萨晓婴
(1 浙江省医学科学院实验动物中心, 杭州 310013;2 杭州师范大学实验动物中心, 杭州 310036)
鼠痘病毒荧光定量Taqman-PCR检测方法的建立与应用
杜江涛1,戴方伟1,周莎桑1,宋晓明2,吕宇1,萨晓婴1
(1 浙江省医学科学院实验动物中心, 杭州310013;2 杭州师范大学实验动物中心, 杭州310036)
【摘要】目的建立鼠痘病毒的荧光定量Taqman-PCR检测方法,以期能快速、准确、灵敏、特异的检出鼠痘病毒。方法经过比对和筛选,本研究选取鼠痘病毒的ERPV027基因480-800位序列段,作为引物设计位点设计引物和探针,并对该引物对和探针的特异性、灵敏性、稳定性和重复性进行检测。结果本研究建立的方法,对鼠痘病毒的检测极限是68 copies/μL;该方法特异性强,只对鼠痘病毒特定片段进行特异性扩增,而对小鼠肝炎病毒、仙台病毒、沙门氏菌等其它病毒、细菌无扩增;该方法稳定性和重复性均较好。结论本研究成功建立了检测鼠痘病毒的荧光定量Taqman-PCR方法,该方法特异性强、灵敏度高,且具有较好的稳定性和重复性,具有广阔的应用价值。
【关键词】鼠痘病毒;荧光定量PCR;Taqman探针
鼠痘(mouse pox)是由鼠痘病毒(mouse poxvirus,MPV)感染引起的实验小鼠的一种烈性传染病。本病多呈爆发性流行,致死率较高,常造成全群淘汰,危害极大[1]。临床表现以四肢、尾和头部肿胀、溃烂、坏死甚至脚趾脱落为特征,故又称脱脚病(Ectromelia,Ect)[2]。
目前,鼠痘病毒的检测方法主要是酶联免疫吸附技术(ELISA)和免疫荧光技术(IFA)[3]等血清学方法。传统的血清学方法对检测鼠痘病毒感染,特别是隐性感染存在较大的局限性。近年来,随着分子生物学的快速发展,聚合酶链反应(PCR)越来越多地应用于传染病的诊断检测[4, 5]。关于鼠痘病毒的普通PCR检测方法及应用已有报道[6-8],但未见其荧光定量PCR检测方法的相关报道。本研究针对鼠痘病毒建立荧光定量PCR检测方法,能快速、准确、灵敏、特异的检出鼠痘病毒。
1材料方法
1.1病毒株核酸及样品
鼠痘病毒标准株核酸ECT-BJ、ECT-GZ(ECT-GZ-1、ECT-GZ-2)和4个临床分离株核酸001、MB35、HZ、1436R由中国食品药品检定研究院和广东实验动物监测所提供。种属外病原核酸包括牛痘病毒、泰泽病原体、仙台病毒、小鼠肝炎病毒(以上均来源于中国食品药品检定研究院)以及沙门氏菌、李斯特杆菌、支气管鲍特菌、大肠埃希菌、铜绿假单胞菌、金黄色葡萄球菌、白色念珠菌及42份鼠源性动物粪便、组织等样品(由本实验室收集保存)。
1.2主要试剂及器材
DNA提取试剂盒、琼脂糖凝胶纯化试剂盒购自Qiagen公司;PMD18-T Vector载体、DNA Taq酶、JM109感受态细胞、聚合酶链反应(PCR)相关试剂购自日本TaKaRa中国分公司;TaqMan Fast Advanced Master Mix购自ABI公司;质粒DNA纯化试剂盒由Axygen公司生产;DNA Marker、6×Loading Buffer为上海捷瑞产品;常温离心机(Thermo),微量紫外分光光度计(Nanodrop 2000-Thermo),水平电泳仪(Tanon),Gel Image System(Tanon),生化培养箱(上海精宏仪器有限公司),普通PCR扩增仪(Bio-RAD),荧光定量PCR仪(ABI 7500)。
1.3方法
1.3.1引物、探针设计及合成:从NCBI上下载鼠痘病毒的全基因组序列,从中选出四个基因利用Primer Express 3.0设计荧光定量PCR引物对和探针(表1)。经过筛选和验证,本研究最终选取ERPV_027基因作为靶基因引物、探针均由上海捷瑞生物工程有限公司合成。
1.3.2DNA提取:参照QIAamp DNA Mini Kit说明书,分别提取鼠痘病毒感染样本、细菌、鼠源性动物粪便组织等样品的DNA。
1.3.3特异性检测:对设计的4对引物进行筛选后,选择特异性最好的ECT-027引物对和探针进行检测,并对PCR程序进行优化。
优化后的普通PCR体系如下:10× Taq PCR buffer (含Mg2+) 2 μL,dNTPs mixture(2.5 mmol/L)2 μL,Taq DNA聚合酶(5 U/μL)0.5 μL,上下游引物(10 μmol/L)各0.5 μL,模板DNA(10 ng/μL) 2 μL,补水至20 μL。扩增程序为:95℃预变性5 min;95℃变性15 s,55℃退火20 s,72℃延伸20 s ,共40个循环;72℃再延伸7 min;8℃保存。
优化后的荧光定量Taqman-PCR体系如下:2× TaqMan Fast Advanced Master Mix 12.5 μL,上下游引物(10 μmol/L)各0.5 μL,探针(5 μmol/L)1.0 μL,模板DNA(10 ng/μL)1.0 μL,补水至25 μL。扩增程序为:50℃培育2 min,95℃预变性10 min;95℃变性15 s,55℃退火20 s,72℃延伸20 s ,预扩增10个循环;95℃变性15 s,60℃退火延伸1 min ,共40个循环,收集荧光信号并读取数据。

表1 四组荧光定量PCR引物对和Taqman探针序列
普通PCR和荧光定量Taqman-PCR分别对鼠痘病毒标准株ECT-BJ、ECT-GZ-1、ECT-GZ-2和分离株001、MB35、1436R、HZ DNA,荧光定量Taqman-PCR对小鼠肝炎病毒、牛痘病毒、仙台病毒、泰泽病原体、沙门氏菌、李斯特菌、支气管鲍特菌、大肠埃希菌、铜绿假单胞菌、金黄色葡萄球菌和白色念珠菌,及鼠痘病毒感染组织样品DNA进行扩增,检测引物和探针的特异性。
1.3.4敏感性检测:
1.3.4.1标准曲线与表达式的建立:将ERPV_027基因克隆至PMD 18-T vector上,并对重组质粒(21.7 ng/μL)依次作10倍稀释直到21.7×10-8ng/μL。选取(21.7×10-8~21.71×10-1)ng/μL进行TaqMan探针检测制作标准曲线。
1.3.4.2探针灵敏性: 将重组质粒(21.7 ng/μL)依次作10倍稀释直到21.7× 10-9ng/μL,再取1 μL各稀释倍数的ERPV_027克隆质粒作为模板,用荧光定量Taqman-PCR进行检测,PCR扩增体系和反应程序同上。
1.3.5稳定性和重复性实验:取鼠痘病毒标准株ECT-BJ、ECT-GZ-1、ECT-GZ-2,分离株001、MB35、1436R、HZ DNA及同一批PCR检测试剂于-20℃冰箱放置1周、2周、3周,用荧光定量Taqman-PCR检测,3次试验各做3个重复,PCR扩增体系和反应程序同上。
1.3.6实际检测应用:以ERPV027基因克隆质粒作为阳性对照,用荧光定量Taqman-PCR分别对取自鼠源性动物粪便、组织等42份样本的DNA样品及鼠痘病毒感染样本(鼠痘病毒感染的BHK21细胞)的DNA样品进行检测。
2结果
2.1引物和探针的特异性
普通PCR和荧光定量Taqman-PCR分别对鼠痘病毒标准株ECT-BJ、ECT-GZ-1、ECT-GZ-2,分离株001、MB35、1436R、HZ进行检测,均能得到特异性扩增条带和曲线(图1、2)。荧光定量Taqman-PCR对鼠痘病毒感染样本,都能够特异性扩增,而对其它病毒及细菌,如牛痘病毒、泰泽病原体、仙台病毒、小鼠肝炎病毒、沙门氏菌、李斯特杆菌、支气管鲍特菌、大肠埃希菌、铜绿假单胞菌、金黄色葡萄球菌和白色念珠菌则无扩增结果。
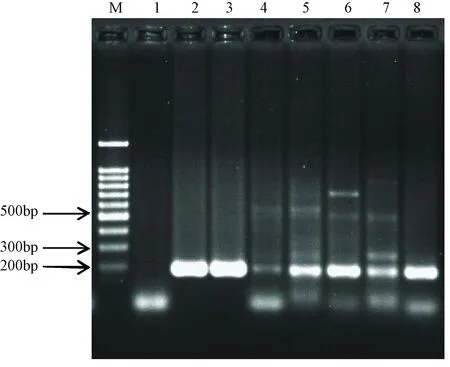
注:M为100 bp DNA ladder;1-8依次为阴性对照(NTC)、ECT-GZ-2、ECT-BJ、001、MB35、1436R、HZ、ECT-GZ-1的扩增结果图1 各鼠痘病毒DNA样本的普通PCR扩增结果Note. Lane M represents 100 bp DNA ladder; Lanes 1-8 represent amplification results of NTC, ECT-GZ-2, ECT-BJ, 001, MB35, 1436R, HZ and ECT-GZ-1Fig.1 Regular PCR amplification results of each mouse poxvirus DNA samples
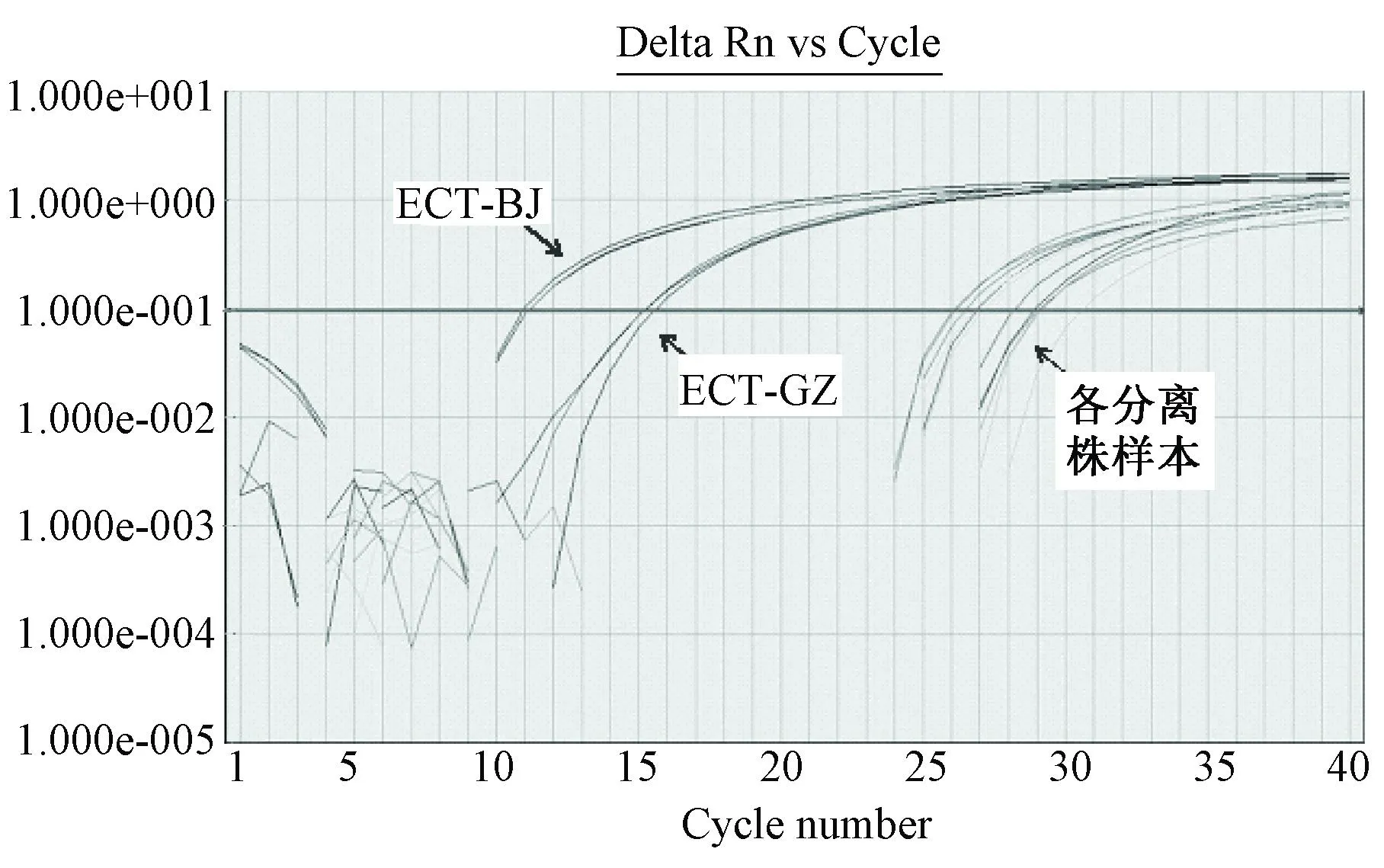
注:Delta Rn表示标准指示信号值减去基线信号值,Cycle Number表示PCR循环数。图2 荧光定量Taqman-PCR检测各鼠痘病毒DNA样本的扩增曲线Note. Delta Rn represents the standard indication signal minus the baseline signal value. Cycle number represents the number of PCR cycles.Fig.2 Amplification curve of mouse poxvirus DNA detected by FQ Taqman-PCR
2.2敏感性
2.2.1标准曲线与表达式的建立:将ERPV_027基因克隆至PMD 18-T vector上,并对重组质粒(21.7 ng/μL)依次作10倍稀释直到21.7×10-8ng/μL。选取(21.7×10-8~21.7×10-1)ng/μL进行TaqMan探针检测制作标准曲线,横坐标是以10为底的质粒拷贝数的对数值,纵坐标是循环阈值Ct。从标准曲线得出重组质粒拷贝数(copy number)与循环阈值(Ct)之间的线性关系曲线表达式Ct = -3.47 × lg(copy number)+ 44.66,根据该表达式测算出重组质粒的初始拷贝数。根据标准曲线得知,已建立的荧光定量PCR的相关系数为R2= 0.996,扩增效率为94%,表明已建立的荧光定量PCR方法误差较小,使用的标准品是合格的(图3、4)。

注:横坐标是以10为底的质粒拷贝数的对数值,纵坐标是循环阈值Ct图3 标准曲线Note. The abscissa is lg (Copy numbers), and ordinate is Ct.Fig.3 The standard curve

注:曲线从左到右依次为克隆质粒21.7×10-1~21.7×10-7 ng/μL稀释图4 标准曲线扩增图Note. The curves from left to right are cloning plasmid 21.7×10-1~21.7×10-7 ng/μL dilutionFig.4 The standard amplification curves
2.2.2探针灵敏性检测:将ERPV027基因克隆质粒(21.7 ng/μL)依次10倍稀释直到21.7×10-9ng/μL,各取1 μL作为模板,用荧光定量Taqman-PCR进行检测。结果显示:在40个PCR循环内,最小可以检测到21.7×10-8ng/μL,即:68 copies,探针灵敏性较好。扩增曲线见图5:从左到右分别是21.7×10-1ng/μL ~21.7×10-9ng/μL,21.7×10-9ng/μL已经看不到完整的扩增曲线。
2.3稳定性和重复性
取鼠痘病毒标准株ECT-BJ、ECT-GZ-1、ECT-GZ-2,分离株001、MB35、1436R、HZ DNA及同一批荧光定量PCR检测试剂于-20℃冰箱放置1周、2周、3周,用荧光定量Taqman-PCR检测(表2)。3次试验各做3个重复,3次试验的Ct的标准差SD值小于0.5,变异系数(CV)小于5%,说明用引物027建立的FQ Taqman-PCR方法稳定性和重复性均较好。

图5 荧光定量Taqman-PCR对10倍梯度稀释质粒扩增结果Fig.5 Amplification results of the plasmid in 10-fold dilutions by FQ Taqman-PCR

表2 鼠痘病毒DNA及试剂放置一段时间后用检测结果
2.4实际检测应用
以ERPV027基因克隆质粒作为阳性对照,用荧光定量Taqman-PCR对取自鼠源性动物粪便、组织等42份样本的DNA样品及鼠痘病毒感染样本(鼠痘病毒感染的BHK21细胞)的DNA样品进行Real-time PCR检测。鼠源性动物粪便、组织中均未检测出鼠痘病毒目的基因,鼠痘感染样品中检测到目的基因且含量较高。
3讨论
目前国内通用的检测鼠痘病毒的方法是血清学方法,如免疫荧光技术(IFA)[3]、酶联免疫吸附技术(ELISA)等。但对于急性发病鼠群,其体内尚未产生相应的抗体或抗体未达到可检出的水平时,血清学方法会出现假阴性结果,造成漏检[9]。而且血清学检测方法对抗原的纯度要求较高,对能产生抗DNA抗体的小鼠血清会出现假阳性,且不能鉴别痘苗病毒免疫抗体和MPV感染所产生的抗体。对病毒的早期诊断,存在着很大的局限性。近年来,随着分子生物学的快速发展,应用PCR技术扩增病毒基因的特异DNA片段[10],可以在病毒诱生抗体之前确定感染,且可分型和定量。目前,关于鼠痘病毒的普通PCR检测已有相关报道[6-8],但其荧光定量PCR检测方法仍未见报道。
本研究从NCBI的FTP下载一株Ectromelia virus全基因组的基因序列(Ectromelia virus culture-collection ATCC:VR-1431,GenBank Accession No:JQ410350.1),将其183个基因与Nt库对比,获得全部的比对结果。在分析比对结果时,发现ERPV_027,ERPV_60、 ERPV_64、 ERPV_77、 ERPV_116、 ERPV_140、 ERPV_142、 ERPV_145、 ERPV_148、 ERPV_149、 ERPV_150、 ERPV_174、 ERPV_175、 ERPV_177基因,有非常好的种内特异和种间的差异性(与牛痘病毒差别较大)。我们选择了特异性最好的三个基因ERPV_027、ERPV_150、ERPV_177三个基因作为候选基因,设计特异性检测引物。此外,我们还参考文献,将鼠痘的secreted chemokine binding protein也作为靶基因设计引物。
针对ERPV_027、ERPV_150、ERPV_177三个基因,我们下载了不同分离株各三条序列,针对secreted chemokine binding protein我们下载了五条分离株的序列,利用Mega5进行多序列联配,针对不同分离株的保守性区域利用Primer Express 3.0设计引物和探针(表1)。我们将4对引物用普通PCR对标准株进行扩增,发现都能得到目的条带,之后又对不同来源的分离株进行PCR检测,发现仅ERPV_027有很好的扩增效果。我们将ERPV_027基因作为候选基因,对7株病毒株进行检测,结果也符合预期。
为了进一步验证其特异性,我们对32个样本进行检测,其中18个样本为鼠痘感染的生物样本,其余样本为不同病原体感染的生物样本。检测结果显示我们所设计的探针的特异性为100%。为了检测引物的灵敏性,我们制作了该目的基因的标准品,Taqman检测结果表明该方法对鼠痘病毒的检测限为68 copies/μL,与普通PCR相比,大大提高了检测灵敏度。取鼠痘病毒标准株和分离株样品DNA及同一批PCR检测试剂于-20℃冰箱放置1周、2周、3周,Taqman PCR检测能得到良好的扩增效果,证明所建立的方法稳定性和重复性较好。用荧光定量Taqman-PCR均未从鼠源性动物粪便、组织样本的DNA中检出鼠痘病毒目的基因,但从鼠痘感染样本的DNA中检测到目的基因且含量较高,证明该方法具有良好的实际应用价值。
本方法在实际检测应用中,仅对本实验室收集的沙鼠粪便和组织,野鼠粪便样本及鼠痘病毒感染的BHK21细胞样本进行了检测,并未对鼠痘感染的动物组织样本进行过检测,表明该方法在实际应用中,尚需进一步的验证。
参考文献:
[1]景志忠, 贾怀杰, 周涛. 痘病毒病:值得高度重视的一类人兽共患病 [J]. 中国病毒病杂志, 2011. 1(6): 416-418.
[2]师长宏, 李六金, 李成, 等. KM和BALB/c小鼠痘病毒感染的诊断 [J]. 动物医学进展, 2002. 23(3): 72-73.
[3]应贤平, 钱琴, 屈霞琴, 等. 实验小鼠痘病毒感染检测分析 [J]. 中国实验动物学杂志, 2000. 10(2): p. 69-72.
[4]Scaramozzino N, Ferrier-Rembert A, Favier AL, et al. Real-time PCR to identify variola virus or other human pathogenic orthopox viruses[J]. Clin Chem, 2007. 53(4): 606-613.
[5]Labelle P, Hahn NE, Fraser JK, et al. Mousepox detected in a research facility: case report and failure of mouse antibody production testing to identify Ectromelia virus in contaminated mouse serum [J]. Comp Med, 2009, 59(2): 180-186.
[6]赵雅静, 宁磊, 于风刚. 小鼠痘病毒的聚合酶链反应检测法 [J]. 上海实验动物科学, 1998. 18(2): 88-90.
[7]付瑞, 岳秉飞, 贺争鸣. 鼠痘病毒PCR检测方法的建立及在鼠源性生物制品检定中的应用 [J]. 实验动物科学, 2012. 29(3): 12-14.
[8]杨松涛, 夏咸柱, 乔军,等. 鼠痘病毒CC强毒株的分离与鉴定 [J]. 中国病原生物学杂志, 2007,2(1):5.
[9]Parker S, Siddiquia AM, Oberlea C, et al. Mousepox in the C57BL/6 strain provides an improved model for evaluating anti-poxvirus therapies [J]. Virology, 2009. 385(1): 11-21.
[10]Kochneva GV, Kolosova TA, Lupan GF, et al. [Orthopoxvirus genes for kelch-like proteins. III. Construction of mousepox (ectromelia) virus variants with targeted gene deletions] [J]. Mol Biol (Mosk), 2009.43(4): 567-572.
〔修回日期〕2015-05-18
技术方法
Establishment and application of a fluorescence quantitative
Taqman-PCR detection method of mouse poxvirus
Du Jiang-tao1, DAI Fang-wei1, ZHOU Sha-sang1, SONG Xiao-ming2, LV Yu1, SA Xiao-ying1
(1. Center of Laboratory Animals, Zhejiang Academy of Medical Sciences, Hangzhou 310013, China;
2. Center of Laboratory Animals, Hangzhou Normal University, Hangzhou 310036)
【Abstract】ObjectiveTo establish a fluorescence quantitative Taqman-PCR method for rapid and accurate detection of mouse poxvirus. Methods After sequence alignment and comparison, ERPV027 gene was selected as the primer and probe design gene. Furthermore, the specificity, sensitivity, stability and reproducibility of these primers and probes were detected. ResultsThe detection limitation of this method was 68 copies/μL. Data showed that this method has high specificity, which specifically amplifies mouse poxvirus, with no amplification signal of mouse hepatitis virus, Sendai virus, Salmonella and some other viruses and bacteria. This method also showed good stability and reproducibility. ConclusionsThis study has successfully established a fluorescence quantitative Taqman-PCR method for detection of mouse poxvirus, with high specificity, sensitivity, good stability and reproducibility, and a broad application potential.
【Key words】Mouse poxvirus; Fluorescence quantitative PCR; Taqman probe
doi:10.3969.j.issn.1671.7856. 2015.006.012
【中图分类号】R-33
【文献标识码】A
【文章编号】1671-7856(2015) 06-0059-06
[通讯作者]萨晓婴。E-mail: saxiaoyin@163.com。
[作者简介]杜江涛(1986-)男,研究实习员,从事实验动物微生物检测等工作。E-mail: djtao1986@126.com。
[基金项目]科技部“十二五”科技支撑计划项目子项目(2013BAK11B01-41),浙江省医药卫生科技计划项目(2012ZDA010),浙江省科技计划项目(2012C37097)。

