实时荧光定量TaqMan-PCR检测小鼠多瘤病毒方法的建立
尹雪琴,袁 文,王 静,黄碧洪,饶 丹,伍妙梨,朱余军,
冯胜鹏,郭鹏举,张 钰,黄 韧
(广东省实验动物重点实验室,广东省实验动物监测所,广州 510663)
实时荧光定量TaqMan-PCR检测小鼠多瘤病毒方法的建立
尹雪琴,袁文,王静,黄碧洪,饶丹,伍妙梨,朱余军,
冯胜鹏,郭鹏举,张钰,黄韧
(广东省实验动物重点实验室,广东省实验动物监测所,广州510663)
【摘要】目的建立一种快速、特异、敏感的小鼠多瘤病毒 (murine polyomavirus, MPyV)荧光定量 TaqMan PCR检测方法,用于MPyV核酸的检测。 方法根据GenBank中小鼠多瘤病毒基因组序列设计了一对特异性引物及TaqMan探针,扩增长度为69 bp的片段,通过优化反应体系和反应条件,对构建的重组质粒标准品进行检测,并绘制标准曲线,进行特异性、敏感性和重复性试验。最后用建立的方法对人工感染MPyV的肺脏、脾脏和粪便,及86 份小鼠临床样本进行检测,验证在临床应用中的效果。 结果 所建立的检测方法特异性强,只能在小鼠多瘤病毒DNA中检出荧光信号,检测灵敏度达到100拷贝,批内和批间重复性好,检测结果变异系数(CV)均小于1.13%,人工感染MPyV小鼠的肺脏、脾脏和粪便均为阳性,对86份临床样本进行检测,有3份样本呈阳性(阳性率为3.5%)。 结论 建立的MPyV荧光定量TaqMan-PCR检测方法特异性强、敏感性高、重复性好,适合用于MPyV临床诊断、日常监测和流行病学调查。
【关键词】小鼠多瘤病毒;实时荧光定量PCR;TaqMan探针
Establishment of a TaqMan real-time fluorescence
小鼠多瘤病毒 (murine polyomavirus, MPyV)属于多瘤病毒科多瘤病毒属,为双链DNA病毒,病毒粒子呈圆形,无囊膜,可存在于实验鼠群和野生鼠群中,为中国实验动物国家标准《实验动物微生物等级及监测》(GB14922. 2-2011)中SPF级小鼠必要时需排除的病原[1-3]。此外人工感染可使小鼠等动物产生各种组织肿瘤,故MPyV也可用于研究病毒介导的肿瘤机制以及肿瘤模型的建立。然而尽管MPyV具有致肿瘤的特性,但在自然条件下小鼠感染多瘤病毒呈隐形或亚临床感染[4-6]。在研究病毒介导肿瘤的模型中,小鼠体内MPyV含量的变化是分析肿瘤发展、免疫反应及疾病表征的重要指标。故隐性感染一方面可对实验动物本身造成危害,对科研工作造成潜在干扰,另一方面也可作为研究感染病毒后宿主免疫反应的模型。因此建立一个敏感有效的监测MPyV感染小鼠的检测方法,不仅可以保证实验动物的质量,而且有利于建立一个针对病毒、免疫和肿瘤有效的模型系统。本试验建立了荧光定量定量PCR检测MPyV的方法,具有敏感性高、特异性强、稳定性好、速度快的特点。
1材料和方法
1.1材料
1.1.1仪器和试剂:荧光定量PCR仪为ABI的7500,常规PCR仪为购自Biometra的TProfessional Standard Gradient,紫外分光光度计Nanodrop 2000C购自Thermo;PCR Premix、PMD-T19载体、T4连接酶、HotStart Tag酶、dNTPs、MgCl2和DL5000 DNA marker均购自TakaRa公司,病毒DNA抽提试剂盒、质粒抽提试剂盒、胶回收试剂盒购自Omega公司。
1.1.2动物、毒株及菌株:小鼠多瘤病毒购自美国典型菌种保藏中心 (ATCC VR-252),BHK细胞及大肠埃希菌DH-5肠菌株由本实验室保存,SPF级BALB/c小鼠购自广东省医学实验动物中心(SCXK(粤)2013-0002)、(SYXK (粤) 2008-0002)。
1.1.3引物和探针:根据小鼠多瘤病毒基因组序列(GenBank:AF442959.1),应用Oligo7软件设计一对特异性引物,扩增产物用于克隆至pMD-T19 载体中,上游引物P1:5′-CCATGGCCTACTT CATTCCG-3′,下游引物P2:5′-CGGTCAACATAGCGCGTCA-3′,该引物扩增的目的片段长度为1603 bp。同时在上述扩增片段内设计一对特异性引物及探针用于荧光定量检测,上游引物P3:5′-CGGCGTCTCTAAA TGCGAG-3′,下游引物P4:5′-AGCAGTTTGGG AAC GGGTG-3′,TaqMan探针:5′-(FAM)CAAAATGTA CAAAGGCCTGTCCAAGACCC(BHQ-1)-3′,该引物扩增的目的片段长度为69 bp。
1.2方法
1.2.1病毒DNA提取:于BHK细胞接种小鼠多瘤病毒,48 h后反复冻融细胞3次收获病毒,按照病毒DNA抽提试剂盒操作步骤提取病毒DNA,-20°C保存备用。
1.2.2MPyV 基因片段的PCR扩增:PCR反应体积为20 μL,反应液中包括DNA 2 μL,P1、P2上下游引物各1 μL (终浓度为0.4 μM。PCR扩增程序:95℃预变性5 min,94℃变性50 s,60℃退火50 s,72℃延伸90 s,共进行35个循环,72℃延伸10 min,同时设阴性对照。取PCR扩增产物于经溴乙锭预染的1%琼脂糖凝胶电泳检测,5 μL DL 5000 DNA marker作分子量参照,凝胶成像仪下观察结果。
1.2.3MPyV标准质粒的构建:P1、P2扩增的PCR产物(1603 bp)电泳后经胶回收试剂盒回收纯化后TA克隆连接到pMD-T19载体,并转化至DH-5α感受态细胞中,37℃培养过夜,挑取单个菌落,筛选阳性克隆并送立菲生物技术有限公司测序。扩增阳性克隆菌落,提取重组质粒,命名为pMD-T19-MPyV,通过紫外分光光度计测定浓度后,按公式:浓度(拷贝/μL )=[质粒浓度(g/ml) × 6.02 × 1023]/[质粒大小( bp) × 660]计算初始拷贝数,重组质粒于-20°C保存备用。
1.2.4荧光定量PCR反应体系的建立和优化:以质粒pMD-T19- MPyV为模板,用P3、P4及TaqMan探针建立荧光定量PCR检测方法,按照Premix Ex Tag (probe)试剂盒操作说明配制反应体系,分别对引物浓度(0.1~1.0 μmol/L)、探针浓度(0.2~1.0 μmol/L)、退火温度(55~65)℃、循环条件(两步法与三步法)进行条件优化,每个条件3个重复孔,通过比较同一浓度质粒的Ct值,荧光强度来判断最优条件。同时设置BHK细胞DNA为阴性对照,水为空白对照。
1.2.5荧光定量PCR检测方法特异性分析:使用10种感染小鼠病原的DNA或cDNA为模板进行特异性分析,包括:小鼠巨细胞病毒 (MCMV)、小鼠细小病毒MVM株(MVM)、鼠痘病毒 (ECT)、小鼠腺病毒(MAD)、小鼠脑脊髓炎病毒(TMEV)、呼肠孤病毒III型(Reo3)、仙台病毒(SV)、小鼠肝炎病毒 (MHV)、小鼠诺如病毒 (MNV)、小家鼠螺杆菌(H.muridarum),每种病毒2个重复孔。同时设立小鼠多瘤病毒DNA为阳性对照,BHK细胞DNA为阴性对照,水为空白对照。
1.2.6荧光定量PCR检测方法敏感性验证及线性标准曲线的建立:重组质粒pMD-T19-MPyV计算出初始拷贝数后,用超纯水连续10倍梯度稀释至浓度在( 1. 0×101)~( 1. 0×107) 拷贝/μL,取2 μL作为荧光定量PCR模板,反应体系为1.2.4建立的最优条件。
1.2.7实时荧光定量PCR检测方法的重复性分析:取3份阳性感染MPyV的BHK细胞 DNA用该方法测定3次;每次试验每个样本设3个重复孔,计算批内、批间差异,从而对本方法检测的重复性进行考核。
1.2.8实时荧光定量PCR方法在临床实际样本的检测:
1.2.8.1对人工感染MPyV组织样本的检测:人工感染试验在本实验室的屏障环境实验间[SYXK(粤)2012-0122]进行。用MPyV细胞毒(Ct值为28.33)对1日龄BALB/c小鼠进行0.5 μL滴鼻感染,感染后1周再滴鼻感染10 μL,共感染6只;另设2只阴性对照小鼠,滴鼻等量灭菌生理盐水。饲养小鼠至21日龄,断颈处死后收集肺脏、脾脏和粪便,按照DNA抽提试剂盒操作步骤提取样本DNA,用本研究建立的荧光 PCR方法分别对6只攻毒鼠与2只阴性小鼠各组织器官样品进行检测,每份做3个重复检测,观察扩增曲线。
1.2.8.2对临床样品的检测:用建立的荧光PCR方法对来自广东省广州市一家大型实验鼠场的86份送检粪便样品进行了测定,同时设立阳性对照,观察各样品的扩增曲线与Ct值。并用引物对P1/P2 PCR扩增阳性粪便DNA,同时设立阴性对照,凝胶电泳观察结果。
2结果
2.1 重组质粒的鉴定
用引物对P1/P2对构建的重组质粒pMD-T19-MPyV进行PCR扩增, 得到约1 603 bp长度的片段,与预期大小一致,且测序鉴定表明与GenBank登记的序列同源性为100%。经荧光定量PCR引物对P3/P4扩增出的片段长度约为69 bp,条带具有特异性,没有二聚体,结果见图1。提取的重组质粒浓度为117.7 ng/μL。

注:Marker:DL5000;泳道1为P1/P2对构建的重组质粒pMD-T19-MPyV进行PCR扩增, 片段约1603 bp;泳道2为P3/P4对构建的重组质粒pMD-T19-MPyV进行PCR扩增, 片段约69 bp;泳道3为水空白对照。图1 重组质粒pMD-T19-MPyV的PCR鉴定Note.Lane M is 5Kb DNA ladder,lane 1-2 represent PCR results of positive recombinant plasmids using primers P1/P2 and P3/P4, respectively, lane 3 represents blank control.Fig.1 PCR-identified results of the recombinant plasmid pMD-T19-MPyV
2.2 实时荧光定量PCR方法的条件优化
以重组质粒DNA 为模板,通过对引物浓度(0.1~1.0 μmol/L)、探针浓度(0.2~1.0 μmol/L)、退火温度(55~65℃)、循环条件(两步法与三步法)条件的优化,筛选出最佳反应体系如下:上、下游引物终浓度0.4 μmol/L,探针终浓度0.8 μmol/L。反应程序两步法为:95℃ 30 s;95℃ 5 s,60℃ 34 s,40个循环。读板温度为60℃。
2.3 特异性试验
对小鼠多瘤病毒及其他非小鼠多瘤病毒的病原DNA或cDNA进行检测,只有小鼠多瘤病毒DNA出现特异性扩增,在小鼠巨细胞病毒 (MCMV)、小鼠细小病毒MVM株(MVM)、鼠痘病毒 (ECT)、小鼠腺病毒(MAD)、小鼠脑脊髓炎病毒(TMEV)、呼肠孤病毒Ⅲ型(Reo3)、仙台病毒(SV)、小鼠肝炎病毒 (MHV)、小鼠诺如病毒 (MNV)、小家鼠螺杆菌(H.muridarum)、BHK细胞阴性对照及水空白对照组中无扩增(图2)。
2.4 敏感性验证及线性标准曲线的建立
提取的重组质粒浓度为117.7 ng/μL,换算成拷贝数为3.5×1010拷贝/μL,本试验建立的荧光定量PCR方法以107~101拷贝稀释度为模板,样本检测呈现良好的线性关系,相关性为0.999。101拷贝稀释度起峰较晚,重复性较其他稀释度差,故排除,因此本方法判定100个拷贝以上有较好的线性相关性,Ct值大于33.085为阴性,反之为阳性。图3为以样本的拷贝数为横轴,检测的循环数为纵轴,建立的标准曲线。
2.5重复性分析
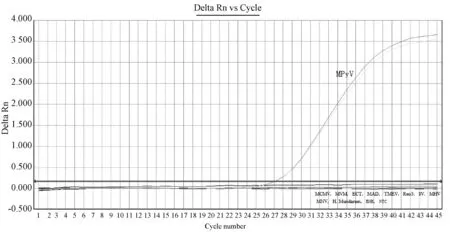
图2 MPyV TaqMan-PCR方法特异性试验结果Fig.2 Specificity evaluation of the TaqMan-PCR method
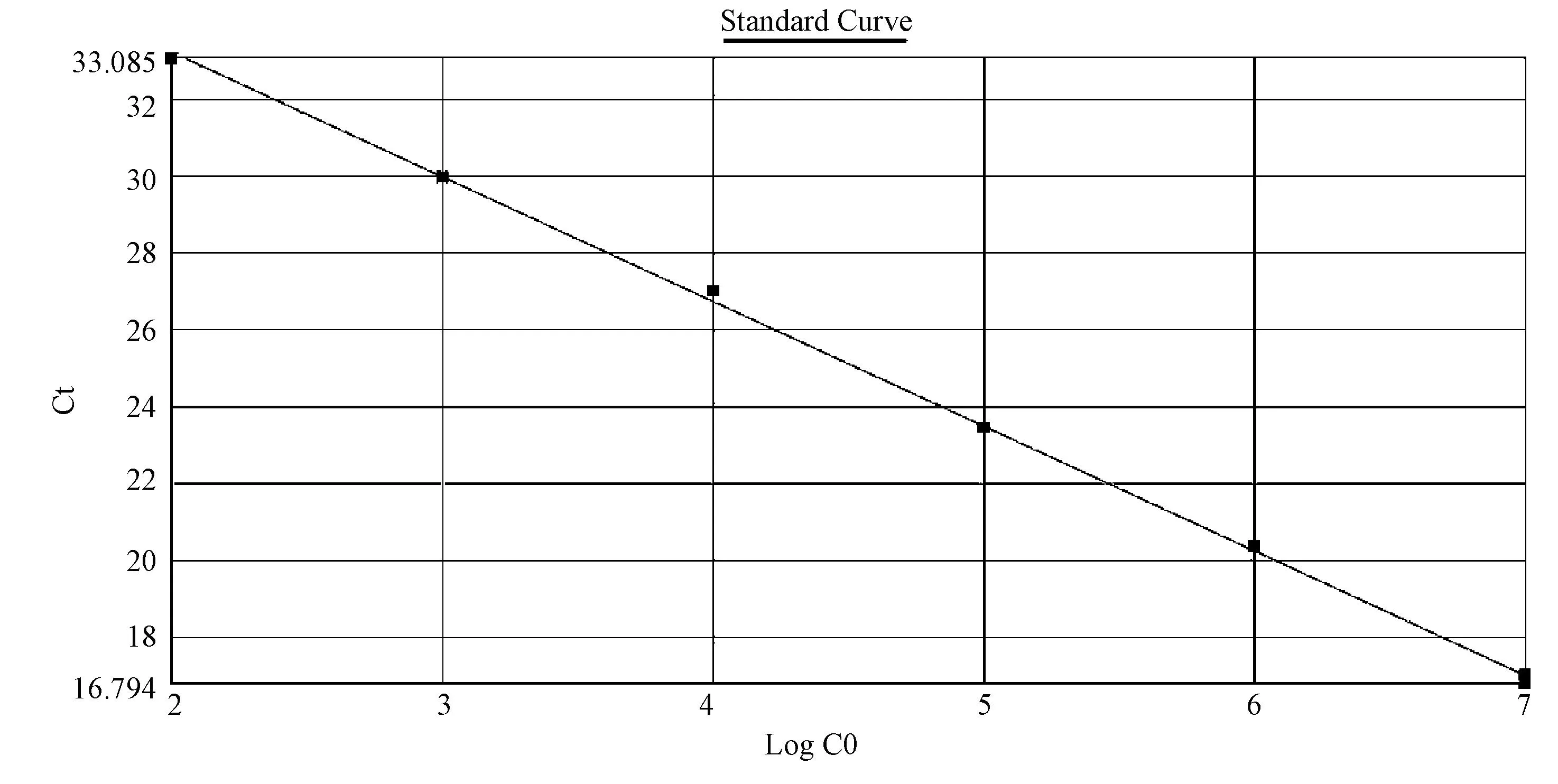
注:从左到右依次为102到107拷贝10倍系列稀释质粒标准品;标准曲线定量线性方程:Y=-3.25x + 39.75,R2 =0.999。图3 荧光定量PCR检测MPyV DNA的标准曲线Note. Standard curve was obtained with serial dilution of the recombinant plasmid from 102 to 107 copies. The quantitative linear equation of the standard curve: Y=-3.25x + 39.75,R2 =0.999.Fig.3 The standard curve of quantitative fluorescence PCR to detect the DNA of MPyV
用荧光定量PCR对3份不同的阳性细胞毒DNA进行重复性检测,每次试验每个样本设3个重复,并对检测结果进行统计学分析, 做出批内批间重复性评价,结果表明批内检测变异系数(CV)均小于0.85%(表1),批间检测变异系数(CV) 均小于1.13%(表2)

表1 阳性样本批内重复性实验

表2 阳性样本批间重复性实验
2.6对人工感染MPyV组织样本的检测
从21日龄的试验感染鼠的组织脏器中检出病毒:6只感染小鼠的肺脏与脾脏的荧光定量 PCR检测均为强阳性(Ct值在21.10~28.61内),且每只小鼠脾脏病毒含量高于肺脏,粪便检测Ct值在22.24~32.97范围内,2只阴性对照小鼠均为阴性。
2. 7临床样品调查结果
用本研究建立的荧光定量PCR方法对广东省广州市一家大型实验鼠场抽样送检的86份粪便样品进行了测定,检出3只小鼠粪便中含有多瘤病毒,引物对P1/P2对此3只粪便DNA进行PCR扩增,凝胶电泳结果显示片段大小为1 603 bp左右,与预期片段大小一致,证实为MPyV阳性。
3讨论
MPyV感染对实验动物本身造成危害,对科研工作造成潜在干扰,且小鼠体内MPyV含量的变化是分析肿瘤发展、免疫反应及疾病表征的重要指标,而病毒感染的病理学研究亦需要一个敏感有效的检测方法。TaqMan探针荧光定量 PCR技术具有较高的灵敏度和特异性,操作简单快速,且后期不需要开盖处理,大大降低了假阳性的发生,因其显著的优越性,已被国内外广泛应用于临床诊断[7,8]。我们根据小鼠多瘤病毒基因组序列(GenBank:AF442959.1)中保守的序列设计引物和探针建立了实时荧光定量PCR检测MPyV病毒DNA方法,该方法只能从含有MPyV病毒的样本中检测出特异性扩增荧光信号,而不与正常组织及小鼠巨细胞病毒等非MPyV病原DNA发生交叉反应,充分证明了其检测的高度特异性。
用荧光定量PCR检测构建的pMD-T19-MPyV重组质粒标准品,在样本DNA为107~102拷贝时呈现良好的线性关系,其定量准确性可达到100拷贝,对应的Ct值为33.085,即Ct值大于33.085判定为阴性,小于33.085判为阳性。重复性分析批内检测变异系数(CV)均小于0.85%,批间检测变异系数( CV) 均小于1.13%,说明方法稳定可靠。且从样本核酸提取到报告结果全程在3小时内即可完成。
经母体垂直传播的7日龄幼鼠体内唾液腺、肾脏、肝脏和脾脏的病毒量最高[9],本研究对1日龄BALB/c小鼠滴鼻0.5 μL MPyV病毒液因不确实病毒是否进入小鼠体内,故于7日龄进行了第二次滴鼻,21日龄时取肺、脾脏及粪便。本研究未能在不同时间点采取组织样本以研究MPyV在小鼠体内载量的变化规律,但通过建立的荧光定量PCR检测结果可知感染后的小鼠在其21日龄均可检出MPyV,且脾脏病毒含量高于肺脏,证明MPyV通过鼻腔进入体内并在体内增殖。同时86个实验小鼠场的粪便检查出3份样品为阳性,说明建立的定量方法能用于人工感染小鼠及临床样本的检测,也为进一步的研究提供了技术支持。佟巍等曾报道用血清学方法及普通PCR方法对北京地区实验小鼠MPyV感染情况进行初步调查,结果表明对实验动物使用机构检出了MPyV[4]。谢军芳[10]也建立了小鼠多瘤病毒的血清学普通PCR检测方法。上述的血清学方法及普通PCR方法虽然能检测小鼠多瘤病毒DNA,但不能定量,而本研究建立的TaqMan探针荧光定量不仅能满足小鼠多瘤病毒临床快速诊断检疫及其分子流行病学调查的需要,还能精确定量,敏感度高,报告结果快,能较好满足MPyV临床快速诊断、日常监测和分子流行病学调查的需要,对实验动物质量检测具有实际应用价值。
参考文献:
[1]Sullivan CS, Sung CK, Pack CD, et al. Murine polyomavirus encodes a microRNA that cleaves early RNA transcripts but is not essential for experimental infection [J]. Virology, 2009, 387(1): 157-167.
[2]Nakamichi K, Takayama-Ito M, Nukuzuma S, et al. Long-term infection of adult mice with murine polyomavirus following stereotaxic inoculation into the brain [J],Microbiol Immunol, 2010, 54(8): 475-482.
[3]Simon C, Klose T, Herbst S, et al. Disulfide linkage and structure of highly stable yeast-derived virus-like particles of murine polyomavirus [J]. J Biol Chem, 2014, 289(15): 10411-10418.
[4]佟巍, 张丽芳, 向志光, 等. 北京地区2011~2012年度实验小鼠POLY病毒感染情况调查与分析 [J]. 中国比较医学杂志, 2013, 23(12): 40-43.
[5]Carroll J, Dey D, Kreisman L, et al. Receptor-binding and oncogenic properties of polyoma viruses isolated from feral mice [J]. PLoS Pathog, 2007, 3(12): e179.
[6]Benjamin TL. Polyoma virus: old findings and new challenges [J]. Virology, 2001, 289(2):167-173.
[7]袁文, 王静, 赵维波, 等. 结合内标的小鼠诺如病毒荧光定量RT-PCR检测方法的建立及应用 [J]. 中国实验动物学报, 2015, 23(1): 50-56.
[8]王静, 张鈺, 闵凡贵, 等. 猴免疫缺陷病毒(SIV)实时荧光定量PCR检测方法的建立 [J]. 中国比较医学杂志, 2013, 23(9): 68-72.
[9]Zhang S, McNees AL, Butel JS.Quantification of vertical transmission of murine polyoma virus by real-time quantitative PCR [J]. J Gen Virol, 2005, 86(10): 2721-2729.
[10]谢军芳. TMEV、Ect、LCMV、POLY和PVM病毒免疫血清制备及ELISA等检测方法的研究 [D]. 硕士学位论文, 中国医学科学院实验动物研究所, 2009, 45-54.
〔修回日期〕2015-04-09
技术方法
quantitative PCR for detection of murine polyomavirus
YIN Xue-qin, YUAN Wen, WANG Jing, HUANG Bi-hong, RAO Dan, WU Miao-li,
ZHU Yu-jun, FENG Sheng-peng, GUO Peng-ju, ZHANG Yu, HUANG Ren
(Guangdong Key Laboratory of Laboratory Animals, Guangdong Laboratory Animals Monitoring Institute,
Guangzhou 510663, China)
【Abstract】ObjectiveTo establish a rapid,specific and sensitive TaqMan real-time fluorescence quantitative PCR assay for detection of murine polyomavirus (MPyV). Methods The specific primers and TaqMan probe were designed based on genome sequence of MPyV. The primers amplified a 69 bp fragment. After optimizing the reaction system and reaction condition, the standard curve was plotted by detecting recombinant plasmid standards. The specificity, sensitivity and reproducibility of this method were evaluated. In addition, samples of lungs, spleens and feces obtained from experimentally infected mice and 86 clinical samples were used to validate the efficacy of this real-time PCR assay. Results The specificity assay showed that this assay could specifically detect MPyV and the sensitivity for MPyV was about 100 copies/well. The coefficients of variation (CV) of both intra-assay and inter-assay were less than 1.13%. All of the samples from experimentally infected mice were positive for MPyV and 3 out of 86 clinical samples were positive by this TaqMan-PCR detection with a positive rate of 3.5%. ConclusionsThe real-time fluorescence quantitative TaqMan-PCR assay established in this study has high specificity, sensitivity and stability. It can be used for clinical diagnosis, routine detection and epidemiological investigation of murine polyomavirus infections.
【Key words】Murine polyomavirus; Real-time fluorescence quantitative PCR; TaqMan probe; Mice
doi:10.3969.j.issn.1671.7856. 2015.006.011
【中图分类号】R-33
【文献标识码】A
【文章编号】1671-7856(2015) 06-0053-06
[通讯作者]黄韧 (1959-),男,研究员,研究方向: 实验动物学和比较医学研究。E- mail: labking@sohu.com。
[作者简介]尹雪琴 (1988-),女,实习研究员,研究方向: 实验动物病毒学。E- mail: yinxueqin.dr@163.com。
[基金项目]国家科技支撑计划 (编号:2013BAK11B01);广东省科技计划项目(编号:2012B010300026)。

