大鼠细小病毒H-1株和KRV株双重PCR检测方法的建立及应用
李晓波,付 瑞,王 吉,卫 礼,王淑菁,岳秉飞,贺争鸣
(中国食品药品检定研究院 实验动物资源研究所,北京 100050)
大鼠细小病毒H-1株和KRV株双重PCR检测方法的建立及应用
李晓波,付瑞,王吉,卫礼,王淑菁,岳秉飞,贺争鸣
(中国食品药品检定研究院 实验动物资源研究所,北京100050)
【摘要】目的建立大鼠细小病毒H-1和KRV株双重PCR方法并对方法进行初步应用。 方法 根据NCBI发表的H-1(NC001358)和KRV(U790330)基因组序列分别设计特异引物,以H-1和KRV 病毒DNA为模板建立双重PCR方法,对方法进行优化后验证方法的敏感性和特异性;经口感染大鼠,分为H-1和KRV单独感染组和混合感染组,感染后第2,4,6,8,10天采集大鼠粪便,第10天处死所有大鼠,采集心、肝、脾、肺、肾和盲肠内容物等组织,用建立的方法对粪便和组织样本进行检测。结果建立的双重PCR方法以H-1和KRV为模板能够分别扩增出183 bp和302 bp 2个条带,敏感性验证显示能够检测到的最低H-1量为3.8 pg/mL,最低KRV量为0.73 pg/mL;在以小鼠微小病毒、犬细小病毒和猫细小病毒为模板时无任何条带扩增出,特异性良好。感染第2天在所有大鼠粪便中均检测到病毒核酸,感染大鼠均无明显临床症状,感染第10天采集组织,H-1在各组织的检出率分别是心50%(4/8),肝50%(4/8),脾62.5%(5/8),肺50%(4/8),肾37.5%(3/8),盲肠内容物62.5%(5/8),且单独感染组检出率高于混合感染组;KRV在各组织的检出率分别是心0(0/8),肝25%(2/8),脾87.5%(7/8),肺12.5%(1/8),肾25%(2/8),盲肠内容物62.5%(5/8),混合感染组检出率高于单独感染组。结论建立的H-1和KRV双重PCR方法能够高效的检测大鼠粪便及组织中的病毒感染,可作为实验动物国家标准的有力补充。
【关键词】大鼠细小病毒;H-1;KRV;双重PCR
大鼠细小病毒(rat parvovirus, RPV)是对实验大鼠危害最为严重的病毒之一,分类上属细小病毒科,细小病毒属。Kilham等[1]从患肿瘤的大鼠体内首次分离到RPV,通常称为Kilham大鼠病毒(Kilham rat virus, KRV);随后Toolan 等[2]从经大鼠传代的人肿瘤细胞系(HEP- 1)分离到得第2株RPV,通常称为H-1病毒,又称 Toolan 病毒。RPV在野生大鼠中有较高的感染率,成年大鼠感染多无临床症状,但感染鼠可通过粪便长期向外排毒,污染饲料、饮水和周围环境,并重新感染易感动物,造成RPV在鼠群中持续存在。RPV还可污染肿瘤移植物和细胞系,对实验研究造成严重干扰[3]。我国实验动物国家标准(GB 14922.2-2011)规定大鼠细小病毒KRV和H-1株为SPF实验大鼠病毒的必检项目[4]。
本实验建立了大鼠细小病毒H-1株和KRV株的双重PCR方法,能够在同一反应体系里同时检测H-1株和KRV株,缩短了检测时间,提高了检测效率。
1材料
1.1试剂
PCR相关试剂购自Takara公司;DNA提取试剂盒为Qiagen公司产品。
1.2病毒毒株
大鼠细小病毒H-1和KRV株、小鼠微小病毒(MVM)、犬细小病毒均为本室保存,猫细小病毒购自ATCC。
1.3SPF大鼠
13只,购自本所动物生产供应室,动物生产许可证号:SCXK(京)2014-0013,使用许可证号:SYXK(京)2011-0008,品系SD,8周龄,雌雄各半。
2方法
2.1引物的设计
根据NCBI发表的大鼠细小病毒H-1株(NC_001358)和KRV株(U790330)基因组序列分别设计特异引物,扩增区域均为病毒的衣壳蛋白,两对引物间无交叉反应(表1)。

表1 大鼠细小病毒双重PCR引物
2.2 病毒DNA的提取
大鼠细小病毒H-1和KRV株C6细胞培养物经3次冻融后,分别取200 μL按试剂盒的操作说明提取DNA,作为双重PCR反应的模板,同时提取各对照病毒DNA。
2.3 PCR反应条件优化
对双重PCR反应体系dNTP浓度、HS Taq酶量、H-1和KRV引物比例、引物浓度及退火温度等进行优化,确定最佳反应条件。
2.4 敏感性测定
紫外分光光度法测定H-1和KRV模板DNA浓度,分别进行10-1~10-10系列稀释,用建立的PCR方法进行扩增,检测方法的灵敏度。
2.5特异性测定
分别以KRV和H-1混合DNA、KRV、H-1、小鼠微小病毒、犬细小及猫细小病毒DNA为模板进行双重PCR扩增,阳性PCR产物送上海生工进行核酸序列测定,验证方法的特异性。
2.6初步应用
12只SPF大鼠分为3组,每组4只,第1组按200 μL/只的剂量经口感染H-1,第2组按同样方式感染KRV,第3组同时感染H-1和KRV,最后1只为阴性对照。感染后第2,4,5,6,10天采集大鼠粪便,加入适量PBS悬浮离心,上清过滤除菌,取200 μL提取DNA进行双重PCR检测。第10天处死所有大鼠,无菌采集心、肝、脾、肺、肾和盲肠内容物等组织,提取DNA后进行检测。
3结果
3.1PCR反应体系及条件
优化后的反应体系为10× PCR buffer 2.5 μL,dNTP 2 μL,2对引物(10 μmol/L)各1 μL,DNA模板2 μL,HS Taq酶0.5 μL,最后加灭菌双蒸水补至25 μL。反应条件为94℃ 30 s,56℃ 30 s,72℃ 30 s,共40个循环,最后72℃延伸7 min。
3.2PCR产物测序
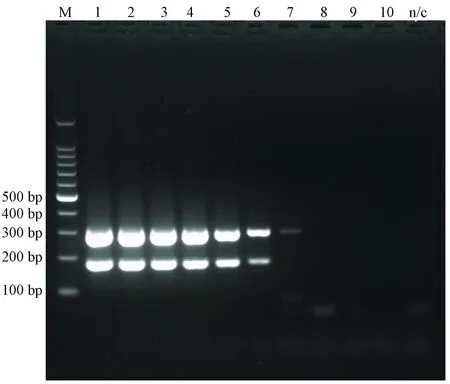
提取H-1和KRV细胞培养物DNA,用建立的双重PCR方法进行扩增,产物送上海生工进行测序,序列经NCBI Blast比对,结果见图1,符合率均为99%。
3.3敏感性测定
紫外分光法测得H-1 DNA模板浓度为384.52 ng/mL,KRV为732.42 ng/mL。由图2可见,单一PCR检测限均为10-7,即单一PCR能够检出的最低浓度分别为H-1 0.38 pg/mL,KRV 0.73 pg/mL;双重PCR检测限为H-1 10-6,KRV10-7,检出的最低浓度为H-13.8 pg/mL,KRV0.73 pg/mL(图3)。
3.4特异性测定
用建立的双重PCR方法分别扩增KRV和H-1混合DNA、单独KRV或H-1、小鼠微小病毒、犬细小及猫细小病毒,结果显示(图4),该双重PCR方法与小鼠细小、犬细小和猫细小均无交叉反应,KRV和H-1相互间也无交叉反应。
3.5初步应用
所有大鼠均无明显临床症状,感染后第2天在感染大鼠的粪便中均检测到相应的目的条带(图5),通过测序证实为相应的病毒;取感染大鼠的心、肝、脾、肺、肾和盲肠内容物等组织进行检测,结果显示H-1在各组织的检出率分别是心50%(4/8),肝50%(4/8),脾62.5%(5/8),肺50%(4/8),肾37.5%(3/8),盲肠内容物62.5%(5/8),单独感染组检出率高于混合感染组;KRV在各组织的检出率分别是心0(0/8),肝25%(2/8),脾87.5%(7/8),肺12.5%(1/8),肾25%(2/8),盲肠内容物62.5%(5/8),混合感染组检出率高于单独感染组。对照小鼠各组织中均未检出H-1或KRV,具体见表2。监测感染大鼠粪便排毒情况,第10天仍能检测到KRV排出(表3)。
4讨论
血清学方法是目前诊断实验大鼠中H-1和KRV感染的常用方法,实验动物国标中规定的血清学方法包括酶联免疫吸附试验(ELISA),免疫酶试验(IEA),免疫荧光试验(IFA)和血凝抑制试验(HIA),ELISA或IFA一般用做大规模的筛查,HIA一般用来做确证试验[4]。ELISA和IFA敏感性较高,但由于细小病毒非结构蛋白比较保守,会产生抗体间的交叉反应,因而方法的特异性较差,同时血清学方法也不适用病毒在动物间急性感染而血清还未发生阳转的情况[5]。PCR方法以其较高的灵敏度和特异性已经广泛应用于病毒的检测,本试验建立了大鼠H-1和KRV的双重PCR检测方法,特异性好,灵敏度高,能够在同一反应体系中同时检测并区分H-1和KRV,与传统的PCR方法[5,6]相比提高了检测效率。

表2 各感染组大鼠组织中病毒的分布情况
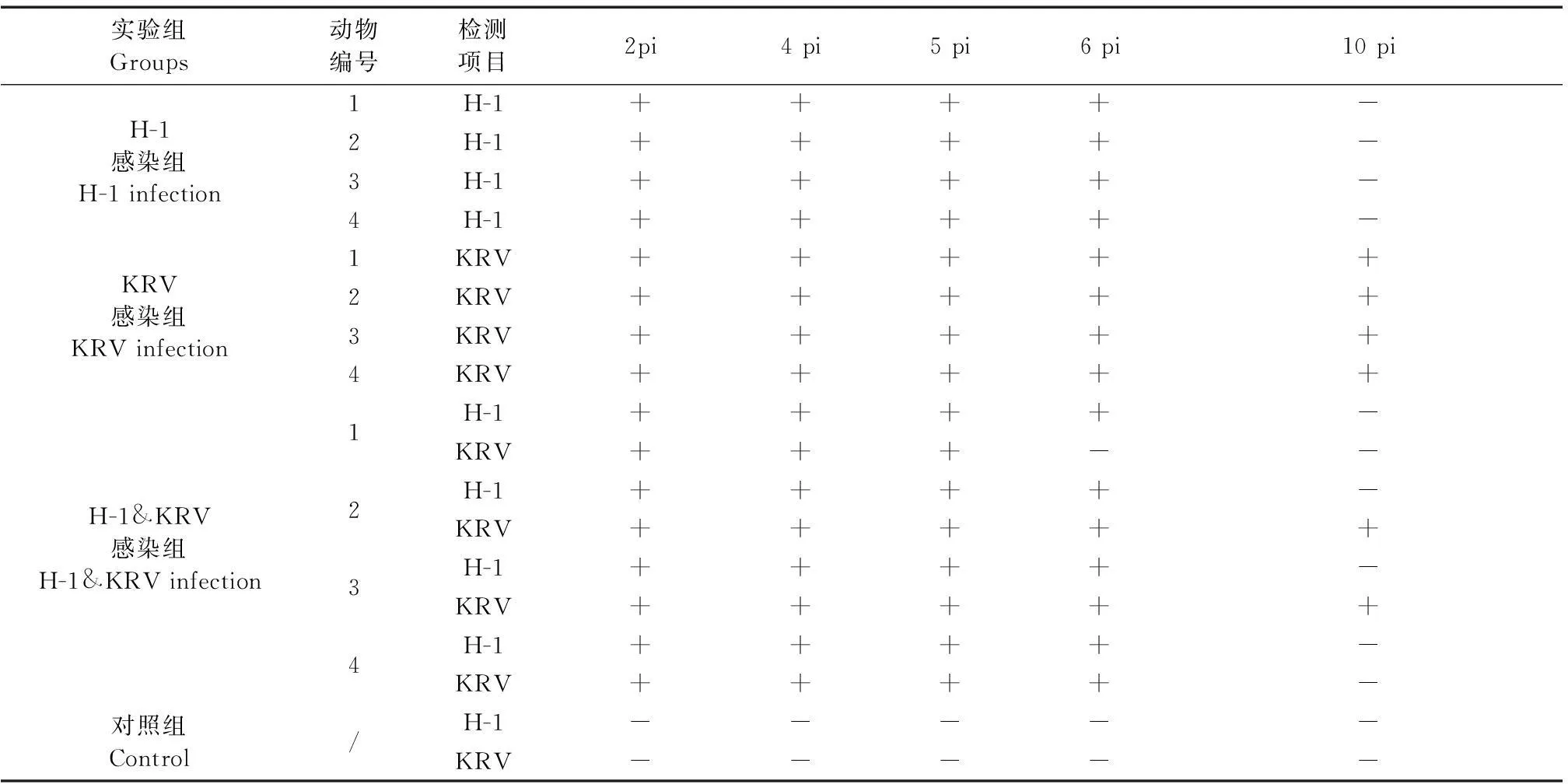
表3 感染后不同时间粪便中病毒监测结果

图1 H-1 and KRV PCR产物测序结果比对Fig.1 Comparison of the BLAST results of PCR products sequencing of H-1 and KRV

A:H-1 B:KRVM:100 bp marker; 1~10: DNA模板分别10-1~10-10稀释图2 单一PCR敏感性结果M: 100 bp marker; 1 to 10: 10-1 to 10-10 dilution of H-1 or KRV DNAFig.2 The sensitivity results of single PCR assay
M:100 bp marker; 1~10: H-1和KRV cDNA模板分别10-1~10-10稀释图3 大鼠细小病毒双重PCR敏感性结果M: 100 bp marker; 1 to10: 10-1 to10-10 dilution of H-1 and KRV DNAFig.3 The sensitivity results of duplex PCR assay of RPV
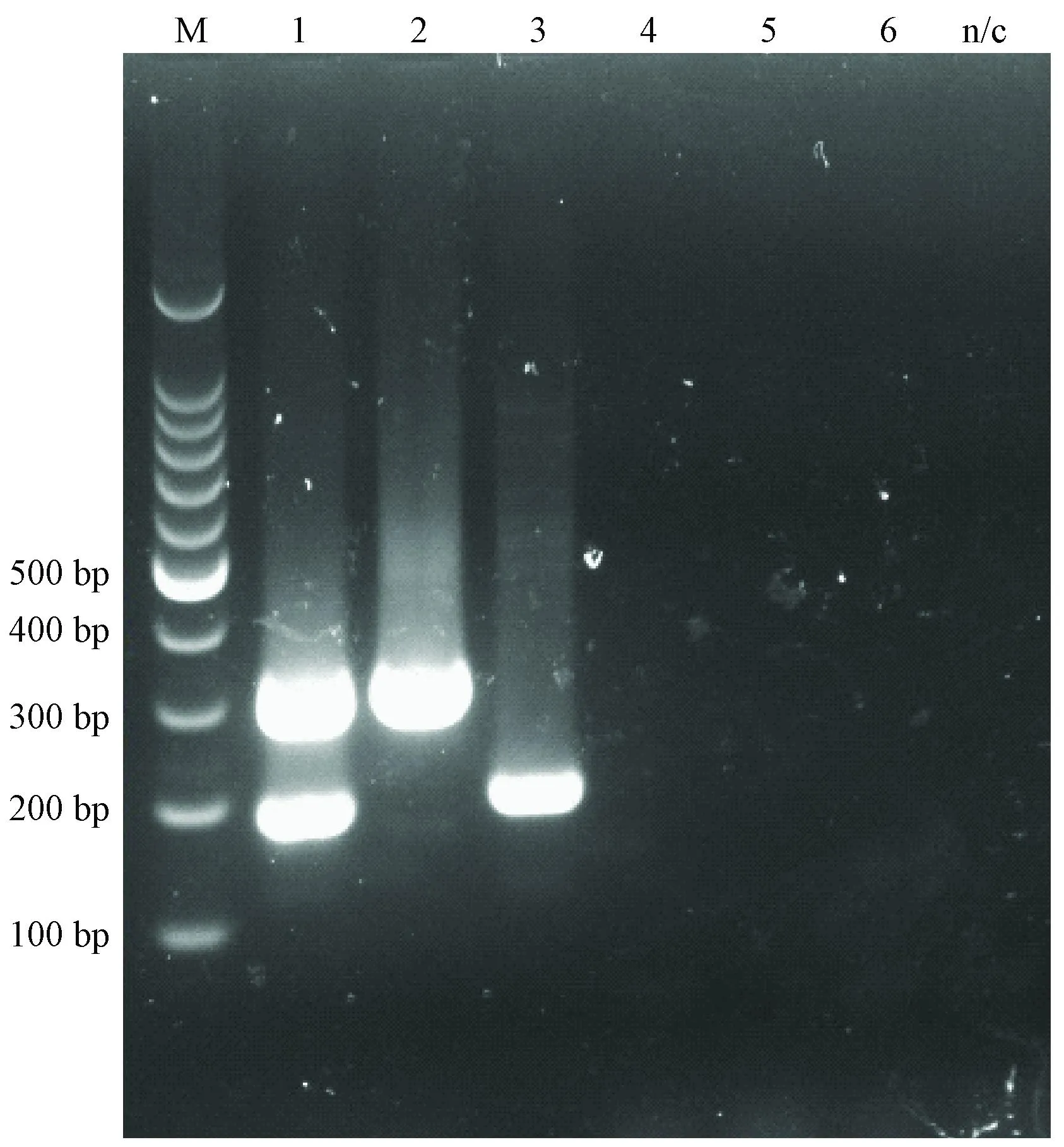
1~6: KRV和H-1混合模板、KRV、H-1、MVM、犬细小、猫细小病毒图4 大鼠细小病毒双重PCR特异性结果1 to 6: KRV and H-1 mixed templete, KRV, H-1, MVM, CPV, FPVFig.4 The specificity results of duplex PCR of RPV
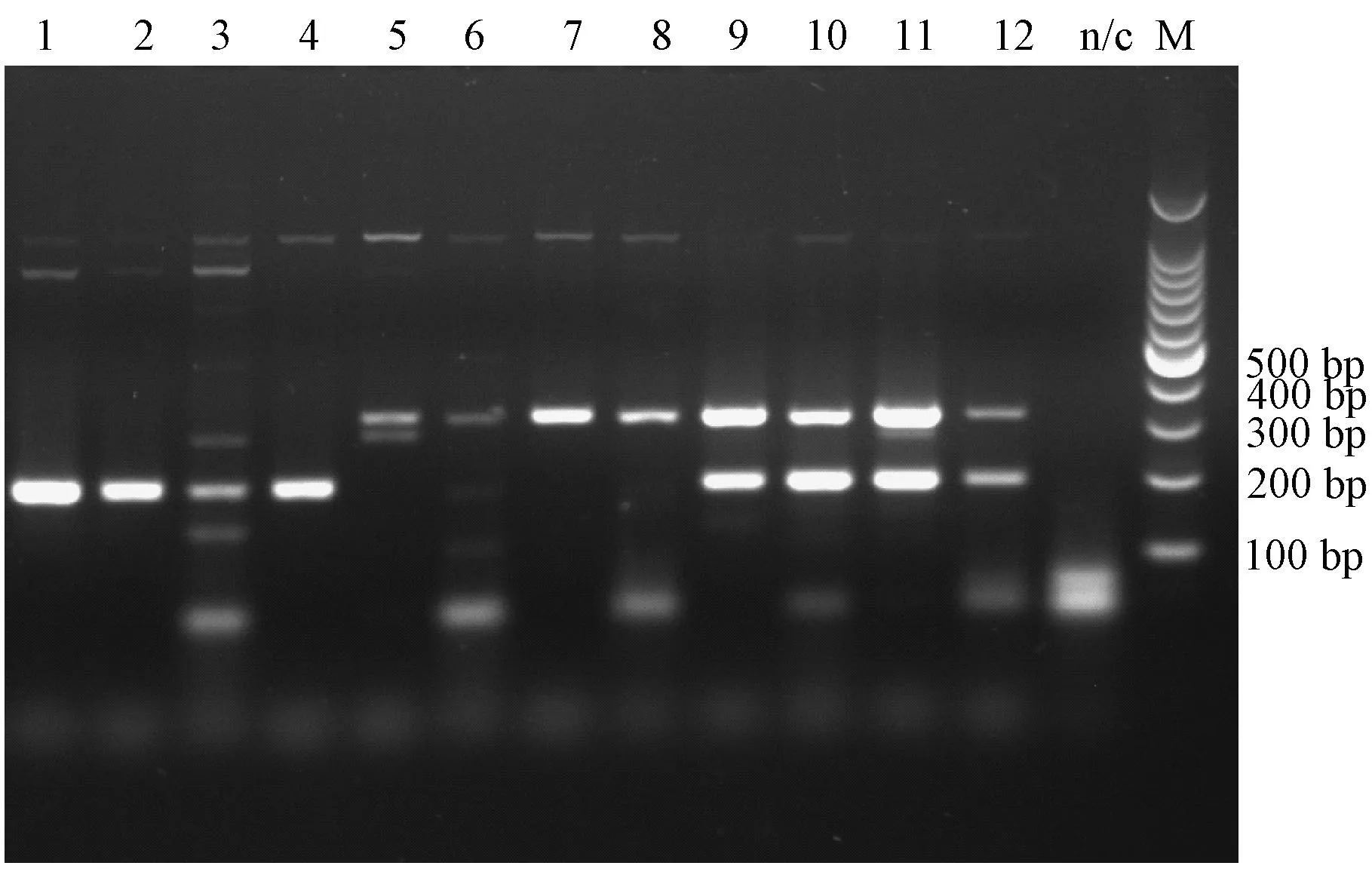
1~4:H-1单独感染组;5~8:KRV单独感染组;9~12:混合感染组图5 感染第2天大鼠粪便中RPV检测结果1 to 4: H-1 infection group; 5 to 8: KRV infection group;9 to 12: H-1 & KRV infection groupFig.5 The results of duplex PCR assay for RPV of rat feces collected on the 2th day
通过比较不同细小病毒毒株的基因组序列,我们选择H-1和KRV特有的区域设计了2对引物,扩增的区域均位于衣壳蛋白基因,每对引物只能特异的扩增相应毒株,与其他毒株无交叉反应,特异性验证显示针对H-1的引物在以H-1 DNA为模板时能够扩增特定大小的单一目的片段,以KRV、MVM及猫、犬等哺乳动物细小病毒为模板无任何条带出现;KRV也同样如此,说明方法的特异性良好。先前报道的PCR方法[7]虽然也能够特异的扩增H-1和KRV,但两者的PCR产物大小相近,电泳不容易区分,无法在同一反应体系中建立双重PCR方法,本试验2对特异引物扩增的片段大小分别为183 bp和302 bp,电泳能够很好的区分,适合在同一反应体系中同时检测H-1和KRV,大大提高了检测效率。
对方法的敏感性测定显示H-1和KRV在单独进行PCR扩增时敏感性相差不大,检测的最小DNA浓度分别为0.38 pg/mL和0.73 pg/mL,而在同一体系进行双重PCR时KRV的敏感性无变化,H-1的敏感性降低了一个数量级,为3.8 pg/mL,即使对双重体系进行优化敏感性仍没有显著提高,如何将两个反应间的影响降至最低是后续方法优化的重点。
大鼠细小病毒感染后可通过粪便长期排毒,我们经口感染大鼠,定期采集粪便用建立的双重PCR方法进行检测,感染第2天即在所有感染大鼠粪便中检出相应病毒,感染大鼠均无明显临床症状,感染第10天仍能够检出KRV,但均未检出H-1,说明KRV在大鼠体内能够持续存在并向外排毒,这与文献报道相符[8];H-1虽然在粪便中未检出,但在大鼠的组织样本中能够检测到,说明H-1可能在大鼠体内潜伏感染。由于实验样本有限,H-1的感染特征还需进一步研究证实。我们还用该方法检测了感染大鼠心、肝、脾、肺、肾和盲肠内容物中病毒的分布情况,结果显示H-1在心、肝、脾、肺、肾和盲肠内容物中均有分布,单独感染组检出率高于H-1&KRV混合感染组;KRV在心组织未检出,在脾中的检出率明显高于其他组织,且混合感染组检出率高于单独感染组,说明H-1的同时感染可能对KRV的感染有协同作用,这有待进一步证实。
考虑到各种影响检测的因素,笔者认为要获得最佳的检测结果,需要注意以下两点:(1)样本采集后最好马上处理,不能马上处理的需-70℃保存,避免反复冻融。(2)由于粪便中杂质较多,有可能存在影响病毒核酸提取的物质,建议采用粪便专用的核酸提取试剂盒,去除粪便中的杂质干扰。本实验未对大鼠血清及全血样本进行检测,不能确定动物是否产生病毒血症及组织器官中病毒为血液来源还是组织特异富集病毒,这需要在后续的实验进行补充。
综上所述,本试验建立的双重PCR方法特异性好,敏感性高,能够高效的检测大鼠粪便及组织中的细小病毒,并且可以用来检测细胞培养物中的病毒污染情况,可作为实验动物国家标准的补充方法。
参考文献:
[1]Kilham L, Olivier LJ. A latent virus of rats isolated in tissue culture [J]. Virology, 1959, 7: 428-437.
[2]Toolan HW, Dalldorf G, Barclay M, et al. An unidentified filterable agent isolated from transplanted human tumors [J].Proc.Natl.Acad.Sci. U S A, 1960, 46: 1256-1259.
[3]田克恭.实验动物病毒性疾病 [M].农业出版社.1992:126-132.
[4]Lindsey JR, Boorman GA, Collins MJ, et al. Multiple systems. In Committee on Infectious Disease of Mice and Rats (ed.), Infectious diseases of mice and rats [M]. National Academy Press, Washington, D.C. 1991, 236-256.
[5]Taylor K, Copley CG. Diagnosis of Kilham rat virus using PCR [J].Lab. Anim, 1993, 28: 26-30.
[6]Wan CH, Bauer BA, pintel DJ, et al. Detection of rat parvovirus type 1 and rat minute virus type 1 by polymerase chain reaction [J]. Lab Anim, 2006, 40(1): 63-69.
[7]Besselsen DG, Besch CL, Pintel DJ, et al. Detection of H-1 parvovirus and Kilham rat virus by PCR [J]. J Clin Microbiol, 1995, 33(7): 1699-1703.
[8]Jacoby RO, Johnson EA, Paturzo FX, et al. Persistent rat parvovirus infection in individually housed rats [J]. Arch Virol, 1991, 117: 193-205.
〔修回日期〕2015-04-20
技术方法
Development and application of duplex PCR for
detection of H-1 and KRV strains
LI Xiao-bo, FU Rui, WANG Ji, WEI Li, WANG Shu-jing, YUE Bing-fei, HE Zheng-ming
(Laboratory Animal Institute, National Institutes for Food and Drug Control, Beijing 100050, China)
【Abstract】ObjectiveTo develop a duplex PCR assay for detection of rat parvovirus H-1 and KRV and its application. Methods To design specific primers on the basis of H-1(NC001358) and KRV(U790330) genome sequences published in NCBI and establish a duplex PCR assay using H-1 and KRV DNA as templates. To verify the sensitivity and specificity of the method after optimizing PCR. The rats were infected by oral inoculation. The rats were divided into three groups: H-1 infection, KRV infection and mixed infection groups. To collect feces at the 4th, 6th, 8th and 10th days postinfection. Rats were euthanized on the 10th day and samples from heart, liver, spleen, lung, kidney and cecal contents were collected from each rat, then all the samples were screened with the duplex PCR. ResultsThe 183 bp and 302 bp bands were amplified using H-1 and KRV as templates. The sensitivity test showed that the PCR method can detect as low as 3.8 pg/mL H-1 and 0.73 pg/mL KRV. There were no bands amplified when mouse minus virus, canine parvovirus and feline parvovirus were used as templates, showing that the specificity of the duplex PCR assay is very good. The nucleic acids of H-1 or KRV were detected in all rat feces on the 2th day postinfection and there was no obvious clinical symptoms in all the infected rats. The positive rates of H-1 were as follows: 50% (4/8) heart tissues, 50% (4/8) liver tissues, 62.5% (5/8) spleen tissues, 50% (4/8) lung tissues, 37.5% (3/8) kidney tissues and 62.5% (5/8) cecum contents, and the positive rate of single infection group was higher than that of mixed infection group. The positive rates of KRV were as follows: 0 (0/8) heart tissues, 25% (2/8) liver tissues, 87.5% (7/8) spleen tissues, 12.5% (1/8) lung tissues, 25% (2/8) kidney tissues and 62.5%(5/8) cecum contents, and the positive rate of mixed infection group was higher than that of single infection group. ConclusionsThe duplex PCR assay for H-1 and KRV established in this study can effectively detect H-1 or KRV infection in rat feces and other tissues, and can be used as an effective supplement to the national standard of lab animals.
【Key words】Rat parvovirus, RPV; H-1; KRV; Duplex PCR; Rats
doi:10.3969.j.issn.1671.7856. 2015.006.010
【中图分类号】R-33
【文献标识码】A
【文章编号】1671-7856(2015) 06-0046-07
[通讯作者]贺争鸣(1957-),研究员,研究方向:实验动物微生物学。E-mail: zhengminghe57@163.com。
[作者简介]李晓波(1980-),助理研究员,研究方向: 实验动物病毒学. E-mail: lxb8493059@163.com。
[基金项目]国家科技支撑计划“实验动物质量监测体系的完善与检测关键技术研究”(2013BAK11B00)。

