mM-CSF及其剪切体重组逆转录病毒表达载体的构建
马翠花,廖金凤,王大刚,刘淑艳,任倩,郑国光( 1秦皇岛市第一医院,河北秦皇岛066000;中国医学科学院血液学研究所血液病医院)
mM-CSF及其剪切体重组逆转录病毒表达载体的构建
马翠花1,2,廖金凤2,王大刚2,刘淑艳2,任倩2,郑国光2
( 1秦皇岛市第一医院,河北秦皇岛066000;2中国医学科学院血液学研究所血液病医院)
摘要:目的构建膜结合型M-CSF( mM-CSF)及其胞内区截短30个氨基酸的剪切体( mM-CSF-Δ)重组逆转录病毒表达载体。方法用DNA重组技术构建并鉴定mM-CSF和mM-CSF-Δ的重组逆转录病毒表达载体MSCVPGK-GFP-mM-CSF、MSCV-PGK-GFP-mM-CSF-Δ,与空载体对照MSCV-PGK-GFP分别转染Phoenix细胞包装病毒,并感染HEK293细胞,通过流式分选术获得3种阳性细胞。结果经Phoenix包装的重组及对照逆转录病毒成功感染HEK293细胞,获得了稳定表达细胞株HEK293-M、HEK293-M-Δ和对照细胞株HEK293-V。RT-PCR以及Western blotting法检测发现HEK293细胞中有mM-CSF和mM-CSF-Δ的表达,HEK293-M细胞和HEK293-M-Δ细胞经流式抗体标记后均能检测到膜蛋白的表达。结论成功构建了mM-CSF及其剪切体的重组逆转录病毒表达载体。
关键词:mM-CSF;剪切体;逆转录病毒表达载体; HEK293细胞系
Construction of membrane-bound macrophage colony-stimulating factor and recombinant retroviral expression vector of spliceosome
MA Cui-hua1,LIAO Jin-feng,WANG Da-gang,LIU Shu-yan,REN Qian,ZHENG Guo-guang
( 1 The First Hospital of Qinhuangdao City,Qinhuangdao 066000,China)
Abstract:Objective To construct membrane-bound macrophage colony-stimulating factor ( mM-CSF) and recombinant retroviral expression vector of brachytmema mutation of 30 amino acide located in the intracellular region of mM-CSF ( mM-CSF-Δ).Methods The retroviral vectors MSCV-PGK-GFP-mM-CSF and MSCV-PGK-GFP-mM-CSF-Δ were constructed and identified by DNA recombinant techniques.Recombinant and empty vectors were used to transfect the packaging Phoenix cells.HEK293 cells were infected by the viral supernatants.After being sorted by flow cytometry,three positive cell lines were obtained.Results HEK293 cells were successfully infected by retroviruses in packaging Phoenix cells and control retrovirus.Stable expressing cell lines,HEK293-M and HEK293-M-Δ as well as control cell line HEK293-V,were established.The expression of mM-SCF and mM-CSF-Δ was detected by RT-PCR and Western blotting in HEK293 cells and its membrane protein expression was also detected by flow cytometry.Conclusion The mM-CSF and recombinant retroviral expression vector of spliceosome were successfully constructed.
Key words:membrane-bound macrophage colony-stimulating factor; spliceosome; retroviral expression vector; HEK293 cell line
巨噬细胞集落刺激因子( M-CSF)是造血系统细胞因子调控网络中的一个重要成员,是一个多功能的细胞因子,经选择性剪接可形成膜结合型M-CSF ( mM-CSF)。mM-CSF在霍奇金淋巴瘤和髓系白血病细胞中高表达[1],可与相邻细胞膜表面的M-CSF受体作用,形成并置性刺激[2],调节单核/巨噬细胞的增殖、分化等。本实验构建了mM-CSF及其胞内区截短30个氨基酸剪切体( mM-CSF-Δ)的重组逆转录病毒表达载体,并感染HEK293细胞系,为研究mM-CSF胞内区及胞外区的作用机制奠定基础。
1 材料与方法
1.1主要材料和试剂E.coli DH5α菌株、人mMCSF-Δ表达质粒pTARGET-mM-CSF-Δ、人mM-CSF表达质粒pTARGET-mM-CSF、MSCV-PGK-GFP质
粒、Phoenix包装细胞、HEK293细胞系均由天津市血液学研究所惠赠。DMEM培养基购自Gibco公司,脂质体LipofectamineTM2000购自美国Invitrogen公司,Ex Taq DNA聚合酶、T4DNA连接酶、PyrobestTMDNA聚合酶、质粒提取和胶回收试剂盒均购自TaKaRa公司,PCR扩增引物的合成与DNA测序均由上海生工公司完成。Anti-M-CSF抗体购自Santa公司,APC-anti-rabbit二抗为Biolegend公司产品。
1.2重组逆转录病毒表达载体的构建选取逆转录病毒表达载体MSCV-PGK-GFP载体MCS处双酶切位点( XhoⅠ和BglⅡ)用以插入目的基因,分别以pTARGET-mM-CSF和pTARGET-mM-CSF-Δ质粒为模板,用mM-CSF( Forward为5'-ATACTCGAGTGC CCGTATGACCGCGCCG-3',Reverse为5'-GGCAGATCTCTACACTGGCAGTTCCACC-3';片段长度为771 bp)和mM-CSF-Δ( Forward为5'-ATACTCGAGTGCCCGTATGACCGCGCCG-3',Reverse为5'-GGCAGATCTCTACCGCCGCCTCCACCTGT-3';片段长度为681 bp)的克隆引物进行PCR,反应条件均为94℃预变性5 min; 94℃变性45 s、56℃退火45 s、72℃延伸1 min,30个循环后72℃延伸7 min结束反应。胶回收、连接、转化感受态方法如文献[3]报道,阳性质粒酶切鉴定,并进行DNA测序。PCR鉴定重组质粒插入片段长度均正确,用XhoⅠ和BglⅡ双酶切进行鉴定,结果能切除长度相符的目的片段,测序结果与GenBank公布的序列( NC_000001.11)完全一致。成功构建的载体分别命名为MSCV-PGK-GFP-mMCSF和MSCV-PGK-GFP-mM-CSF-Δ。
1.3细胞培养与逆转录病毒包装Phoenix细胞和HEK293细胞均培养于含10%胎牛血清( FBS)的DMEM培养基内,每3 d换液1次,0.25%胰酶消化传代,倒置显微镜下观察。病毒的包装转染前1 d,将处于对数生长期的Phoenix细胞以6×106/皿的密度消化传代于10 cm培养皿中培养,观察细胞融合至90%、状态良好时换液4 mL,按照LipofectamineTM2000说明进行操作,将MSCV-PGK-GFP-mMCSF、MSCV-PGK-GFP-mM-CSF-Δ和空载体MSCVPGK-GFP质粒分别转染上述Phoenix细胞,6 h后换液8 mL,转染后48、72 h,显微镜观察显示几乎所有的Phoenix细胞都表达GFP标记蛋白,收集病毒上清,0.45 μm滤器过滤后,-80℃保存。
1.4细胞感染及阳性细胞的筛选实验分三组进行,将上述携带MSCV-PGK-GFP-mM-CSF、MSCVPGK-GFP-mM-CSF-Δ和空载体MSCV-PGK-GFP的病毒分别感染HEK293细胞。收集处于对数生长期的HEK293细胞,以1×106个/孔的密度接种于6孔板中,37℃、5%CO2孵箱中培养24 h后感染(方法详见本室文献[3]),感染72 h后,荧光显微镜下观察HEK293细胞GFP表达阳性率约60%,消化传代并将细胞移至培养瓶中,每2 d换液1次,除去坏死细胞碎片。培养3代以后,将细胞制备成单细胞悬液,以GFP作为分选标志,流式细胞仪分选纯化,获得的3种>95% GFP阳性细胞,分别命名为HEK293-M、HEK293-M-Δ和对照细胞株HEK293-V。
1.5阳性细胞株中的基因表达及蛋白定位鉴定应用RT-PCR及Western blotting鉴定稳定表达的细胞株。收集HEK293-M、HEK293-M-Δ和对照细胞株HEK293-V,用RT-PCR检测mM-CSF基因。按产品说明书,用TRIzol提取细胞总RNA,并用MML-V反转录酶将1 μg总RNA反转录为cDNA,以甘油醛三磷酸脱氢酶( GAPDH)为内参( Forward为5'-GAAGGTGAAGGTCGGAGTC-3',Reverse为5'-GAAGATGGTGATGGGATTTC-3';片段长度为226 bp),取2 μL进行PCR,进行25个循环,具体反应条件同1.2所述,产物经琼脂糖凝胶电泳。收集HEK293-M、HEK293-M-Δ和HEK293-V细胞各5×106个,分别加入裂解液提取总蛋白。样品经10% SDS-PAGE分离后,电转至PVDF膜上,5%脱脂奶4℃封闭过夜,1∶200稀释M-CSF抗体室温孵育2 h,洗膜后1∶2 000稀释二抗室温孵育1 h,最后在暗室中以化学发光法显色,X线片曝光。应用流式细胞术分析蛋白定位。收集HEK293-M、HEK293-M-Δ和HEK293-V细胞各1×106个,分别经PBS磷酸缓冲液稀释后,1∶100稀释M-CSF抗体4℃孵育20 min;洗涤后1∶100稀释二抗( APC标记) 4℃孵育20 min;洗涤后流式细胞仪分析。
2 结果
RT-PCR以及Western blotting法均能检测到HEK293细胞中mM-CSF和mM-CSF-Δ的表达(见图1),HEK293-M细胞和HEK293-M-Δ细胞经流式抗体标记后均能检测到膜蛋白的表达。
3 讨论
M-CSF为单基因编码的二聚体蛋白,经选择性剪接,可形成mM-CSF、分泌型CSF( sM-CSF)和基质型CSF( PG-M-CSF) 3种形式的蛋白[4],其受体均为c-fms原癌基因编码的跨膜糖蛋白[5]。mM-CSF由于其前体缺乏相应的蛋白酶切位点而形成膜结合型分子,不仅可以通过异常活化巨噬细胞促进血液系统恶性肿瘤的发展[6],而且在乳腺癌、甲状腺癌、前列腺癌中也发挥重要作用[7~9]。
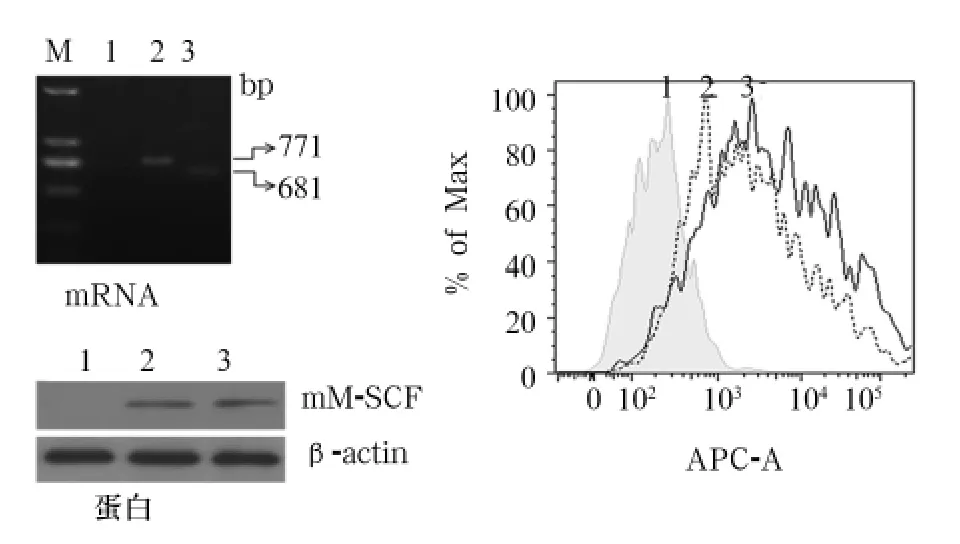
图1 HEK293细胞中mM-CSF和mM-CSF-Δ的表达检测
近年来,膜结合型细胞因子作为配体参与细胞通信受到广泛关注。当膜结合型配体与细胞膜上相应的受体结合后,膜结合型的配体可以向其所在的细胞内传递反向信号[10,11],从而影响血管新生及血管生成、免疫细胞的发育成熟、T/B细胞的活化及细胞的凋亡等。膜结合型的TNF-α可与NK细胞表面的TNF受体2作用,活化胞内NF-κB信号通路,刺激GM-CSF分泌,调节免疫反应[12]。应用逆转录病毒载体介导膜结合型IL-15( mIL-15)在NK细胞表面表达,发现mIL-15可以以自分泌的方式激活胞内抗凋亡信号通路,发挥抗肿瘤效应[13]。mM-CSF作为膜结合型配体,其在细胞通信及胞内胞外区发挥作用的机制为我们关注的焦点。
逆转录病毒载体是目前研究最多的一类RNA病毒载体,其可转染细胞范围广,效率高,并可将目的基因整合到受体细胞基因组中,使目的基因得以稳定高效的表达,被认为是比较理想的转基因载体[14,15]。逆转录病毒表达载体MSCV-PGK-GFP是由1.3 kb的PGK-GFP代替MSCV载体中的neo基因改造而成,GFP标签的引入不仅便于观察,而且提高了阳性细胞的分选效率。本研究通过酶切和亚克隆技术成功构建了重组逆转录病毒表达载体MSCV-PGK-GFP-mM-CSF和MSCV-PGK-GFP-mMCSF-Δ,通过转染及筛选产生高滴度逆转录病毒颗粒,分别感染得到稳定表达mM-CSF及mM-CSF-Δ 的HEK293细胞株,为下一步研究奠定了基础。
参考文献:
[1]Rao Q,Zheng GG,Li G,et al.Membrane-bound macrophage colony-stimulating factor mediated auto-juxtacrine downregulates matrix metalloproteinase-9 release on J6-1 leukemic cell[J].Exp Biol Med,2004,229( 9) : 946-953.
[2]Zheng G,Rao Q,Wu K,et al.Membrane-bound macrophage colony-stimulating factor and its receptor play adhesion molecule-like roles in leukemic cells[J].Leuk Res,2000,24( 5) : 375-383.
[3]刘淑艳,王大刚,胡林萍,等.干细胞因子逆转录病毒表达载体的构建及体外性质研究[J].医学分子生物学杂志,2010,7 ( 2) : 121-125.
[4]Cerretti DP,Wignall J,Anderson D.Human macrophage-colony stimulating factor: alternative RNA and protein processing from a single gene[J].Mol Immunol,1988,25( 8) : 761-770.
[5]Sherr CJ,Rettenmier CW,Sacca R,et al.The c-fms proto-oncogene product is related to the receptor for the mononuclear phagocyte growth factor,CSF-1[J].Cell,1985,41( 3) : 665-676.
[6]Wang L,Zheng GG,Ma CH,et al.A special linker between macrophage and hematopoietic malignant cells: membrane form of macrophage colony-stimulating factor[J].Cancer Res,2008,68( 14) : 5639-5647.
[7]Aharinejad S,Salama M,Paulus P,et al.Elevated CSF1 serum concentration predicts poor overall survival in women with early breast cancer[J].Endocr Relat Cancer,2013,20( 6) : 777-783.
[8]Ryder M,Gild M,Hohl TM,et al.Genetic and pharmacological targeting of CSF-1/CSF-1R inhibits tumor-associated macrophages and impairs BRAF-induced thyroid cancer progression[J].PLoS One,2013,8( 1) : e54302.
[9]Xu J,Escamilla J,Mok S,et al.CSF1R signaling blockade stanches tumor-infiltrating myeloid cells and improves the efficacy of radiotherapy in prostate cancer[J].Cancer Res,2013,73 ( 9) : 2782-2794.
[10]Derer S,Till A,Haesler R,et al.mTNF reverse signalling induced by TNFα antagonists involves a GDF-1 dependent pathway: implications for Crohn's disease[J].Gut,2013,62( 3) : 376-386.
[11]Juhász K,Zvara A,Lipp AM,et al.Casein kinase 2-interacting protein-1,an inflammatory signaling molecule interferes with TNF reverse signaling in human model cells[J].Immunol Lett,2013,152( 1) : 55-64.
[12]Tufa DM,Chatterjee D,Low HZ,et al.TNFR2 and IL-12 coactivation enables slanDCs to support NK-cell function via membranebound TNF-α[J].Eur J Immunol,2014,44( 12) : 3717-3728.
[13]Imamura M,Shook D,Kamiya T,et al.Autonomous growth and increased cytotoxicity of natural killer cells expressing membranebound interleukin-15[J].Blood,2014,124( 7) : 1081-1088.
[14]郭冬梅,李玉娟,李纯璞,等.Notch1活化对骨髓瘤细胞株RPMI8226增殖及药物敏感性的影响[J].山东医药,2012,52 ( 27) : 14-16.
[15]常晶,陆菡,薛庆生,等.人SUMO病毒载体构建及稳转神经母细胞瘤SHSY5Y细胞系的建立[J].山东医药,2013,53( 10) : 1-3.
收稿日期:( 2015-03-09)
通信作者简介:郑国光( 1967-),男,博士,研究员,主要研究方向为血液细胞生物学、分子生物学。E-mail: zhengggtjchn@ aliyun.com
作者简介:第一马翠花( 1981-),女,博士,助理研究员,主要研究方向为分子生物学。E-mail: michellemch@163.com
基金项目:国家自然科学基金资助项目( 81370634)。
文章编号:1002-266X( 2015) 31-0005-03
文献标志码:A
中图分类号:R737.33
doi:10.3969/j.issn.1002-266X.2015.31.002

