5-氮-2′-脱氧胞苷对肺癌A549细胞凋亡及范可尼贫血互补基团F表达的影响
余宗涛, 张吉才, 高 琼, 高 波, 胡春卉
5-氮-2′-脱氧胞苷对肺癌A549细胞凋亡及范可尼贫血互补基团F表达的影响
余宗涛1,张吉才1,高琼2,高波1,胡春卉1
(1. 湖北医药学院附属十堰市太和医院检验科,湖北 十堰 442000;
2. 湖北医药学院附属十堰市太和医院呼吸内科,湖北 十堰 442000)
摘要:目的探讨5-氮-2′-脱氧胞苷(5-Aza-CdR)对人肺癌A549细胞凋亡及抑癌基因范可尼贫血互补基团F(FANCF)基因表达的影响。方法以浓度为0.5、5、50 μmol/L的5-Aza-CdR处理人肺癌细胞株A549,常规培养采用四唑盐(MTT)比色法观察细胞的生长活性,甲基化特异性聚合酶链反应(PCR)检测FANCF基因甲基化状态;以荧光定量PCR检测FANCF mRNA的表达,并用流式细胞仪检测细胞凋亡率。结果5-Aza-CdR能明显抑制肿瘤细胞的生长,细胞增殖抑制率(CPIR)随5-Aza-CdR浓度和作用时间的不同而变化,呈剂量依赖性(P<0.005)和时间依赖性(P<0.001);药物处理后FANCF mRNA表达明显升高,细胞凋亡率与5-Aza-CdR剂量呈正相关(r=0.998, P<0.05)。结论5-Aza-CdR能使FANCF基因去甲基化,促进细胞凋亡,增强抑癌功能,但同时有增加顺铂耐药的风险。
关键词:范可尼贫血互补基团F基因;甲基化;5-氮-2′-脱氧胞苷;A549细胞;凋亡
Influence of 5-Aza-CdR on the apoptosis of lung cancer A549 cell and the expression ofFANCFgeneYUZongtao1,ZHANGJicai1,GAOQiong2,GAOBo1,HUChunhui1
.(1.DepartmentofClinicalLaboratory,TaiheHospital,HubeiUniversityofMedicine,HubeiShiyan442000,China; 2.DepartmentofRespiratoryMedicine,TaiheHospital,HubeiUniversityofMedicine,HubeiShiyan442000,China)
Abstract:ObjectiveTo investigate the influence of 5-Aza-2′-deoxycytidine(5-Aza-CdR) on the apoptosis of lung cancer A549 cell and the expression of Fanconi anemia complementation group F(FANCF) gene. MethodsA549 cells were treated with 5-Aza-CdR(0.5, 5 and 50 μmol/L, respectively). The growth of A549 cells was observed by 3-(4,5-dimethylthiazol)-3,5-diphenyltetrazolium bromide(MTT) assay. The methylation status of FANCF gene was observed by methylation specific polymerase chain reaction(PCR). The expression of FANCF mRNA was observed by fluorescence quantitation PCR. The apoptosis rate of A549 cells was analyzed by flow cytometry. ResultsA549 cells treated with 5-Aza-CdR displayed a slow growth. The rate of cell proliferation inhibiting (CPIR) for A549 cells changed with the concentration and treatment time of 5-Aza-CdR (P<0.005, P<0.001). FANCF mRNA expression increased after treatmert. The apoptosis rates after treatment had a positive correlation with 5-Aza-CdR dose (r=0.998, P<0.05). Conclusions5-Aza-CdR can induce the apoptosis of A549 cells by inducing demethylation and thereby enchancing FANCF gene, enhancing tumor suppressor function, but it can increase the risk of resistance to cisplatin.
Key words:Fanconi anemia complementation group F gene; Methylation; 5-Aza-2′-deoxycytidine; A549 cell; Apoptosis
对于肺癌术后及不能手术的肺癌患者,化疗是重要的治疗手段,而化疗耐药是临床面临的重要难题。最近研究证实,肿瘤抑制基因异常表达不仅在肿瘤形成过程中具有重要作用,而且对化疗耐药也有重要影响。目前顺铂在肺癌化疗治疗中占有重要地位,顺铂的主要靶点是DNA,其引起DNA交联损伤和断裂,干扰DNA复制和转录,导致肿瘤细胞死亡,而DNA损伤修复能力则是肿瘤细胞对铂类耐药的重要分子基础。近年研究显示,范可尼贫血(Fanconi anemia, FA)途径在DNA交联损伤中发挥了重要作用[1],范可尼贫血互补基团F(Fanconi anemia complementation group F,FANCF)基因可激活FA/乳腺癌(breast carcinoma,BRCA)易感基因途径功能蛋白,进而实施DNA交联损伤的修复[2],因此FA/BRCA途径参与了肿瘤细胞对顺铂的耐药机制。甲基化是引起FANCF基因功能缺失的主要机制之一,而FANCF基因在肺癌A549细胞系中存在异常甲基化,我们实验观察了DNA甲基转移酶抑制剂5-氮-2′-脱氧胞苷(5-Aza-2′-deoxycytidine,5-Aza-CdR)处理前后肺癌A549细胞的增殖活性、凋亡及FANCF基因甲基化状态和mRNA表达水平变化,旨在探讨DNA甲基转移酶抑制药物在治疗由异常甲基化致使基因失活而导致肺癌发生、发展及化疗药物耐药中的作用及机制。
材料和方法
一、材料
人肺腺癌细胞株(A549)及人肺腺癌细胞顺铂耐药株(A549/DDP)细胞系(武汉大学细胞库);5-Aza-CdR和二甲亚砜(sigma-aldrich corporation,美国);RPMI1640培养基(Life Technologies Corporation,Gibco, 美国);Trizol试剂(Life Technologies Corporation,Invitrogen,美国);A3500逆转录试剂盒(Promega Corporation,Madison,WI,美国);聚合酶链反应(polymerase chain reaction,PCR)扩增试剂盒(上海生物工程股份有限公司);FANCFmRNA、FANCF甲基化及非甲基化、GAPDHmRNA引物合成见表1(北京赛百盛基因技术有限公司);酶标仪PHomo(郑州安图生物工程股份有限公司);PE7500(Life Technologies Corporation,美国);XL流式细胞仪(Beckman-Coulter Corporation,美国);碘化丙啶(北京泛博生物化学有限公司);核糖核酸酶(北京华美生物工程有限公司);Marker(MD109,北京天根生化科技有限公司)
二、方法
1. 细胞培养将A549/DDP细胞置于含10%胎牛血清的RPMI1640培养基中,37℃、5% CO2条件下培养。细胞传代24 h后,分别加入0.5、5和50 μmol/L(终浓度)的5-Aza-CdR继续培养,24、48和72 h后分别收集细胞进行后续试验。

表1 FANCF甲基化、非甲基化、mRNA及GAPDH mRNA引物序列
2. 细胞增殖活性检测采用四唑盐[3-(4,5)-dimethylthiazol-3,5-diphenyltetrazolium bromide,MTT]比色法。取对数生长期细胞,每孔200 μL培养液(约含2×103个细胞)接种于96孔培养板,共接种5板,每组6孔,接种24 h后弃上清,加入含5-Aza-CdR浓度为0.5、5和50 μmol/L的培养液放入37℃、5%CO2培养箱继续培养,于24、48和72 h分别取一板,每孔加入MTT溶液(5 g/L)20 μL,继续培养4 h,终止培养,去除孔内上清液,每孔加入二甲亚砜,震荡10 min,在酶标仪上于570 nm处测各孔吸光度(A)值。增殖能力以平均A值分析,绘制细胞增殖活性曲线,以未加5-Aza-CdR干预的细胞为阴性对照。细胞增殖抑制率(cellular proliferation inhibition rate, CPIR)=(对照组A均值-试验组A均值)/对照组A均值×100%。
3. 细胞凋亡率检测采用流式细胞术检测细胞凋亡率。细胞传代24 h后弃上清加入含5-Aza-CdR浓度为0.5、5和50 μmol/L培养液,待72 h后分别回收细胞,以胰酶消化离心收集细胞,磷酸盐缓冲液(phosphate buffered saline,PBS)洗涤3次,70%冰乙醇-20℃过夜固定,离心去固定液,再用4℃预冷PBS洗涤2次,核糖核酸酶(ribonuclease,RNaseA,终浓度0.1 g/L)37℃温育30 min,加入0.05 g/L碘化丙啶1 mL,4℃避光染色30 min后上机检测,测定细胞凋亡率。
4.FANCFmRNA表达测定采用荧光定量-逆转录-聚合酶链反应(polymerase chain reaction, PCR)测定,收集各试验组细胞,加入1 mL TrizolRNA提取液提取RNA,再用逆转录试剂盒A3500逆转录RNA为cDNA,以甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase, GAPDH)为内对照,测定FANCFmRNA相对含量。FANCFmRNA/GAPDHmRNA=(1+EGAPDH)Ct(GAPDH)/(1+EFANCF)Ct(FANCF),EGAPDH及EFANCF为PCR扩增效率。
5. 甲基化特异性PCR检测FANCF基因甲基化状态提取的基因组DNA取4 μg,经变性、碱基修复、脱盐回收、脱去磺化基团以及预冷酒精回收等步骤收集修饰后的DNA用于PCR扩增。扩增体系:2 mmol/L dNTP 1.5 μL、25 mmol/L Mg2+2.4 μL、5 U/μL Taq 0.3 μL、10×Buffer 3 μL、上下游引物各2 μL、样本5 μL,10×SYBR-GreenⅠ1.5 μL,用无菌水补齐体积共30 μL。反应条件:94℃预变性5 min;95℃ 45 s,55℃ 45 s,72℃ 1 min,共30个循环;最后一循环于72℃ 8 min。同时测定其熔点曲线。甲基化与非甲基化判断标准:甲基化特异引物对有扩增目标片段者(153 bp)为甲基化;未甲基化特异引物对有扩增目标片段且甲基化特异引物对无扩增目标片段者(153 bp)为未甲基化[5-6]。
三、统计学方法
采用SPSS 19.0统计软件进行统计分析,多组间比较采用方差分析,两两比较用SNK法检验,以P<0.05为差异具有统计学意义。
结果
一、 MTT试验检测5-Aza-CdR对A549细胞增殖的影响
随着5-Aza-CdR浓度的增加,CPIR逐渐增强(P<0.05);随着培养时间的延长,CPIR亦逐渐增强(P<0.001)。见表2。

表2 不同浓度的5-Aza-CdR培养不同时间
注:与5-Aza-CdR 5 μmol/L组比较,*P<0.05;与5-Aza-CdR 50 μmol/L组比较,#P<0.05;与培养48 h比较,△P<0.001;与培养72 h比较,▲P<0.001
二、 5-Aza-CdR干预前后细胞凋亡率的变化
经不同浓度5-Aza-CdR诱导72 h后,对照组(5-Aza-CdR 0 μmol/L组)A549细胞凋亡率为(2.5±0.34)%;5-Aza-CdR 0.5 μmol/L组为(13.37±0.26)%;5-Aza-CdR 5 μmol/L组为(23.77±1.62)%;5-Aza-CdR 50 μmol/L组为(39.38±1.54)%。各组间两两比较差异具有统计学意义(P<0.001)。相关性分析显示细胞凋亡率与5-Aza-CdR剂量呈正相关(r=0.998,P<0.05)。
三、不同浓度5-Aza-CdR处理A549细胞后FANCFmRNA表达情况
以0 μmol/L组为对照,随着5-Aza-CdR浓度的增加,A549细胞中FANCFmRNA表达量相应增加(P<0.001);随着培养时间的延长,FANCFmRNA表达量相应增加,但差异无统计学意义(P>0.05)。见表3。
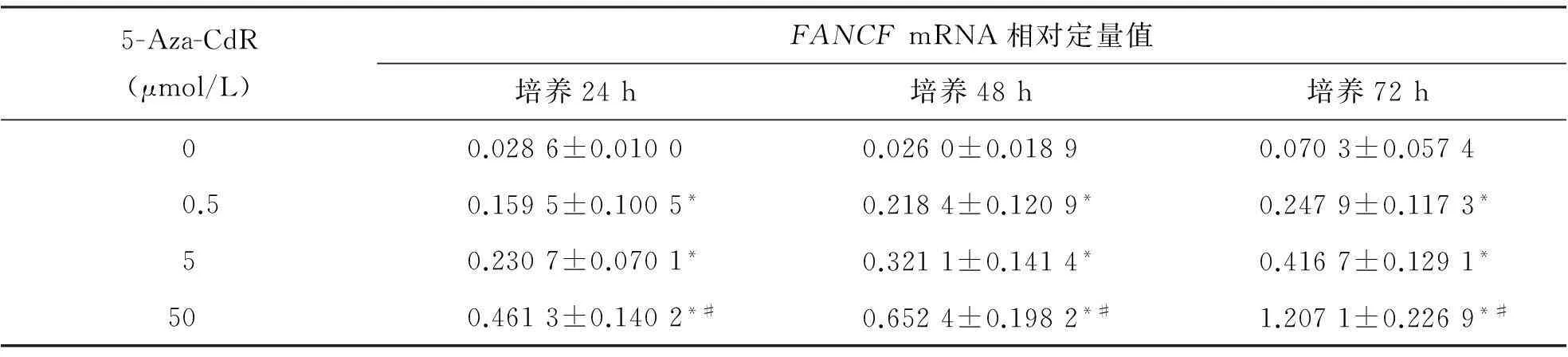
表3 不同浓度5-Aza-CdR对A549细胞内FANCF mRNA表达的影响
注:与5-Aza-CdR 0 μmol/L组比较,*P<0.001;与5-Aza-CdR 0.5 μmolL/L组比较,#P<0.001
四、A549细胞和A549/DDP细胞FANCFmRNA表达情况
A549细胞和A549/DDP细胞FANCFmRNA表达的相对定量值分别为0.070 3±0.057 4和0.728 6±0.159 9,两者比较差异有统计学意义(P<0.001)。
五、FANCF基因表达及甲基化电泳图
A549/DDP细胞株FANCF基因甲基化阴性,5-Aza-CdR处理前后FANCFmRNA表达量差异无统计学意义,而A549细胞株FANCF基因甲基化阳性,5-Aza-CdR处理前后FANCFmRNA表达量差异明显。见图1和图2。

注:M为FANCF基因甲基化引物扩增产物;U为FANCF基因非甲基化引物扩增产物;mRNA为FANCFmRNA;GAPDH为内对照;Marker为相对分子质量标准品;1、3、5和7泳道为未加入5-Aza-CdR细胞培养;2、4、6和8泳道为加入5-Aza-CdR细胞培养
图1A549/DDP细胞株FANCF甲基化及表达电泳图

注:M为FANCF基因甲基化引物扩增产物;U为FANCF基因非甲基化引物扩增产物;mRNA为FANCFmRNA;GAPDH为内对照;Marker为相对分子质量标准品;1、3、5和7泳道为未加入5-Aza-CdR细胞培养;2、4、6和8泳道为加入5-Aza-CdR细胞培养
图2A549细胞株FANCF甲基化及表达电泳图
讨论
近年来,肺癌发病率和死亡率呈急剧上升趋势,而化疗耐药已成为当今肿瘤治疗中亟待解决的一大难题。随着表观遗传学研究的深入,研究认为某些基因启动子甲基化与肿瘤耐药关系密切,可用于预测肿瘤化疗疗效。近年研究显示,FA/BRCA途径在肿瘤细胞对DNA交联剂类药物(如顺铂、丝裂霉素、米尔法兰等)的耐药中发挥了重要作用。FANCF作为FA家族中的衔接蛋白,其C末端与FANCA/FANCG亚单位相连,其N端与FANCC/FANCE亚单位相连,在泛素化的FANCD2入核过程中有着重要作用,FANCF既是稳定FA复合体,也是维持FA/BRCA通路生物学功能的关键因子。由于FANCF基因定位于11p15,而该位点具有一定数量的肿瘤相关印记基因,其主要特点是富含CpG岛,易被高度甲基化,目前研究发现在多种恶性肿瘤中均可检测到FANCF基因甲基化,从而导致基因表达降低或缺失[7]。而FANCF表达对FA/BRCA途径完整发挥细胞修复功能起重要的作用,FANCF基因的表达下降或缺失会导致FA/BRCA信号转导途径缺陷,细胞DNA修复受损,引起染色体异位、倒位、缺失和基因异常扩增等,导致肿瘤发生;同时由于FANCF基因的表达降低或沉默引起FA/BRCA通路失活,丧失对抗肿瘤药物致DNA损伤的修复作用,引起肿瘤细胞的死亡,增强化疗药物的敏感性。ZHAO等[8]用RNAi干预FANCF基因在人乳腺癌细胞的表达证实,随FANCF表达量的降低,癌细胞对化疗药物的敏感性增加。
5-Aza-CdR是一种DNA甲基转移酶抑制剂,能与DNA甲基转移酶结合,降低DNA甲基转移酶的生物活性,进而降低甲基化水平[9],调节基因表达,故5-Aza-CdR常被用来治疗由于启动子甲基化导致基因表达降低或缺失而引起的疾病。本研究结果显示,随着浓度的增加及培养时间的延长,5-Aza-CdR 对A549细胞的CPIR增强,提示5-Aza-CdR作用于FANCF甲基化的A549细胞株可能通过降低DNA甲基转移酶活性,提高FANCF基因非甲基化率。细胞凋亡率与5-Aza-CdR浓度相关,组间差异明显;在人肺腺癌细胞系A549中FANCF基因启动子甲基化阳性,其mRNA表达明显降低,而在顺铂耐药A549/DDP细胞系中表达显著高于A549细胞株,提示肺癌顺铂耐药可能与FANCF基因高表达有关。应用5-Aza-CdR药物干预后,A549细胞FANCFmRNA表达增高,但对A549/DDP细胞株作用不显著,证明增加5-Aza-CdR浓度可增加FANCFmRNA表达,进一步表明5-Aza-CdR可使由于甲基化而导致表达沉默/降低的FANCF基因重新表达,恢复其功能,保证细胞完整性,促进细胞凋亡,但可引起对顺铂的耐药。
本研究证实启动子甲基化可导致FANCF基因沉默,而FANCF表达缺失或降低又与肺癌发生、发展及顺铂类化疗药物疗效相关。DNA甲基化在基因表达调控、细胞增殖分化、肿瘤发生和发展等方面都起重要的作用。5-Aza-CdR作为DNA甲基转移酶抑制剂不但应用于体外细胞去甲基化,而且在白血病、骨髓增生异常综合征、非小细胞肺癌等肿瘤临床治疗中已经取得很好的疗效。在本研究中5-Aza-CdR可以使A549细胞系FANCF基因启动子去甲基化,基因转录激活,因此A549细胞系FANCF基因启动子去甲基化可能是一种潜在的有效药物位点。对于那些失去手术机会,又不能耐受化疗药物的不良作用患者,使用5-Aza-CdR就可能成为延长患者生存时间的新手段,当然这需要临床试验更进一步证实。
参考文献
[1]KNIPSCHEER P, RSCHLE M, SMOGORZEWSKA A, et al. The Fanconi anemia pathway promotes replication-dependent DNA interstrand cross-link repair[J]. Science,2009,326(5960):1698-1701.
[2]WU Y, BROSH RM JR. FANCJ helicase operates in the Fanconi anemia DNA repair pathway and the response to replicational stress[J]. Curr Mol Med,2009, 9(4):470-482.
[3]LIM SL, SMITH P, SYED N, et al. Promoter hypermethylation of FANCF and outcome in advanced ovarian cancer[J]. Br J Cancer,2008, 98(8):1452-1456.
[4]AN J, WEI Q, LIU Z, et al. Messenger RNA expression and methylation of candidate tumor-suppressor genes and risk of ovarian cancer-a case-control analysis[J].Int J Mol Epidemiol Genet,2010, 1(1):1-10.
[5]PAREDES J, ALBERGARIA A, OLIVEIRA JT, et al. P-cadherin overexpression is an indicator of clinical outcome in invasive breast carcinomas and is associated with CDH3 promoter hypomethylation[J]. Clin Cancer Res, 2005, 11(16):5869-5877.
[6]NASS SJ, HERMAN JG, GABRIELSON E, et al. Aberrant methylation of the estrogen receptor and E-cadherin 5′ CpG islands increases with malignant progression in human breast cancer[J]. Cancer Res, 2000, 60(16):4346-4348.
[7]CHEN H, HARDY TM, TOLLEFSBOL TO. Epigenomics of ovarian cancer and its chemoprevention[J]. Front Genet,2011, 2:67.
[8]ZHAO L, LI N, YU JK, et al. RNAi-mediated knockdown of FANCF suppresses cell proliferation, migration, invasion, and drug resistance potential of breast cancer cells[J]. Braz J Med Biol Res,2014,47(1):24-34.
[9]FABIANI E, LEONE G, GIACHELIA M, et al. Analysis of genome-wide methylation and gene expression induced by 5-aza-2′-deoxycytidine identifies BCL2L10 as a frequent methylation target in acute myeloid leukemia[J]. Leuk Lymphoma,2010, 51(12):2275-2284.
(本文编辑:姜敏)


收稿日期:(2014-06-11)
中图分类号:
文章编号:1673-8640(2015)05-0507-05R446.62
文献标志码:ADOI:10.3969/j.issn.1673-8640.2015.05.022
通讯作者:高琼,联系电话:0719-8801750。
作者简介:余宗涛,男,1971年生,硕士,副主任技师,主要从事肿瘤分子机制研究。
基金项目:湖北省十堰市科技局资助项目(ZD2012015);湖北医药学院优秀中青年科技创新项目(2011CXG02)

