金钱松细胞悬浮培养关键技术研究
唐 旭, 何诗虹, 王跃华, 马腾香, 彭雪婷, 李红芳
(1.四川师范大学生命科学院, 成都610101; 2.成都大学生物产业学院, 四川 成都610016)
金钱松(Pseudolarix amabilis(Nelson)Rehd.)是我国特有的古老孑遗松科(Pinaceae)树种,属于单属单种[1-3],由于其特殊的商业和药用价值,目前已处于濒临灭绝的状态,被国家列为二级保护植物[4-7]。当前对金钱松的研究主要集中在栽培技术、化学成分和药理作用等方面[8-10];据报道,金钱松含有二萜类、三萜类和三萜内酯类成分,具有抗真菌、抗生育和抗肿瘤等作用[10-12],因此,对金钱松植物的需求量也大大增加了。
为了更好地解决金钱松植物供不应求的状况,积极开展对金钱松植物的组织培养研究,最终实现利用细胞发酵技术大规模生产含有效成分的金钱松细胞,以满足各级市场对金钱松及其所含有效成分的需求。通过查阅资料可知,何佳等[13-14]在金钱松内生真菌方面进行了大量的工作,但还未见有采用细胞悬浮培养技术来大规模发酵生产金钱松细胞的;本研究的开展可寻求一条有效解决当前金钱松资源短缺的新途径。
1 材料和方法
1.1 材 料
本实验材料采自四川省成都市植物园,经成都大学植物鉴定室鉴定为金钱松属(Pseudolarix Gord.)植物(Pseudolarix amabilis(Nelson)Rehd)金钱松。本研究采用金钱松叶原基诱导产生的优良翠绿色愈伤组织为实验材料。
1.2 方 法
1.2.1 愈伤组织的获取
选取在 MS+6-BA 1.0mg/L+NAA 0.5mg/L培养基中进行了增殖培养20d的金钱松愈伤组织细胞进行悬浮培养,以建立金钱松细胞的悬浮培养体系。
1.2.2 细胞悬浮体系建立
通过对不同激素配比、接种量、蔗糖浓度和pH值等培养条件的筛选,以获得金钱松细胞悬浮培养的最佳条件。
1.2.3 悬浮培养细胞的鲜重测量
取充分摇匀的悬浮细胞在4 000r/min的条件下离心10min后,倒掉上清液并进行称重,即为鲜重。试验重复3次。
1.2.4 计算公式以及数据分析
生物量增殖倍数=(收获鲜重量-接种鲜重量)/接种鲜重量。生长速率=(收获鲜重-接种鲜重量)/培养天数。细胞增殖倍数和生长速率均计算平均值和标准差
2 结果与分析
2.1 不同激素配比对金钱松悬浮细胞生长的影响
本实验研究了6-BA、NAA和2,4-D不同激素组合对金钱松悬浮培养细胞快速增殖的影响,其中6-BA的浓度为1.0mg/L;NAA 的浓度范围为0.3,0.5mg/L和1.0mg/L;2,4-D的浓度范围为0.3,0.5mg/L和1.0mg/L。试验每2天观察记录1次,培养30d的统计结果见表1。
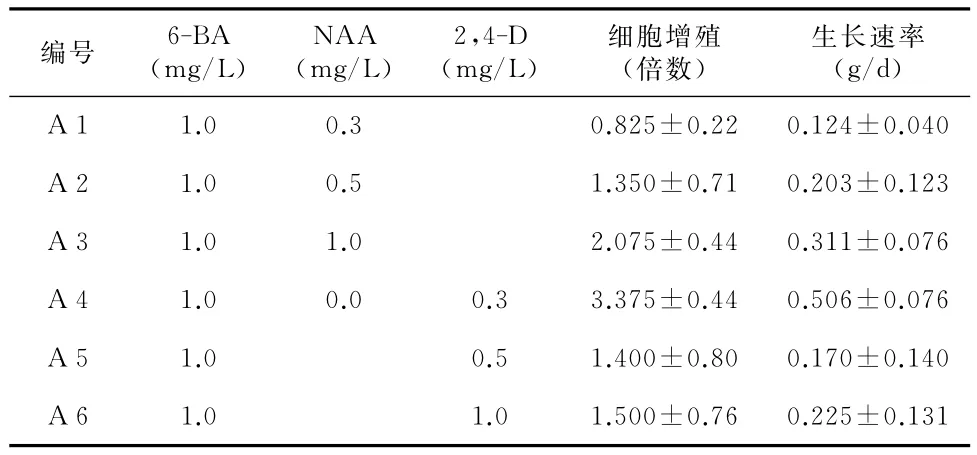
表1 不同激素配比对金钱松悬浮细胞生长的影响
从表1可以看出,不同激素配比对金钱松悬浮培养细胞的增殖有很大影响。配制的6个激素配比中,以 A 4即以6-BA 1.0mg/L和2,4-D 0.3mg/L时,在悬浮培养30d后其金钱松细胞的增殖倍数和生长速率都是最高的,即增殖倍数为3.375±0.44、生长速率为0.506±0.076;另外,通过分析6-BA 与2,4-D 和NAA激素配比对金钱松细胞的增殖生长具体影响是完全不同的;其中在6-BA浓度保持不变的条件下,随着NAA浓度由0.3mg/L到1.0mg/L的逐渐增高,其细胞增殖倍数和生长速率也随着增高,在A 1、A 2和 A 3的3个激素配比中,以 A 3即6-BA 1.0mg/L和NAA 1.0mg/L的激素配比最适宜金钱松细胞的增殖生长;而在由6-BA与2,4-D组合的激素配比 A 4、A 5和 A 6的3个配方中,随着2,4-D浓度由0.3mg/L到1.0mg/L的逐渐增高,其增殖倍数和生长速率却呈现出逐渐降低的趋势。由此可见,在金钱松细胞悬浮培养过程中,采用不同种类的激素配比,其所需要的具体激素浓度也是不同的。
2.2 不同接种量对金钱松悬浮细胞增殖的影响
方文娟等在植物细胞悬浮培养影响因子的研究中指出,在细胞悬浮培养中接种量对细胞增殖生长有很大影响[15-17]。本实验分别采用在150mL的锥形瓶中装有40mL培养液后,再分别接入了1.0,2.,3.0g和4.0g分散状况良好的翠绿色金钱松愈伤组织进行悬浮培养;每2天观察记录1次细胞生长状况,培养30d后统计结果见表2。
从表2可以看出,不同接种量对金钱松悬浮培养细胞的增殖倍数和生长速率都有较大影响;当接种量由1.0g升高为2.0g时,经30d培养后其细胞的增殖倍数和生长速率都是最高的,增殖倍数为2.840±0.560、生长速率为0.487±0.096;但随着接种量进一步升高超过2.0g时,其细胞的增殖倍数和生长速率却出现了下降,并且,当接种量增加到4.0g时,其细胞的增殖倍数和生长速率都是最低(表2),即增殖倍数仅为1.340±0.32、生长速率也仅为0.161±0.039。由此可见,正如王娟等[18]所说,当接种量较少时,不但细胞生长的延迟期较长,而且在培养期中的增殖倍数也较低,但接种量过多时,对数生长期缩短,培养基中营养成分不足,导致细胞生长缓慢,增殖倍数也相对较低。当接种量适宜时,悬浮细胞的增殖倍数最多。

表2 不同接种量对金钱松悬浮细胞的影响
2.3 不同蔗糖浓度对金钱松悬浮细胞增殖的影响
蔗糖浓度也是影响细胞生长和次生物质生产的重要因子。实验设置的蔗糖浓度分别为20,30,40g/L和50g/L,实验每2天进行1次观察记录,培养30d后统计(结果见表3)。

表3 不同蔗糖浓度对金钱松悬浮细胞增殖的影响
从表3可以看出,蔗糖浓度从C 1的20g/L增加到C 4的50g/L,其培养的金钱松细胞呈现出不同的生长状况。具体分析可以发现,当蔗糖浓度由20g/L升高到40g/L时,经30d培养后其细胞的增殖倍数和生长速率都呈现出升高的趋势,其中以蔗糖浓度为40 g/L时的细胞增殖倍数和生长速率为最高,分别是2.700±0.52和0.463±0.089;但随着蔗糖浓度进一步升高到50g/L时,细胞增殖倍数和生长速率又开始出现下降。这进一步说明,糖作为碳源,不仅为细胞提供合成新化合物的碳骨架、为细胞的呼吸代谢提供底物与能源;而且糖还用以维持一定的渗透势,是培养物渗透环境的主要调节者[18-19]。研究表明,过高的蔗糖浓度对细胞生长也是不利的。蔗糖浓度越高,培养基的渗透压就越大;而过高的渗透压会抑制培养细胞的生长,甚至会产生非常明显地毒害作用。
2.4 不同pH值对金钱松悬浮细胞增殖的影响
不同种类的植物细胞在培养过程中所需要的pH值是不同[20-22]。本实验设置的pH 值分别为4、5、6和7,实验每2天进行1次观察记录,培养30d后统计(结果见表4)。
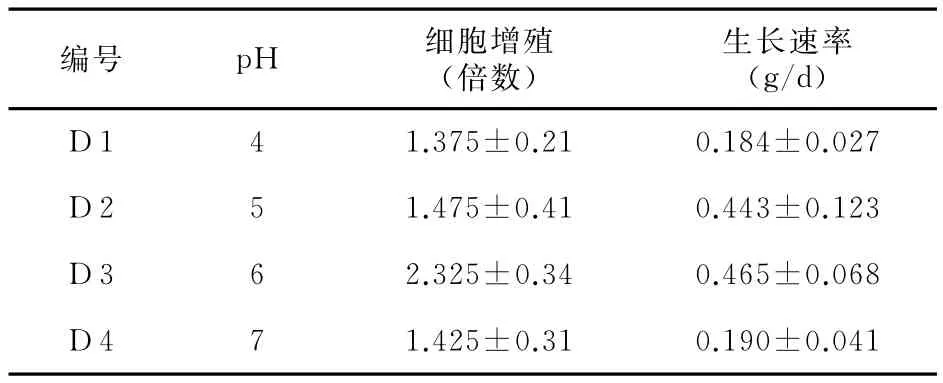
表4 不同pH值金钱松悬浮细胞增殖的影响
表4实验结果显示,在金钱松细胞增殖生长过程中,培养基中的pH值为6.0时,其悬浮培养细胞的增殖倍数和生长速率都是最高的。通过观察金钱松细胞在不同pH值的培养基中的生长状况可以发现,pH值偏高或偏低都不利于金钱松细胞的生长,且均出现不同程度的细胞褐变情况,细胞的生长速度也明显地降低。这主要是因为不同的pH值会引起培养基中的各成分状态的改变(过高的pH会使Fe沉淀)、细胞通透性和酶的活性改变,以及培养细胞对营养物质的吸收利用程度的改变;因此,在进行不同细胞的培养过程中,选择适宜的pH值是非常重要的。
3 结果与讨论
植物细胞的悬浮培养对细胞进行快速大规模、工业化生产提供了技术手段。金钱松作为我国国家二级保护植物,又是具有重要作用的药用植物,其资源严重匮乏,无法满足市场需求,因此急需探讨出大量生产金钱松或获取金钱松有用成分的方法。
本实验主要研究了影响金钱松细胞悬浮培养的各种主要因素,通过对激素配比,接种量,蔗糖浓度以及pH值的研究,从而找出最佳培养条件,以构建完整的金钱松细胞悬浮体系,通过实验,金钱松悬浮的最佳组合为 MS+6-BA 1.0+2,4-D 0.3+蔗糖浓度40g/L+接种量1.2g/40mL+pH 6.0,继代培养天数为10d,延迟期为0~3d,指数期为3~7d,衰落期为7~20d,试验中发现,在培养中,开始细胞逐渐在锥形瓶壁上积累,然后在积累细胞周围长出绿色的细胞,试验中出现的褐变速率快慢的现象也与实验中金钱松愈伤组织的质量状况有关,完全翠绿的褐变速度慢,而黄绿色或黄色的愈伤组织褐变的速率快。
[1]刘洪亮,何承忠.金钱松化学成分及生物活性研究现状与展望[J].西南林学院学报,2008,28(1):52-55.
[2]傅立国.中固植物红皮书——稀有频危植物(第1册)[M].北京:科学出版社,1992.
[3]贺新强,林金星,胡玉熹,等.中国松杉类植物濒危等级划分的比较[J].生物多样性,1996,4(1):45-51.
[4]魏学智,胡玉熹,林金星,等.中国特有植物金钱松的生物学特性及其保护[J].武汉植物学研究,1999,17(增刊):73-77.
[5]崔青云,王小德.金钱松研究进展与展望[J].西南林学院学,2008,28(1):52-55.
[6]钱洪涛,张纪林,宋建法,等.金钱松幼苗移植措施对生长的影响[J].林业科技开发,2005,19(3):59-60.
[7]王良衍,杨永川,宋垚彬.浙江天童国家森林公园金钱松人工林生长动态研究[J].浙江林业科技,2005,25(2):5-9.
[8]李楠.论松科植物的地理分布、起源和扩散[J].植物分类学报,1995,33(2):105-130.
[9]鹿俊牛,张玉龙.中国种子植物特有属[M].北京:科学出版社,1994:10.
[10]Li X C,Elsohly H N.Two auronols from Pseudolarix amabilis[J].J Nat Prod,1999,62(5):767.
[11]王伟成,陆蓉发,赵世权,等.土荆皮甲酸和乙酸抗早孕作用和毒性的比较[J].中国药理学报,1999,9(5):445.
[12]郭尚彬,陈钧,王妍,等.金钱松内生真菌JJ 18灭螺活性与菌株鉴定[J].中国媒介生物学及控制杂志,2008,19(5):442-445
[13]何佳,陈钧.金钱松内生真菌抗植物病原真菌活性的研究[J].河南农业科学,2007(7):46-49.
[14]何佳,陈钧,赵启美,等.快速筛选金钱松内生真菌抗真菌活性的研究[J].中国中药杂志,2006,31(21):1 759-1 762.
[15]方文娟,韩烈保,曾会明.植物细胞悬浮培养影响因子研究[J].生物技术通报,2005(5).
[16]王娟,高文远,黄滔,等.培养条件对西洋参悬浮细胞生物量和活性成分的影响[J].中国中药杂志,2009,34(4):377.
[17]刘冬云,史宝胜,李银华,等.不同碳源及PP333、GA3对山丹组培苗鳞茎增大的影响[J].河北农业大学学报,2005,28(2):32-35.
[18]王惠珍,邓日烈,刘丽屏,等.碳源和氮源对鸡冠花愈伤组织生长及花色素苷积累的影响[J].佛山科学技术学院学报(自然科学版),2007,25(4):62.
[19]Felle H.H.pH:Signal and message in plant cells[J].Plant-Boi.l,2001,3:577-591.
[20]Marty F.Plant vacuoles[J].PlantCel,l 1999,11:587-599.
[21]刘庆昌,吴国良.植物细胞组织培养教程[M].北京:中国农业大学出版社,2003:21-23.
[22]Cosgrove D.J.Loosening of plant cellwalls by expansins[J].Nature,2000,407:321-326.

