宁波沿海陆源排污口蓝藻(Cyanobacteria)和裸藻纲(Euglenoidea)生物的分布特点*
谢 利 王朝阳 张迪骏 周 君 司开学 张红燕韩姣姣 崔晨茜 董丽莎 苏秀榕①
(1. 国家海洋局北海环境监测中心 青岛 266033; 2. 宁波大学海洋学院 宁波 315211)
蓝藻(Cyanobacteria)又称为蓝细菌或蓝绿藻,是一类进化历史悠久、革兰氏染色阴性、无鞭毛、含叶绿素a(但不形成叶绿体)、能进行产氧性光合作用的大型原核微生物。蓝藻的分布广泛, 从水生到陆生生态系统, 从热带到南北极均有分布。蓝藻是海洋生态系统和海洋初级生产力的重要组成部分(孙晟等, 2003; Paul, 2008)。蓝藻结构简单, 细胞内没有真正的细胞核结构和色素体, 只有核质和色素两大部分。蓝藻的繁殖方式有两类, 一类为营养繁殖, 包括细胞直接分裂(即裂殖)、群体破裂和丝状体产生藻殖段等几种方法; 另一类为可产生内生孢子或外生孢子等, 以进行无性生殖。蓝藻主要有微囊藻、螺旋藻、项圈藻、颤藻等, 其中微囊藻的危害最大(Asselman et al, 2014)。根据长期的观测, 发现在大多数情况下, 在特定湖区内, 这种突然“暴发”的水华是在适宜的气象与水文条件下, 该湖区内亦已存在的、悬浮于水体中的蓝藻群体再加上其它湖区的水华蓝藻, 随着风和湖流的驱动, 漂移到该湖区聚集上浮至水面, 并为人们肉眼所见的过程(孔繁翔等, 2009; O’Neil et al, 2012)。蓝藻作为河湖水华中的常见优势种群, 引起的蓝藻事件是目前社会普遍关注的问题。蓝藻水华的暴发是水体富营养化特征之一。蓝藻通过产生毒素、死亡个体分解使水体缺氧和破坏正常的食物链威胁到饮用水安全、公众健康和景观, 会造成严重的经济损失和社会问题(马健荣等, 2013)。因此人们开始关注蓝藻, 并取得一定的进展。眼虫门是一群鞭毛生物, 兼有叶绿素和眼点, 兼有动物和植物的特性, 在植物学、藻类学中称为“裸藻”, 而在原生动物学中称为“眼虫”, 因此眼虫门也称作裸藻门。眼虫门主要有两个纲: 裸藻纲和动质体纲。在本次研究中的主要对象是裸藻纲,这类生物在水华和赤潮中也起一定的作用。
藻-菌关系一直是研究的热点问题之一, 但目前主要集中在海洋、湖泊赤潮藻方面, 陆源排污口中的蓝藻和裸藻纲生物未见报道。本文选取宁波沿海 10个主要的陆源排污口, 分别对排污口处和距排污口50m以外的 20个站位的水样进行分析, 对每个站点进行总体和单独分析, 研究蓝藻和裸藻纲生物种类和分布特点。
1 材料与方法
1.1 样品采集
选取宁波沿海 10个陆源排污口和距离排污口50m以外的10个站位作为采样位点(见图1)。分别于2011年3月、5月、8月、10月进行采集, 每次采集4L水样。

图1 采样站位区域分布图Fig.1 Map of sampling site
1.2 方法
1.2.1 DNA提取 取排污口的海水, 以0.22μm的微孔滤膜富集微生物, 利用试剂盒提取基因组DNA(美国Omega生物技术公司)。
1.2.2 PCR扩增 根据细菌16S rRNA的保守序列, 利用Primer Premier 5.0设计扩增引物: 16S F(5’-CCA TCT CAT CCC TGC GTG TCT CCG ACT CAG-3’)和 16S R (5’-CCT ATC CCC TGT GTG CCT TGG CAG TCT CAG-3’)。
20μL 扩增反应体系: 10×buffer 2μL, MgCl22μL,dNTP 2μL, 上游引物和下游引物各 25μL, 0.2μL Taq DNA聚合酶和1μL DNA模版。PCR扩增产物用2%的琼脂糖凝胶电泳检测(Wang et al, 2014a, b)。
PCR扩增条件: 94°C预变性4 min, 94°C变性30 s,退火温度从65°C到55°C, 退火 30 s, 20个循环; 72°C延伸 30 s, 94°C 变性 30 s, 55°C 退火 30 s, 72°C延伸30 s, 35个循环; 最终72°C延伸10 min(刘兵等, 2009)。
1.2.3 测序与分析 将纯化后的 PCR产物进行454焦磷酸测序(Margulies et al, 2005; 王中华等,2014), 结果用罗氏软件2.5.3进行信号处理分析。根据蓝藻细菌在文库中出现的频次数量, 进一步用 R For Window 2.15.2、SPSS等进行统计分析。
2 结果与分析
2.1 454测序分析裸藻纲和蓝藻在排污口的分布
通过对 454高通量测序共检出眼虫门的裸藻纲(Euglenoidea)、蓝藻门的集球藻目(Synechococcophycideae)、颤藻目(Oscillatoriophycideae)、念珠藻目(Nostocophycideae)、粘杆菌目(Gloeobacterophycideae),具体数量见表1。

表1 不同时间蓝藻和裸藻纲生物检出次数总体分析Tab.1 Results of detection on Cyanobacteria and Euglenoidea in percentage
2.2 排污口蓝藻和裸藻纲生物的分布与季节的关系
通过对 454高通量测序平台结果进行比对分析发现: 在3月份, S4象山西周工业园区排污口、S7宁海西店崔家综合排污口蓝藻和裸藻纲生物数量最多,S7宁海西店崔家综合排污口次之。在5月份, S4象山西周工业园区排污口的检出次数最高, S6北仑三山排污口、S7宁海西店崔家综合排污口和S8奉化下陈排污口次之。在8月份, S7宁海西店崔家综合排污口的检出次数最高, S9宁海颜公河入海排污口次之。在10月份, S6北仑三山排污口检出次数最高, S7宁海西店崔家综合排污口和S9宁海颜公河入海排污口次之。
3月份的蓝藻和裸藻纲生物检出次数最高, 8月份和10月份检出次数较低。其原因是8月份东海海洋表面平均温度达到年最高值约为 30—35°C, 高温使部分工厂停产休息, 因此污水排放量减小(陈丽萍等, 2013), 3月份的时候排污量较多, 而且气温较低适于这两类生物的生长, 因此检出次数与季节温度、空气湿度有关(图2)。

图2 不同月份蓝藻和裸藻纲生物在排污口的分布情况Fig.2 The distribution of Cyanobacteria and Euglenoidea in different sewage outlets and months
3月份, 距S7宁海西店崔家综合排污口50m处蓝藻和裸藻纲生物数量最多, 距 S4象山西周工业园区排污口50m处含量次之; 5月份, 距S7宁海西店崔家综合排污口50m处含量最高, 距S4象山西周工业园区排污口50m处含量次之; 8月份, 距S7宁海西店崔家综合排污口50m处含量最高, 距S6北仑三山排污口50m处含量次之; 10月份, 距S6北仑三山排污口50m处含量最高, 距S7宁海西店崔家综合排污口50m处含量次之(图3)。
蓝藻和裸藻纲生物大量出现时, 附近水体一般呈蓝色或绿色, 水面被大量藻体覆盖。蓝藻细胞尤其是微囊藻将毒素释放到水里, 由于本身的机制使得其在夏天的富营养水体中容易大量暴发生长, 造成严重的水体生态灾难(Brescianiet al, 2014)。微囊藻毒素对人体肝功能有很大的伤害, 生活在湖边、池塘边和海边的人容易通过饮用水和食用藻类中毒(王伟琴等, 2010; Urrutia-Corderoet al, 2013)。宁海西店镇是中国著名的“牡蛎之乡”, 牡蛎营养丰富, 具有各种人体必需氨基酸对降低血糖也有一定的作用(滕瑜等,2005), 冬季是西店牡蛎最盛产也是蛎肉最肥美的季节。而蛎肉品质与海水的质量有着紧密联系, 某些蓝细菌(如集球藻目)会通过内吞的方式进入牡蛎组织内部达到寄生目的, 进而在牡蛎组织内部累积, 从而污染了牡蛎的肉质(Avila-Povedaet al, 2014), 因此3月份应重点加强对 S7号排污口的监控, 以免造成牡蛎污染和经济损失。
2.3 种类的分布

图3 不同月份各排污口的蓝藻和裸藻纲生物数量与50m的站位点的比较Fig.3 Comparison in Cyanobacteria and Euglenoidea quantity between each sewage outlet and a site 50m away in different months
在3月份, S4号象山西周工业园区排污口裸藻纲生物检出频次最高(排污口1906次, 距排污口50m处2223次), 占3月份所有检出生物总量的20.83%, 蓝藻检出频次则较少(排污口124次, 距排污口50m处106次); S2号象山水桶岱垃圾场排污口中两类生物排出量最少(排污口0次, 距排污口 50m处 51次)。说明S2号3月份排污口排出的污染物中没有这两类微生物需要的营养。而其它排污口均是裸藻纲生物的检出频次最高(图 4)。在 5月份, 各排污口蓝藻检出频次均较少, S4号象山西周工业园区排污口裸藻纲生物检出频次最高(排污口 629次, 距排污口 50m处 557次), S6号北仑三山排污口裸藻纲生物检出频次也较高(排污口处231次, 距排污口50m处343次), S1号象山爵溪东塘排污口裸藻纲生物检出频次最低(排污口处3次, 距排污口50m处3次)。在8月份, S7号宁海西店崔家综合排污口裸藻纲生物检出频次最高(排污口处1077次, 距排污口50m处2040次), 其它排污口裸藻纲生物检出频次都较低。各排污口集球藻目检出频次均偏低, 其中 S8号奉化下陈排污口检出频次最高(排污口处236次, 距排污口50m处4次), S6号北仑三山排污口集球藻目检出频次次之(排污口处180次, 距排污口50m处195次)。而S2、S3、S5号则没有集球藻目。在10月份, S6号北仑三山排污口集球藻目检出次数最高(排污口处 344次, 距排污口50m 处 249次), 而裸藻纲检出频次较低(排污口处129次, 距排污口50m处404次), S9宁海颜公河入海排污口叶绿体目检出频次最高(排污口 212次, 距排污口50m处193次), 集球藻目检出次数则较低。
S7宁海西店崔家综合排污口和距排污口50m处裸藻纲生物的检出次数总数最高, 说明 S7号处的海水质量更适合裸藻纲生物的生长。宁海西店崔家综合排污口的主要污染物没有氨氮化合物, 而其它排污口处氨氮浓度较高。裸藻纲生物的生长并不只是受氨氮含量的影响, 氮磷比对裸藻纲生物的生长影响较大, 在低磷情况下(0.02mg/L), 氮磷比为 4︰1—32︰1范围内, 某些生物(如铜绿微囊藻和斜生栅藻)的生长均受到营养盐的限制, 当磷浓度达到 0.20mg/L时,这两种藻类分别在在N/P比为32︰1和64︰1时生长速率达到最大值, 而在磷浓度升高到2mg/L时, 氮磷比对生长速率已经没有影响(Sabour et al, 2009; 许海等, 2011)。可以推测S7号排出的污水中氮磷比适合裸藻纲生物的生长, 因此应该加强对 S7号氮磷含量的监控, 以避免出现水华现象(图4)。
2.4 蓝藻和裸藻纲生物在重点排污口的分布
S9号宁海颜公河入海排污口和S5号象山墙头综合排污口为宁波市两个重点沿海排污口。两类生物检出频次在时间和数量上有明显的差异。S9号宁海颜公河入海排污口中的裸藻纲检出频次最高为 3月份,高达1099次, 最低为5月份的35次, 蓝藻的检出次数在3、5、8、10月份检出频次均很少, 最高为8月份16次。S5号象山墙头综合排污口裸藻纲检出频次最高为5月份, 高达23次, 其它月份排污口裸藻纲的检出频次都在15次以下, 而蓝藻在四个月份检出频次一共只有 3次(图 5)。S9号宁海颜公河入海排污口和S5号象山墙头综合排污口排出的主要是裸藻纲。
S9号宁海颜公河入海排污口的主要污染物为磷和氨氮, S5号象山墙头综合排污口的主要污染为粪大肠菌群、苯胺、生化需氧量。这两个重点排污口两类生物检出频次均相对较少, 说明这两个排污口污染物中氮磷比含量不适合它们生长。但是宁海颜公河排污口和象山墙头综合排污口分别在3月和5月裸藻纲的检出量达到最大值, 宁海颜公河排污口3月份裸藻纲检出频次要高于象山墙头综合排污口在 5月份的检出频次, 这可能与宁波3月份和5月份气温有关系,3月份平均气温比5月份平均气温低10°C左右, 推测裸藻纲生物更适宜较低温度生长; 蓝藻检出量分别在8月和5月达到最大值。宁波8月份日均最低温度为25°C, 日均最高温度为32°C; 5月份日均最低温度为 17°C, 日均最高温度为 25°C, 铜绿微囊藻在 15°C的生长速率和生长量低于在20°C、25°C下的生长速率, 20°C条件下铜绿微囊藻在前期的生长速率低于在 25°C下的生长速率, 而在 17d时两种条件下的生长量开始相等。铜绿微囊藻更容易在5月份生长, 所以应根据温度变化做好对蓝藻生长的防治, 以免其毒素在水产品中(如藻类、螺类、贝类和各种鱼类)积累, 对人类健康造成危害(陈建中等, 2010)。

图4 不同月份和不同站位排污口的蓝藻和裸藻纲生物检出次数Fig.4 The numbers of Cyanobacteria and Euglenoidea in the sewage outlets in different months
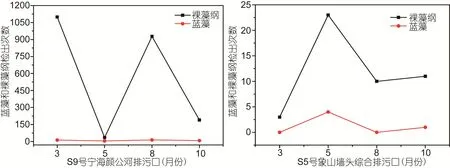
图5 重点排污口蓝藻和裸藻纲生物各月份检出频次Fig.5 The number of Cyanobacteria and Euglenoidea in major sewage outlets in different months
3 结论
利用454高通量测序技术, 确定了宁波沿海2个重点排污口、8个一般排污口的20个站位的海水中,含有叶绿体的裸藻纲生物检出量最高, 蓝藻门的集球藻目次之。由于季节性的影响, 排污口的污染物和温度也会发生相应的变化, 进而影响蓝藻的生长。裸藻纲生物的检出量也受各排污口中氮磷比含量影响较大, 不同的生物在不同的氮磷比的条件下生长速率也会不同, S7号排污口中污染源更适合裸藻纲生物的生长。S9号和S5号排污口作为宁波市两个重点陆源排污口, 两种生物检出量均相对较低, 分别在3月份和5月份裸藻纲检出量最大, 8月和5月蓝藻检出量达到最大值, 季节性温度变化会影响这两类生物的生长, 应该依照不同季节和不同类型的排污口针对性地对蓝藻进行治理, 防止造成水体污染。
马健荣, 邓建明, 秦伯强等, 2013. 湖泊蓝藻水华发生机理研究进展. 生态学报, 33(10): 3020—3030
王中华, 徐茂琴, 谢 利等, 2014. 宁波沿海陆源排污口拟杆菌(Bacteroidetes)分布的特点. 海洋与湖沼, 45(5):1030—1036
王伟琴, 金永堂, 吴 斌等, 2010. 水源水中微囊藻毒素的遗传毒性与健康风险评价. 中国环境科学, 30(4): 468—476
孔繁翔, 马荣华, 高俊峰等, 2009. 太湖蓝藻水华的预防、预测和预警的理论与实践. 湖泊科学, 21(3): 314—328
刘 兵, 李太武, 苏秀榕等, 2009. 宁波北仑港冬季浮游细菌多样性研究. 台湾海峡, 28(2): 217—222
许 海, 朱广伟, 秦伯强等, 2011. 氮磷比对水华蓝藻优势形成的影响. 中国环境科学, 31(10): 1676—1683
孙 晟, 肖 天, 岳海东, 2003. 秋季与春季东、黄海蓝细菌(Synechococcus spp.)生态分布特点. 海洋与湖沼, 34(2):161—168
陈丽萍, 侯付景, 张迪骏等, 2013. 宁波沿海陆源排污口假单胞菌属(Pseudomonas)分布特点. 海洋与湖沼, 44(4):926—930
陈建中, 刘志礼, 李晓明等, 2010. 温度、pH和氮、磷含量对铜绿微囊藻(Microcystis aeruginosa)生长的影响. 海洋与湖沼, 41(5): 714—718
滕 瑜, 王彩理, 2005. 牡蛎的营养和降糖作用研究. 海洋水产研究, 26(6): 39—44
Asselman J, Hochmuth J D, de Schamphelaere K A C, 2014. A comparison of the sensitivities of Daphnia magna and Daphnia pulex to six different cyanobacteria. Harmful Algae,39: 1—7
Avila-Poveda O H, Torres-Ariño A, Girón-Cruz D A et al, 2014.Evidence for accumulation of Synechococcus elongatus(Cyanobacteria: Cyanophyceae) in the tissues of the oyster Crassostrea gigas (Mollusca: Bivalvia). Tissue and Cell,46(5): 379—387
Bresciani M, Adamo M, de Carolis G et al, 2014. Monitoring blooms and surface accumulation of cyanobacteria in the Curonian Lagoon by combining MERIS and ASAR data.Remote Sensing of Environment, 146: 124—135
Margulies M, Egholm M, Altman W E et al, 2005. Genome sequencing in microfabricated high-density picolitre reactors.Nature, 437(7057): 376—380
O’Neil J M, Davis T W, Burford M A et al, 2012. The rise of harmful cyanobacteria blooms: the potential roles of eutrophication and climate change. Harmful Algae, 14: 313—334
Paul V J, 2008. Global warming and cyanobacterial harmful algal blooms. Advances in Experimental Medicine and Biology,619: 239—257
Sabour B, Loudiki M, Vasconcelos V, 2009. Growth responses of Microcystis ichthyoblabe Kützing and Anabaena aphanizomenoides Forti (cyanobacteria) under different nitrogen and phosphorus conditions. Chemistry and Ecology,25(5): 337—344
Urrutia-Cordero P, Agha R, Cirés S et al, 2013. Effects of harmful cyanobacteria on the freshwater pathogenic free-living amoeba Acanthamoeba castellanii. Aquatic Toxicology, 130—131: 9—17
Wang Z H, Yang J Q, Zhang D J et al, 2014a. Composition of microbial communities in industrial drain outlets. Journal of Pure and Applied Microbiology, 8(1): 807—815
Wang Z H, Yang J Q, Zhang D J et al, 2014b. Composition and structure of microbial communities associated with different domestic sewage outfalls. Genetics and Molecular Research,13(3): 7542—7552

