红松成熟合子胚愈伤组织诱导的适宜培养条件
红松成熟合子胚愈伤组织诱导的适宜培养条件
王祎1,赵彤彤1,杨魏1,马辉1,丁令智1,梁艳2,沈海龙1*
(1.东北林业大学 林学院,哈尔滨 150040;2.齐齐哈尔大学 生命科学与农林学院,黑龙江 齐齐哈尔 161006)
摘要:为了探索以红松成熟合子胚为外植体诱导愈伤组织的适宜培养条件,以GD、DCR、LM、MS等为基本培养基,以2,4-D和6-BA组成不同浓度激素组合,进行愈伤组织诱导试验。结果表明,①供试培养基均可诱导红松成熟合子胚产生愈伤组织,但DCR培养基上诱导的愈伤组织出现最早,出愈率显著高于其他培养基,达93.3%;②在DCR培养基中添加2,4-D与6-BA的各种组合均获得了较好的愈伤组织发生,但以2,4-D 2 mg/L+6-BA 0.5 mg/L和2,4-D 6 mg/L+6-BA 1 mg/L的出愈率最高,达96.7%。综上所述,红松成熟合子胚外植体诱导愈伤组织时,适宜基本培养基为DCR,适宜激素组合为2,4-D 2 mg/L+6-BA 0.5 mg/L。
关键词:红松;成熟合子胚;愈伤组织;基本培养基;激素组合
中图分类号:S 791.247
文献标识码:A
文章编号:1001-005X(2015)02-0005-03
Abstract:For the purpose of selecting proper culture conditions of callus induction from mature zygotic embryos of Pinus koraiensis Sieb.Et Zucc.,the callus induction experiment was conducted by using basic media of GD,DCR,LM and MS supplemented with different combinations of 2,4-D and 6-BA.The results showed that ①callus could be induced from the mature zygotic embryos of Korean pine on all types of media tested,but the earliest generation and highest induction rate was obtained on DCR medium,the callus induction rate on it could reached 93.3%;②relative high callus induction rates were obtained on DCR supplemented with the hormone combinations tested,but the highest rate(96.7%)was obtained from the combinations 2 mg/L 2,4-D plus 0.5 mg/L 6-BA and 6 mg/L 2,4-D plus 1.0 mg/L 6-BA.In conclusion,the proper protocol for callus induction from mature zygotic embryos of Korean pine was DCR supplemented with 2 mg/L 2,4-D plus 0.5 mg/L 6-BA.
Keywords:korean pine;mature zygotic embryo;callus;basic medium;hormone combinations
收稿日期:2014-10-15
基金项目:国家林业局林业公益性行业专项(201204320);东北林业大学创新训练项目(201410225149);齐齐哈尔大学青年科研基金项目(2012k-M22)
作者简介:第一王祎,本科生。研究方向: 林木种苗培育原理与技术研究。
通讯作者:*沈海龙,博士,教授。研究方向: 林木种苗培育原理与技术研究。E-mail:shenhl-cf@nefu.edu.cn
Proper Condition for Callus Induction from MatureZygotic Embryo Explants ofPinuskoraiensis
Wang Yi1,Zhao Tongtong1,Yang Wei1,Ma Hui1,Ding Lingzhi1,Liang Yan2,Shen Hailong1*
(1.School of Forestry,Northeast Forestry University,Harbin 150040;
2.School of Life Sciences and A & F,Qiqihar University,Qiqihar 161006,Heilongjiang Province)

引文格式:王祎,赵彤彤,杨魏,等.红松成熟合子胚愈伤组织诱导的适宜培养条件[J].森林工程,2015,31(2):5-7.
植物愈伤组织培养既是一种植物组织培养微繁的方法,也是植物遗传改良、种质材料保存和一些有用化合物生产的理想途径。胚性愈伤组织诱导是目前所有针叶树种体细胞胚胎发生的必经阶段,同时愈伤组织又是优良品种材料保存的主要形式。现代多品种林业(Multi-variety forestry,MVF)的优良品系选育方法中,结合体细胞胚胎发生技术是其中非常重要的一条新途径[1-3]。其中优良种质材料通过愈伤组织培养形成胚型愈伤组织,一部分直接增殖形成体胚和体胚苗进行鉴定,一部分用液氮保存可达5~10 a,这期间对体胚苗进行生长、形质、材性、抗虫抗病性等进行鉴定,选出优良种质材料,再利用液氮保存的材料大量增殖[1-3]。因此,愈伤组织特别是胚性愈伤组织的诱导,一直是研究的热点问题。
红松(PinuskoraiensisSieb.et Zucc)是温带地带性顶极群落红松阔叶林的建群种,是我国优质珍贵用材树种和坚果经济林树种,在我国生态环境保护与建设和林区经济发展及人们生活改善中具有重要意义。但由于长期掠夺性采伐,红松天然林资源受到极大破坏,急需发展红松人工林资源,一来可以替代天然林的生产作用,而减少对天然林资源的依赖度;二来可以为林区经济发展和人们生活水平提高提供更多的资源保证。发展人工林,需要有能够对优良种质材料进行大量快繁的技术,而体胚发生就是这样的一项技术[1-5]。基于愈伤组织诱导对体胚发生和MVF中的重要性,本研究选择红松的成熟合子胚作为外植体,开展了红松愈伤组织的诱导关键因子和条件的探讨分析,旨在为红松体细胞胚发生技术研究和MVF体系建立奠定基础。
1材料与方法
1.1 外植体的消毒与接种
先将红松成熟种子用中性洗涤剂清洗,再用自来水反复冲洗后去种皮,用10%次氯酸钠浸泡10 min后,用无菌水清洗3~5次,再用0.1%的升汞处理2.5 min,无菌水冲洗3~5次,无菌条件下剥取种胚并将完整合子胚水平接种于培养基上。每个处理接种6皿,每皿5个外植体。培养后30 d观察统计获得愈伤组织的外植体数及出愈率。
出愈率(%)=(获得愈伤组织的外植体数/总的外植体数)×100%
1.2 培养基种类的筛选
将红松成熟合子胚接种在愈伤组织诱导的不同类型的基本培养基上,添加2,4-D 2 mg/L,6-BA 0.5 mg/L,酸水解酪蛋白500 mg/L,L-谷氨酰胺500 mg/L,蔗糖3%,琼脂0.6%,pH值5.6~5.8,25℃黑暗条件下培养。其中。诱导20 d后观察愈伤组织诱导情况,筛选出最佳诱导培养基类型。
1.3 2,4-D和6-BA浓度的筛选
将红松成熟合子胚接种在分别添加不同浓度2,4-D和6-BA组合的DCR基本培养基上,添加酸水解酪蛋白500 mg/L,L-谷氨酰胺500 mg/L,蔗糖3%,琼脂0.6%,pH值5.6~5.8,25℃黑暗条件下培养。其中2,4-D浓度分别设置为2、4、6、8 mg/L,6-BA浓度分别设置为0、0.5、1.0 mg/L。诱导30 d后观察愈伤组织诱导情况,筛选出最佳激素处理组合。
2结果与分析
2.1 基本培养基对愈伤组织诱导的影响
经过灭菌处理的红松成熟合子胚分别接入GD、DCR、LM和MS 4种不同的诱导培养基上,3~5 d后部分合子胚开始有萌动,表现为子叶微张,胚轴膨大,或在近胚根处先形成接近透明的白色愈伤组织,两周后胚根处愈伤组织逐渐变为褐色。观察发现,接种于不同的培养基上的合子胚在培养过程中,在愈伤组织的获得情况上存在着一定的差异,由表1及观察可得出,在供试的几种培养基中,均可诱导红松成熟合子胚产生愈伤组织,其中DCR培养基中的愈伤组织获得情况最好,出愈率达到93.3%,与其他各处理的出愈率差异均达到显著,并且愈伤组织出现最早,约在培养3 d时即出现愈伤组织。综上结果可见,DCR培养基为诱导红松合子胚愈伤组织的最佳基本培养基。
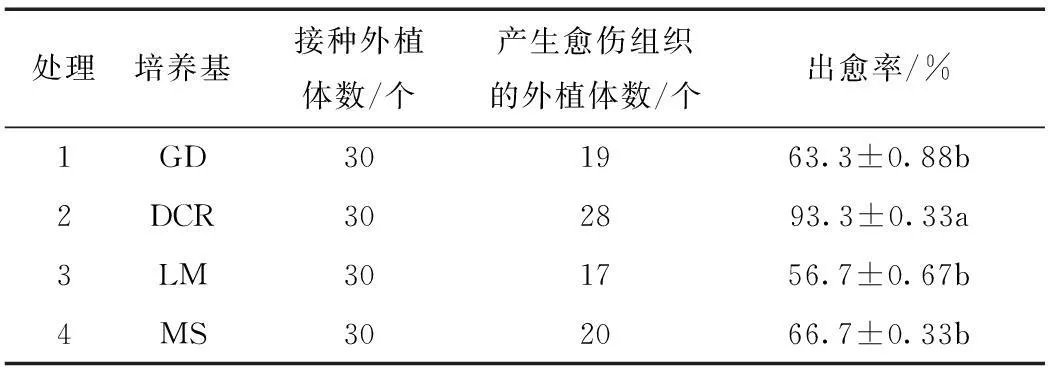
表1 基本培养基对红松成熟合子胚诱导愈伤组织的影响 Tab.1 Effects of media types on callus induction from mature zygotic embryos of Korean pine
注:出愈率后字母表示不同激素组合下的诱导率多重比较结果,标有相同字母表示无显著差异(α=0.05)。
2.2 2,4-D和6-BA浓度对愈伤组织诱导的影响
在DCR培养基中添加不同浓度组合的2,4-D和6-BA,得到不同的红松合子胚愈伤组织诱导率,见表2。总体来看,试验中各个激素组合均可获得愈伤组织发生,出愈率最高的是在DCR培养基中添加2,4-D 2 mg/L与6-BA 0.5 mg/L的组合及2,4-D 6 mg/L与6-BA 1 mg/L组合,出愈率均达到了96.7%;其次是DCR培养基中添加2,4-D 2 mg/L与6-BA 1.0 mg/L的组合及2,4-D 6 mg/L与6-BA 0.5 mg/L组合,出愈率均达到了93.3%,但与最高出愈率的2个组合差异不显著。从经济的角度考虑,最佳的处理组合浓度为向DCR培养基中添加2,4-D 2 mg/L与6-BA 0.5 mg/L。实际观测结果也表明,高浓度的2,4-D与低浓度的6-BA组合更有利于红松成熟合子胚的愈伤组织的诱导。图1是在DCR + 2,4-D 2 mg/L + 6-BA 0.5 mg/L方案下诱导产生的愈伤组织。
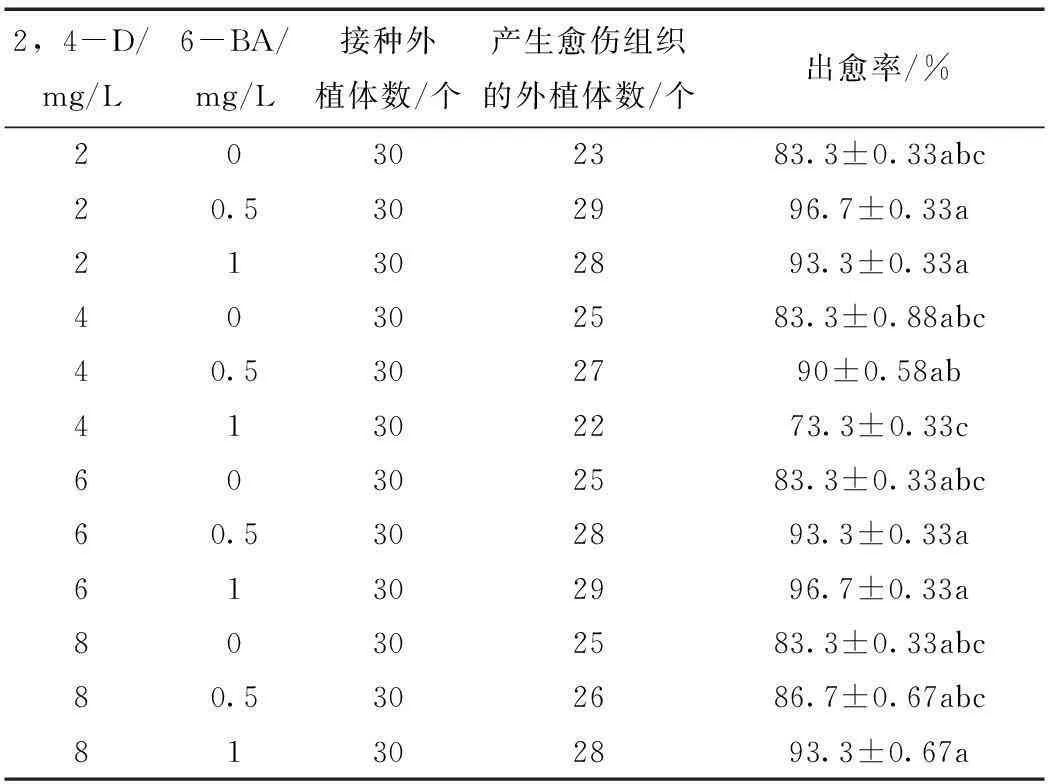
表2 2,4-D和6-BA浓度对红松成熟合子胚诱导愈伤组织的影响 Tab.2 Effect of 2,4-D and 6-BA concentrations on callus induction from mature zygotic embryos of Korean pine
注:出愈率后字母表示不同激素组合下的诱导率多重比较结果,标有相同字母表示无显著差异(α=0.05)。
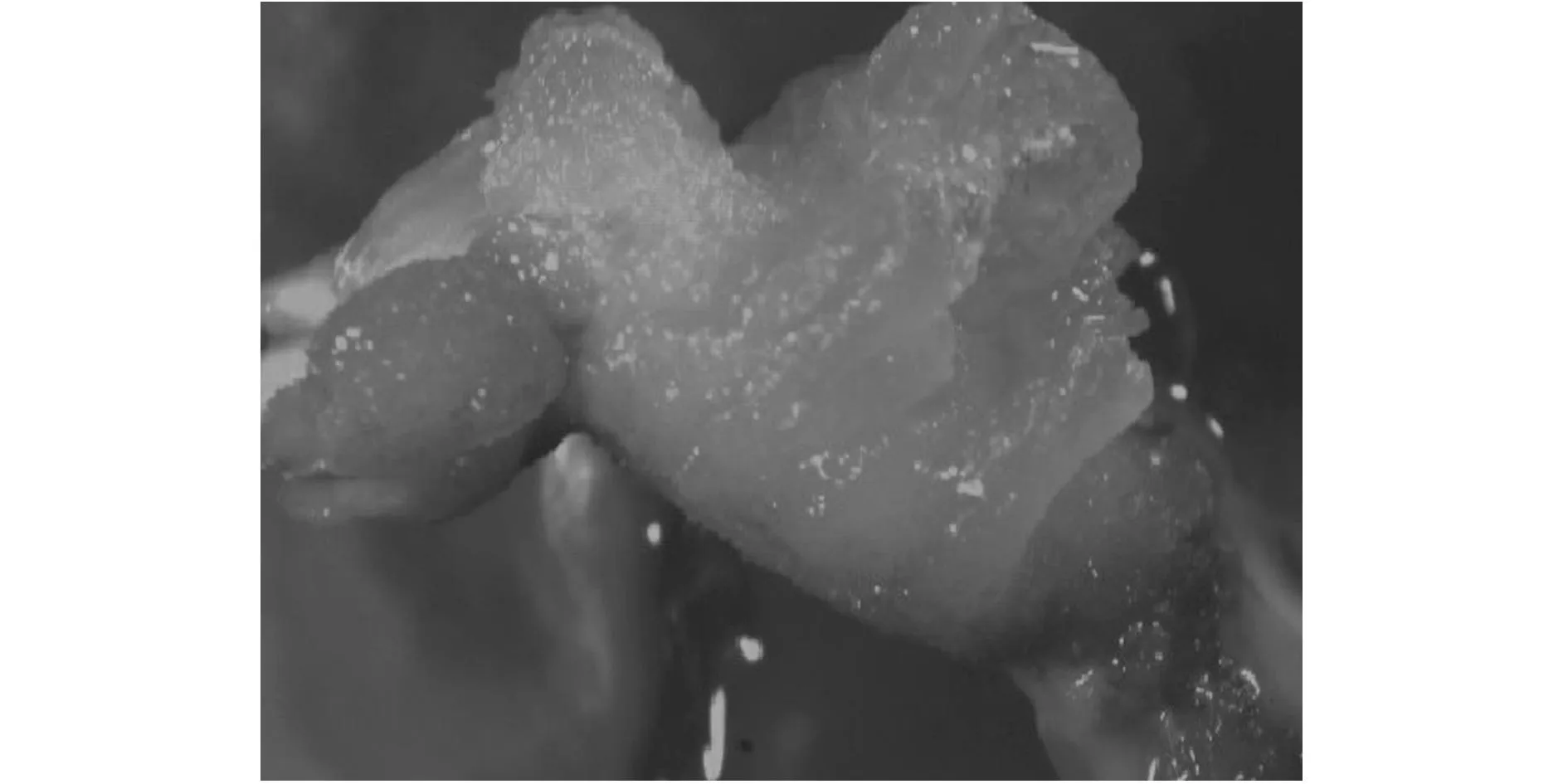
图1 DCR培养基添加2 mg o L -1 2,4-D+ 0.5 mg o L -1 6-BA诱导15 d形成的红松愈伤组织 Fig.1 Korean pine callus formed on DCR medium supplemented with 2 mg/L 2,4-D plus 0.5 mg/L 6-BA at 15 days culture
3结论与讨论
研究结果表明,供试的GD、DCR、LM、MS等4种培养基均可以从红松成熟合子胚外植体上诱导产生愈伤组织,但在DCR培养基上诱导的愈伤组织出现最早,出愈率显著高于其他培养基;在筛选出的DCR培养基中添加2 mg/L的2,4-D与0.5 mg/L的6-BA或添加6 mg/L的2,4-D与1.0 mg/L的6-BA,可获得96.7%的最高愈伤组织诱导率。因此,可以确定,DCR + 2,4-D 2 mg/L+6-BA 0.5 mg/L为从红松成熟合子胚外植体诱导产生愈伤组织的最佳方案。
成熟胚由于取材、处理、保存方便,同时又具备胚性较强、便于生产应用的特点,常常是进行愈伤组织诱导和体胚发生首选的外植体类型[3,5-12],喜玛拉雅白皮松(P.geradiana)[5]、糖松(P.lambertiana)[5]、乔松(P.wallichiana)[5]、华北落叶松(Larixprincipis-rupprechtii)[6]、华山松(P.armandii)[7]、湿地松(P.elliottii)[8]、杉木(Cunninghamialanceolata)[9]、思茅松(P.kesiyavar.langbianensis)[10]、兴安落叶松((Larixgmelini)[11]和云南松(P.yunnanensis)[12]等均用成熟胚诱导获得了愈伤组织。本项研究也表明,红松成熟胚作为外植体诱导愈伤组织是可行的。
通过选择适宜培养基或改良培养基配方是建立一个树种组织培养方案的第一步,针叶树愈伤组织诱导常用培养基主要有BLG、DCR、EDM、EM、GD、Glitz、LM、LPG、MS、MSG、SH、WPMG等[2,5-12],其中,无机盐含量较低、特别是NO-3和NH+4总量较低的DCR是松属树种应用成功最多的一种基本培养基[5,10,12]。本试验结果证明,DCR培养基的诱导红松成熟胚产生愈伤组织的效果明显好于其它培养基,这说明红松成熟合子胚的愈伤组织诱导符合多数松属树种对培养基组成成分的要求特点。
激素的种类及配比对植物愈伤组织的诱导会产生重要的影响。众多试验研究表明针叶树植物愈伤组织的诱导一般在含有较高浓度的生长素和较低浓度的细胞分裂素的培养基上进行,其中以2,4-D和6-BA组合最为常见和有效[2,5-12]。本项研究结果表明,2,4-D和6-BA的适宜组合也是红松成熟胚愈伤组织诱导的条件,与大多数松属树种的要求一致。
探索一个树种的组织培养方案时,筛选适宜的基本培养基类型和合适的细胞分裂素与生长素浓度组合都是基本步骤。本研究筛选确定了红松成熟合子胚愈伤组织的适宜基本培养基和合适的激素浓度组合,为下一步的愈伤组织的保持与增殖、体胚的诱导、体细胞胚的萌发、转化等其他环节的实验研究奠定了基础。
【参考文献】
[1]Park Y S.Conifer somatic embryogenesis and multi-varietal forestry [A].In:Trevor F(Ed.).Challenges and Opportunities for the World’s Forests in the 21st Century[M].Netherlands:Springer,2014:425-439.
[2]Find J I,Hargreaves C L,Reeves C B.Progress towards initiation of somatic embryogenesis from differentiated tissues of radiata pine(Pinus radiata D.Don)using cotyledonary embryos [J].In Vitro Cell.Dev.Biol.Plant,2014,50:190-198.
[3]Lelu-Walter M A,Thompson D,Harvengt L,et al.Somatic embryogenesis in forestry with a focus on Europe state-of-the-art,benefits,challenges and future direction [J].Tree Genetics & Genomes,2013,9:883-899.
[4]Pullman G S,Bucalo K.Pine somatic embryogenesis:analyses of seed tissue and medium to improve protocol development [J].New Forests,2014,45(3):353-377.
[5]Pullman G S,Bucalo K.Pine somatic embryogenesis using zygotic embryos as explants [A].In:Trevor A.Thorpe and Edward C.Yeung(eds.),Plant Embryo Culture:Methods and Protocols[M].Humana Press,2011:267-291.
[6]韩登媛,李旦,赵健,等.华北落叶松胚性愈伤组织诱导影响因子的研究[J].林业科学研究,2013,26(4):454-458.
[7]逯昀,孙景梅,侯佳.华山松胚性愈伤组织的诱导研究[J].北方园艺,2010(11):155-157.
[8]何月秋,池树友.激素对诱导湿地松成熟胚胚性愈伤组织影响的初步研究[J].四川林业科技,2007,28(1):74-76,80.
[9]席梦利,施季森.杉木合子胚愈伤组织的诱导及植株再生[J].南京林业大学学报(自然科学版),2006,30(2):6-10.
[10]吴涛,陈少瑜,陈芳,等.思茅松胚性愈伤组织的诱导[J].中南林业科技大学学报,2007,27(5):74-78.
[11]赵晓敏,沈海龙,杨玲,等.兴安落叶松胚性愈伤组织诱导影响因子的研究[J].植物研究,2007,27(5):538-543.
[12]于大德,肖宁,王企珂,等.云南松胚性愈伤组织诱导及增殖[J].西北植物学报,2011,31(10):2119-2123.
[责任编辑:刘美爽]

