纤连蛋白降解片段对心肌细胞腱糖蛋白C表达的影响
纤连蛋白降解片段对心肌细胞腱糖蛋白C表达的影响
韦舒杰,马双陶,杨大春,王强,李德,唐兵,杨永健
(成都军区总医院心血管内科,四川成都610083)
【摘要】目的:探讨纤连蛋白(fibronectin,FN)降解片段对心肌细胞腱糖蛋白C(tenascin-C,TN-C)再表达的影响。方法:通过构建携带FN片段(包括FN-f1、FN-f2、FN-f3、FN-f4、FN-f5、FN-f6和FN-f7)慢病毒载体转染H9C2心肌细胞,采用免疫荧光及Western blotting检测TN-C的表达和分布情况。结果:相比于对照组,FN-f1、FN-f2、FN-f3和FN-f5组,免疫荧光结果显示TN-C表达升高幅度分别为(2.72±0.11)、(2.51±0.06)、(2.14±0.10)、(2.39±0.09),Western blotting则分别升高(0.415± 0.009)、(0.290±0.012)、(0.386±0.014)、(0.332±0.016),TN-C表达显著升高,同时FN表达不受影响。而FN-f4、FN-f6和FN-f7对TN-C及FN的表达均没有影响。结论:部分FN片段可能参与TN-C的再表达和心肌重构的过程。
【关键词】腱糖蛋白C;纤连蛋白;心肌重构
心室重构,是促进心力衰竭病程进展的主要病理生理过程。在心室重构的过程中,细胞外基质(extracellular matrix,ECM)的相互作用发挥了重要的生物信号作用[1]。在心脏各种ECM分子中,腱糖蛋白C(tenascin-C,TN-C)因其在心室重构进程中调控心肌细胞与细胞外基质组织之间粘附,影响心肌细胞的生物学行为,而倍受重视[2-3]。虽然TN-C在心室重构发展中的具体作用尚不清楚,但研究提示TN-C可能是调控心肌重构进展的潜在治疗靶点[4]。
TN-C出现在胚胎期心脏发生发育多个重要过程中,而在健康成人心脏组织中停止表达[5-6]。重要的是在心脏发生各种病理状况时(例如心力衰竭),又可发生再表达[7]。然而,目前的研究还未能明确可促使TN-C再表达的确切诱导物。我们先前的报道已经证实TN-C基质沉积与纤连蛋白(fibronectin,FN)降解有关,并且在心肌细胞与成纤维细胞共培养模型中,纤连蛋白降解片段可诱导TN-C基质沉积[8]。然而,何种类型的纤连蛋白降解片段可以促使TN-C的再表达尚不清楚。
在本研究中,构建了表达FN降解片段的慢病毒载体,包括FN-f1、FN-f2、FN-f3、FN-f4、FN-f5、FN-f6和FN-f7,通过转染H9C2心肌细胞,其后评估研究上述片段对TN-C表达的影响。
1 材料与方法
1.1H9C2心肌细胞培养
实验经过成都军区总医院伦理委员会批准。大鼠胚胎源性心肌成肌细胞H9C2细胞购自中国科学院上海细胞库(中国,上海),细胞于包含10%优质胎牛血清(GIBCO)、100 U/mL青链霉素(Hyclone)的DMEM F12培养基(Hyclone)中培养,95%空气,5%二氧化碳,37℃。
1.2pMD19T-FN-fs载体构建
人FN前体基因(GeneID: X02761.1)序列被划分为7个片段。293T细胞总RNA按照TRIZOL(Invitrogen)操作流程提取,反转录合成cDNA随后用于FN-f1、FN-f2、FN-f3、FN-f4、FN-f5、FN-f6和FN-f7合成模板。引物序列如下: FN-f1-F:5'CTG TCA TTA ATT AAG CCA CCA TGG ACG AGC TTC CCC AAC TGG T 3',FN-f1-R: 5'TAT TCG GCG CGC CCT ACC CAG GTC TGC GGC AGT T 3'; FN-f2-F: 5'CTG TCA TTA ATT AAG CCA CCA TGG CTA TTC CTG CAC CAA CTG ACG 3'; FN-f2-R: 5'TAT TCG GCG CGC CCT AAG TGG AGG CGT CGA TGA CC 3'; FN-f3-F: 5' CTG TCA TTA ATT AAG CCA CCA TGC CTA TCT CTG ATA CCA TCA TCC CA 3'; FN-f3-R:5'TAT TCG GCG CGC CCT AGC TTG CGG GGC TGT CTC CA 3'; FN-f4-F:5'CTG TCA TTA ATT AAG CCA CCA TGC AGC CTG GGA GCT CTA TTC C 3'; FN-f4-R: 5'TAT TCG GCG CGC CCT ATG GGA TGA TGG TAT CAG AGA TAG G 3'; FN-f5-F: 5'CTG TCA TTA ATT AAG CCA CCA TGA GTG GTC CTG TCG AAG TAT TTA TCA 3'; FN-f5-R: 5'TAT TCG GCG CGC CCT ACA GTG TGG TAA AGA CTC CAG TGG C 3'; FN-f6-F: 5'CTG TCA TTA ATT AAG CCA CCA TGT GTG TCA CAG ACA GTG GTG TGG T 3'; FN-f6-R: 5'TAT TCG GCG CGC CCT ATG AGC TTG GAT AGG TCT GTA AAG GT 3'; FN-f7-F:5'CTG TCA TTA ATT AAG CCA CCA TGT GTT ATG ACA ATG GAA AAC ACT ATC 3'; FN-f7-R: 5'TAT TCG GCG CGC CCT ACC TCT CAC ACT TCC ACT CTC CTC 3'。将克隆的cDNA连接到pMD-19T载体(TaKaRa,日本),生成pMD19T-FN-fs,转化至大肠杆菌DH5α细胞中,含有质粒的菌落在X-gal/IPTG/Amp平板中筛选。PacI 和AscI消化pMD19T-FN-fs,1.5%琼脂糖凝胶电泳评价。ABI3730XL DNA分析仪(国际设备贸易有限公司,美国)测定pMD19T-FN-fs载体序列。
1.3pLenti6.3-FN-fs-IRES-EGFP载体构建
pMD19T-FN-fs和pLenti6.3-MCS-IRES-EGFP经PacI和AscI消化,T4 DNA连接酶连接,形成pLenti6.3-FN-fs-IRES-EGFP载体。PacI和AscI消化pLenti6.3-FN-fs-IRES-EGFP载体,1.5%琼脂糖凝胶电泳评价。ABI3730XL DNA分析仪测定pLenti6.3-FN-fs-IRES-EGFP载体序列。
1.4慢病毒包装、滴度测定及转染H9C2细胞
pLenti6.3-FN-fs-IRES-EGFP质粒及病毒包装质粒混合物共同转染293T细胞,达到50%~70%融合时,大约各质粒90 mg转染入293T细胞。48 h后,收集上清测定被转染293T细胞病毒滴度。选择生长状态良好的H9C2细胞使用病毒工作液进行转染,使感染效率达到80%以上。
1.5免疫荧光试验
培养的细胞4%多聚甲醛固定15 min,PBS洗涤,4%牛血清蛋白封闭,兔来源抗-FN(1∶200稀释,Bioworld Technology,美国)和抗TN-C(1∶200稀释,Epitomics,美国)一抗4℃孵育过夜,PBS洗涤,荧光探针Cy3标记偶联的山羊抗兔IgG(1∶1 000稀释,Proteintech,中国武汉)二抗室温孵育40 min,PBS洗涤,DAPI核染10 min,PBS冲洗后,激光共聚焦显微镜(Olympus FluoView FV1000,美国)拍摄成像。
1.6Western-blotting检测
通过如前所述Western印迹法检测TN-C蛋白表达量[9]。蛋白裂解缓冲液均化细胞获得蛋白裂解产物。蛋白质浓度用BCA蛋白分析试剂盒(R&S生物技术有限公司,中国上海)测定。SDS-聚丙烯酰胺凝胶电泳(12%)分离提取等量蛋白,随后与将样品转印至PVDF膜,5%脱脂奶粉溶液室温孵育封闭1 h,抗TN-C(1∶1 000稀释,Epitomics公司,美国)和GAPDH(稀释1∶5 000,Bioworld Technology公司,美国)抗体室温孵育2 h,其后HRP标记的山羊抗兔二抗(1∶5 000稀释,Abmart,中国上海)室温孵育1 h,ECL化学发光试剂盒(Amersham Biosciences公司,瑞典)定影。NIH Image 1.61定量分析。
1.7Real-time PCR
Trizol法(Invitrogen)提取H9C2细胞总RNA。cDNA合成试剂盒(Fermentas国际公司,加拿大)将1μg总RNA反转录为单链cDNA。Mastercycler EP Realplex实时荧光定量PCR仪(Eppendorf,美国)中执行Real-time PCR反应,FN-fs mRNA水平通过SYBR Green(Qiagen)进行定量。相关引物序列如下: FN-f1-F:5'ACT GAA AGA CCA GCA GAG GC 3',FN-f1-R: 5'CCA ACG GCA TAA TGG GAA A 3',132bp; FN-f2-F: 5'AAA GAA ATC AAC CTT GCT CCT G 3',FN-f2-R: 5'CTG GTC TGC TTG TCA AAG TGT C 3',115bp; FN-f3-F: 5'AGG GAC CTG GAA GTT GTT GC 3',FN-f3-R: 5'CCT CCT GTT TCT CCG TAA GTG 3',107bp; FN-f4-F: 5'AGA ATT GGT TTT AAG CTG GGT G 3',FN-f4-R: 5'TCT CAG GAC TTG GAT GGT GTA G 3',138bp; FN-f5-F:5'GAC TCC CTT TTC TCC TCT TGT G 3',FN-f5-R: 5'CAG GTA CTG TGG CTC ATC TCC 3',154bp; FN-f6-F: 5'CAG GAC GGA CAT CTT TGG TG 3',FN-f6-R: 5'CAG GAC GGA CAT CTT TGG TG 3',148bp; FN-f7-F: 5'GTG TCT TGG TAA TGG AAA AGG A 3',FN-f7-R: 5'CAA TCT ACC ATC ATC CAG CCT 3',135bp; rACTB-F: 5'GCT ATG TTG CCC TAG ACT TCG A 3',rACTB-R: 5'GAT GCC ACA GGA TTC CAT ACC 3',173bp。
1.8统计学分析
数据采用SPSS13.0统计软件进行统计学分析,不同转染组及与对照组间样本均数比较采用单因素方差分析。取P<0.05,认为差异有统计学意义。
2 结果
2.1心肌细胞FN-fs的过表达
采用荧光定量PCR对FN-fs过表达进行评估。结果显示,转染后3 d,与空慢病毒处理组相比,FN-f1至FN-f7的表达依次增加了507倍、464倍、363倍、63倍、452倍、657倍和59倍。
2.2FN-fs转染对FN表达的影响
免疫荧光检测FN-fs转染后H9C2细胞FN表达情况。结果显示所有类型FN-fs转染均未能引起FN表达情况的显著改变(图1)。

图1 免疫荧光检测FN-fs转染后H9C2细胞FN表达情况
2.3FN-fs转染对TN-C表达的影响
通过免疫荧光(图2)和Western印迹法(图3)检测FN-fs转染后的H9C2细胞TN-C的表达情况。免疫荧光结果显示,在未处理对照细胞组以及空白慢病毒载体转染细胞组中,未探及TN-C有明显表达,FN-f1、FN-f2、FN-f3和FN-f5慢病毒载体组中,TN-C表达升高幅度分别为2.72±0.11、2.51± 0.06、2.14±0.10、2.39±0.09,明显高于对照组,P<0.01,差异有统计学意义。在Western印迹法结果中,FN-f1,FN-f2,FN-f3和FN-f5组相对于对照组,分别升高0.415±0.009、0.290±0.012、0.386± 0.014、0.332±0.016,TN-C表达明显增高,P<0.01,差异有统计学意义。而FN-f4、FN-f6和FN-f7 这3种FN片段过表达无论是在免疫荧光或是Western印迹法检测中,对TN-C的表达均无影响。
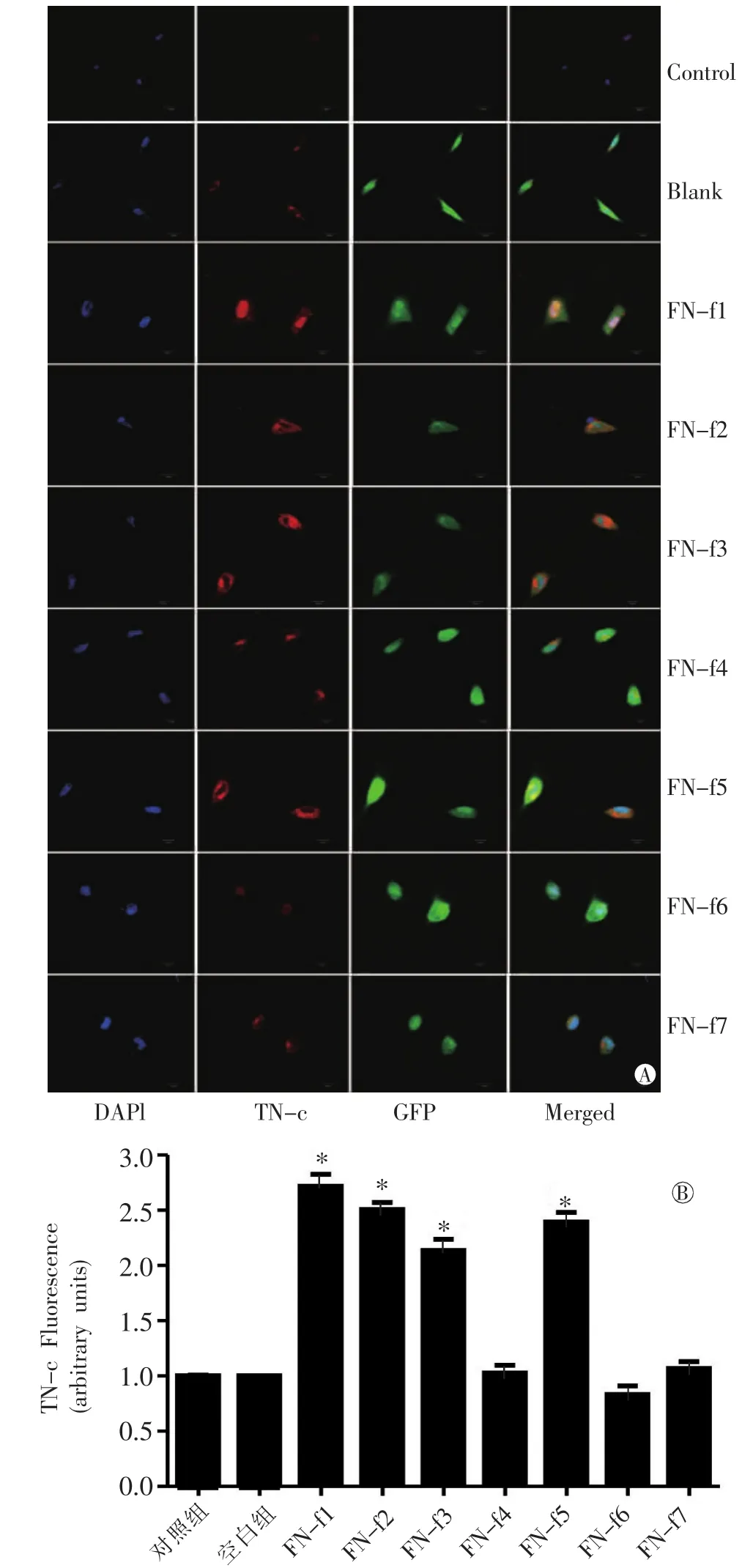
图2 FN-fs转染后H9C2细胞TN-C的表达情况

图3 Western印迹法显示FN-fs转染后的H9C2细胞TN-C的表达情况
3 讨论
本研究的创新之处在于发现了FN-f1、FN-f2、FN-f3和FN-f5可以诱导H9C2细胞TN-C的再表达。TN-C作为TN蛋白家族发现最早也是最重要的一员,已被证实其在心力衰竭和心室重构发展过程中发挥着重要作用[7]。同时,血清TN-C水平与心肌梗死后心室重构相关,并且可以作为扩张型心肌病以及肥厚型心肌病患者有用的预后标志物[10-14]。TN-C基因敲除小鼠的实验性运用,更为TN-C可加重心室重构、心肌纤维化、心梗后残余心肌组织纤维化提供了强有力的证据[15]。基于当前的相关研究,我们可大胆预测TN-C可作为一类控制及治疗心室重构心力衰竭的新靶点。但可调控TN-C表达的相关因素仍未见有报道。
我们之前的研究证实了依赖于基质金属酶激活的FN降解,可诱导心肌组织中TN-C基质沉积。可并未能明确哪一类型的FN降解片段可促使TN-C的再表达。本研究表明,FN-f1、FN-f2、FN-f3和FN-f5可以在TN-C诱导再表达中发挥重要作用。我们的发现可能有助于进一步理解FN降解片段调控TN-C再表达的具体机制。并且可以进一步推断,FN-f1、FN-f2、FN-f3和FN-f5可成为有效治疗心力衰竭和阻止心室重构进展的潜在靶点。
参考文献
[1]Howard CM,Baudino TA.Dynamic cell-cell and cell-ECM interactions in the heart[J].Mol Cell Cardiol,2014,70(1):19-26.
[2]Hsia HC,Schwarzbauer JE.Meet the tenascins: multifunctional and mysterious[J].Biol Chem,2005,280(29):26641-26644.
[3]Brellier F,Tucker RP,Chiquet-Ehrismann R.Tenascins and their implications in diseases and tissue mechanics[J].Med Sci Sports,2009,19(4):511-519.
[4]Taki J,Inaki A,Wakabayashi H,et al.Dynamic expression of tenascin-C after myocardial ischemia and reperfusion: assessment by 125I-anti-tenascin-C antibody imaging[J].Nucl Med,2010,51 (7):1116-1122.
[5]Imanaka-Yoshida K,Matsumoto K,Hara M,et al.The dynamic expression of tenascin-C and tenascin-X during early heart development in the mouse[J].Differentiation,2003,71(4-5):291-298.
[6]Franz M,Jung C,Lauten A,et al.Tenascin-C in cardiovascular remodelling: potential impact for diagnosis,prognosis estimation and targeted therapy[J].Cell Adh Migr,2015,doi: 10.1080/19336918.2014.1000075.
[7]Golledge J,Clancy P,Maguire J,et al.The role of tenascin C in cardiovascular disease[J].Cardiovasc Res,2011,92(1):19-28.
[8]Ma S,Yang D,Li D,et al.Cardiac extracellular matrix tenascin-C deposition during fibronectin degradation[J].Biochem Biophys Res Commun,2011,409(2):321-327.
[9]Yang D,Ma S,Li D,et al.Angiotensin II receptor blockade improves matrix metalloproteinases/tissue inhibitor of matrix metalloproteinase-1 balance and restores fibronectin expression in rat infarcted myocardium[J].Biochem Biophys Res Commun,2009,388 (3):606-611.
[10]Terasaki F,Okamoto H,Onishi K,et al.Higher serum tenascin-C levels reflect the severity of heart failure,left ventricular dysfunction and remodeling in patients with dilated cardiomyopathy[J].Circ J,2007,71(3):327-330.
[11]Kitaoka H,Kubo T,Baba Y,et al.Serum tenascin-C levels as a prognostic biomarker of heart failure events in patients with hypertrophic cardiomyopathy[J].Cardiol,2012,59(2):209-214.
[12]Sato A.Serum tenascin-C might be a novel predictor of left ventricular remodeling and prognosis after acute myocardial infarction [J].Am Coll Cardiol,2006,47(11):2319-2325.
[13]Kotby AA,Manal M,Abdel A,et al.Can serum tenascin-C be used as a marker of inflammation in patients with dilated cardiomyopathy [J].Pediatr,2013,doi:10.1016/j.ehj.2013.12.009.
[14]Niebroj-Dobosz I,Madei-Pilarczyk A,Marchel M,et al.Circulating tenascin-C levels in patients with dilated cardiomyopathy in the course of Emery-Dreifuss muscular dystrophy[J].Clin Chim Acta,2011,412(17-18):1533-1538.
[15]Nishioka T,Onishi K,Shimoil N,et al.Tenascin-C may aggravate left ventricular remodeling and function after myocardial infarction in mice[J].Physiol Heart Circ Physiol,2010,298(3): H1072-H1078.
Effects of fibronectin fragments on tenascin-C expression in heart cells
WEI Shu-jie,MA Shuang-tao,YANG Da-chun,WANG Qiang,LI De,TANG Bing,YANG Yong-jian
(Department of Cardiology,Chengdu Military General Hospital,Chengdu 610083,Sichuan,China)
【Abstract】Objective: To determine which fibronectin (FN)degradation fragments contribute to the induction of tenascin-C (TN-C)re-expression.Methods: Lentiviral vectors carrying FN fragments,including FN-f1,FN-f2,FN-f3,FN-f4,FN-f5,FN-f6 and FN-f7 were constructed.The protein expressions of TN-C and FN were measured with immunofluorescence assay and Western blotting.Results: Transfection with FN-f1,FN-f2,FN-f3 and FN-f5 significantly induced TN-C expression but did not affect FN expression in H9C2 cells.However,FN-f4,FN-f6 and FN-f7 did not affect the TN-C expression.Conclusion: Some FN fragments may be involved in TN-C re-expression and the development of ventricular remodeling.
【Key words】Tenascin-C; Fibronectin; Myocardial remodeling
通讯作者:杨永健,E-mail: yangyongjian38@yahoo.com
作者简介:韦舒杰(1986-),男,四川宜宾人,硕士研究生,主要从事心血管疾病方面的研究。
基金项目:国家自然科学基金面上项目(81070191),四川省科技厅项目(2012JY0029)
收稿日期:2014-12-13
doi:10.3969/j.issn.1005-3697.2015.02.01
【文章编号】1005-3697(2015)02-0135-05
【中图分类号】R735.7
【文献标志码】A
网络出版时间: 2015-5-1 01∶33网络出版地址: http://www.cnki.net/kcms/detail/51.1254.R.20150501.1333.035.html

