缺氮和复氮对菘蓝幼苗生长及氮代谢的影响
*通信作者:唐晓清,博士,副教授,硕士生导师,主要从事药用植物栽培与中药质量控制。E-mail:xqtang@njau.edu.cn
缺氮和复氮对菘蓝幼苗生长及氮代谢的影响
施晟璐,叶冰竹,张润枝,聂鹏卿,唐晓清*,王康才
(南京农业大学 园艺学院,南京 210095)
摘要:对基质育苗后水培的菘蓝进行缺氮与复氮处理,分析其生长情况及氮代谢产物含量的变化,探讨缺氮和复氮对菘蓝幼苗生长及氮代谢的影响,以提高菘蓝产量和品质以及栽培过程中的氮素利用效率。结果显示:(1)正常供氮条件下,菘蓝幼苗的叶绿素含量、谷氨酰胺合成酶(GS)活性、硝态氮含量、靛玉红含量为最高,而其株高、主根直径、根的鲜重与干重、叶的鲜重与干重、根系活力均最小。(2)缺氮处理增加了菘蓝幼苗的主根直径和根干重,提高其根系活力和硝酸还原酶(NR)活性,促进游离氨基酸在叶中的积累;但降低了GS的活性,也降低了叶中硝态氮、可溶性蛋白、靛玉红及根中游离氨基酸的含量;缺氮对叶中靛蓝的含量无明显影响。(3)复氮处理增加了菘蓝幼苗的株高、主根长、根鲜重、叶鲜重、叶干重,提高了其根系活力,降低了NR和GS的活性;与对照相比,复氮降低了叶中硝态氮含量,提高了叶中可溶性蛋白、靛蓝及根中游离氨基酸的含量,但对叶中游离氨基酸和靛玉红含量影响较小。研究表明,缺氮后再复氮有利于菘蓝幼苗叶的生长,同时有利于增加其叶内靛蓝含量,从而提高其产量和品质。
关键词:缺氮;复氮;菘蓝;生长;氮代谢
收稿日期:2014-09-16;修改稿收到日期:2014-12-22
基金项目:国家自然科学基金(31171486);国家大学生创新创业训练计划(201410307026)
作者简介:施晟璐(1991-),女,在读硕士研究生,主要从事药用植物栽培与中药质量控制。E-mail:2013104131@njau.edu.cn
中图分类号:Q945.79 文献标志码:A
Effect of Ndeficiency and N Recovery on Growth and
Nitrogen Metabolism ofIsatisindigoticaSeedlings
SHI Shenglu,YE Bingzhu,ZHANG Runzhi,NIE Pengqing,TANG Xiaoqing*,WANG Kangcai
(College of Horticulture,Nanjing Agricultural University,Nanjing 210095,China)
Abstract:The seedlings of Isatis indigotica in hydroponic cultivation,which seeds were planted in media,were treated by Ndeficiency and N recovery,and the growth and contents of nitrogen metabolites were analyzed to study the effect of Ndeficiency and N recovery on growth and nitrogen metabolism of I.indigotica seedlings,and so as to increase the yields,quality and nitrogen utilization.The results showed that:(1)The content of chlorophyll,nitrate,indirubin,glutamine synthetase (GS) activity were the largest,and plant height,main rootdiameter,fresh weight anddry weight of root,fresh weight anddry weight of leaf and root activity were minimal under the normal treatment.(2)Ndeficiency could increase main rootdiameter anddry weight of root,improve the root activity and the activity of nitrate reductase (NR),promote the accumulation of free amino acid in the leaves.Meanwhile,it reduced the GS activity,the contents of nitrate,soluble protein and indirubin in leaves and free amino acids in roots.There were almost no influences to the content of indigo in leaves under Ndeficiency.(3)N recovery enhanced the weight of plant height,root length,root fresh weight,leaf fresh weight,dry weight of leaves,improved its root activity and reduced the NR and GS activity.Compared with normal process,N recovery reduced the contents of nitrate nitrogen in leaves,improved the content of soluble protein,indigo in leaves and free amino acids in roots.There were little influences to the contents of free amino acids and indirubin in leaves.These results indicated that N recovery after Ndeficiency was beneficial to the leaf growth and the increasing of indigo of I.indigotica seedlings.
Key words:Ndeficiency;N recovery;IsatisindigoticaFort.;growth;nitrogen metabolism
氮是植物所需的大量元素之一,是植物体内重要物质的组成成分,如核酸、蛋白质、酶、叶绿素等[1]。氮素水平影响药用植物的生长发育,对其生理生化反应强度、途径起着调节作用,从而影响其初生和次生代谢[2]。缺氮植物往往表现为植株矮小、叶片发黄,严重缺氮时叶片变褐甚至死亡[3]。但也会出现特殊情况,张燕[4]在研究过程中发现少量供氮比不供氮更不利于甘草的生长,苏文华[5]发现氮素施用量虽与短葶飞蓬植株生物量呈极显著的正相关,但与灯盏乙素和总咖啡酸酯含量则表现出显著的负相关。
植物首先通过根部吸收土壤中的铵盐或硝酸盐,因此氮素的盈亏首先影响植物的根系。根系形态如根长、根表面积等对氮的吸收起着重要作用。王艳等[6]研究表明,氮对玉米地上部生长的促进作用远大于根系,高氮对根系生长的抑制作用表现为平均根长及根系生物量的降低。硝酸还原酶(nitrate reductase,NR)与谷氨酰胺合成酶(glutamine synthetase,GS)都是氮素同化过程中的关键酶。植物体内NO3-首先在NR作用下还原为NO2-,然后在亚硝酸还原酶(NIR)作用下还原为NH4+,NH4+通过GS-GOGAT途径同化为有机氮。李彩凤等[7]研究表明水培条件下甜菜叶片中NR活性随硝态氮比例的增加而增加。黄勤妮等[8]研究发现NO3-能促进小麦幼苗完整叶片和离体叶片的叶绿体谷氨酰胺合成酶(GS2)的活性。氨基酸是构成蛋白质的主要成分,其含量在一定程度上反映植物的氮利用情况和氮代谢状况。氨基酸的合成直接或间接影响着植物生长发育的各个方面,并作用于氮源的同化和源-库转运[9]。谭勇等[10]报道,缺氮处理引起膜荚黄芪游离氨基酸的显著降低,表明氮肥具有调节氨基酸代谢的重要作用。
十字花科植物菘蓝(IsatisindigoticaFort.)的干燥叶入药为大青叶,靛蓝与靛玉红是其体内的重要活性成分,均属于其体内次生代谢形成的吲哚类化合物,靛蓝的生成是色氨酸水解酶和萘双加氧酶共同作用的结果[11],羟基吲哚和吲哚醌缩合形成靛玉红[12]。不同形态氮素的适宜组合能有效地提高大青叶的活性成分和生物量[13],武新红[14]的研究表明,在低施肥量的情况下,靛蓝、靛玉红的含量随施肥量的增加而增加。段飞等[15]在研究盐、低温、干旱、脱落酸等胁迫条件下培养30d的无菌幼苗,发现适当的逆境胁迫有利于菘蓝中的靛玉红积累。在栽培生产中氮营养过多,不仅对环境造成影响,同时可能影响药用植物的次生代谢产物[16]。缺氮胁迫下植物仍能生长[17],但长时间缺氮势必影响其整个生育期的生长,因此需要研究适度缺氮后再进行复氮处理对植物生长的影响。本试验通过水培方式对菘蓝幼苗进行缺氮和复氮处理,考察菘蓝幼苗的生长指标及氮代谢产物的响应特征,旨在了解氮素盈亏对菘蓝生长的影响,为实际生产中获得高产量、高品质的大青叶和板蓝根药材,提高氮素利用效率及避免环境污染提供理论依据。
1材料和方法
1.1 材料培养及处理
菘蓝为来自山西的栽培居群,经南京农业大学王康才教授鉴定为十字花科植物菘蓝,取籽粒饱满、大小均一的菘蓝角果(生产中称种子),用10%次氯酸钠溶液浸泡10 min后冲洗干净,置于培养皿内,于人工气候培养箱中催芽72 h,培养条件为:光照时间18 h/6 h(光/暗),光照度20 000 lx,温度25 ℃/15 ℃(昼/夜)。种子萌发后将其移入穴盘中用基质(蛭石∶有机质=1∶1)栽培,培养时间为2014年3月24日至6月6日,隔天浇1次水,6月7日将幼苗移入自制水培箱中培养,水培基本营养液参照Hoagland营养液配方[18]。
试验共设置对照、缺氮、复氮3组处理。对照组采用基本营养液;缺氮组采用缺氮营养液,共培养15d;复氮组前6d采用基本营养液,之后4d采用缺氮营养液,缺氮4d后采用基本营养液继续培养5d。每个处理3次重复。处理期间每隔1d换1次营养液。培养条件为:光照时间12 h/12 h(光/暗)、光照度20 000 lx、温度25 ℃/20 ℃(昼/夜)。6月22日将水培幼苗移至日光下,用叶绿色测定仪测定其叶绿素相对含量(SPAD值),取部分鲜样用于硝酸还原酶(NR)和谷氨酰胺合成酶(GS)活性的测定,其余幼苗均在测定生长指标后杀青、烘干、粉碎保存,用于其他指标的测定。
1.2 测定项目及方法
1.2.1生长指标各处理组选取10株菘蓝幼苗,测量株高(基生叶从根头部起至最长叶片顶端)、主根长与主根直径,再分别测量各处理组的叶与根的鲜重。之后置于烘箱内,105 ℃杀青15 min后在60 ℃下烘干至恒重,称取叶与根的干重,并粉碎过60目筛,备用。
1.2.2叶绿素相对含量各处理组随机选取10株菘蓝幼苗,采用SPAD 502叶绿素测定仪测定其SPAD值。
1.2.3根系活力采用TTC法测定根系活力[19]。各处理组进行3次重复测定。
1.2.4NR和GS活性称取0.5 g菘蓝幼苗叶的鲜样,NR活性采用南京建成生物工程研究所的试剂盒(A096)进行测定,GS活性采用南京建成生物工程研究所的试剂盒(A047)进行测定。各处理组进行3次重复测定。
1.2.5硝态氮含量参照王学奎[19]的方法测定菘蓝幼苗叶中的硝态氮含量。各处理组进行3次重复测定。
1.2.6游离氨基酸含量分别称取菘蓝叶、根的粉末各0.1 g,用60%的乙醇超声提取15 min后,参照王学奎[19]的方法测定菘蓝幼苗叶、根中的游离氨基酸含量。各处理组进行3次重复测定。
1.2.7可溶性蛋白含量称取0.2 g菘蓝叶的粉末,用蒸馏水在40 ℃水浴条件下提取1 h,采用考马斯亮蓝法测定菘蓝幼苗叶中的蛋白质含量。各处理组进行3次重复测定。
1.2.8靛蓝、靛玉红含量参照《中国药典》的方法[20]提取样品中的靛蓝与靛玉红,采用高效液相色谱法测定其含量。色谱条件:流动相为甲醇∶水=75∶25,流速为1.0 mL/min,检测温度30 ℃,检测波长289 nm。各处理组进行3次重复测定。
1.3 数据分析
采用Excel2003和SPSS 17.0软件对数据进行统计分析,数据间多重比较采用LSD方法。
2结果与分析
2.1 缺氮和复氮对菘蓝幼苗生长的影响
缺氮组和复氮组的菘蓝幼苗长势均优于对照组(表1)。其中,幼苗的株高、主根长、根鲜重、叶鲜重、叶干重均以复氮处理最高,与对照组差异均达到显著水平,尤其是株高、主根长、叶干重、叶鲜重表现最为明显,分别比对照显著提高18.4%、38.9%、106.3%和107.0%,同时显著高于缺氮处理组;幼苗主根直径、根干重均在缺氮处理下数值最大,并分别显著高于对照28.6%和400%,但主根直径与其复氮处理下无显著性差异,而根干重则显著高于复氮处理100%。
另外,3个处理组中,幼苗的根系活力以对照组最低,缺氮组有所增强,而复氮组最高,缺氮和复氮处理分别高于对照组8.97%和15.22%。可见,短暂的氮素丰缺对根系活力存在一定的影响,缺氮能刺激根系去吸收水分和养分,而复氮组由于缺氮处理后又恢复氮素供应,使其根系更为活跃;从而促进根系和地上部分生长和生物量积累,尤其使菘蓝的药用部位叶片的干重和鲜重成倍增加。
2.2 缺氮和复氮对菘蓝幼苗生理指标的影响
2.2.1叶绿素含量缺氮和复氮处理对菘蓝幼苗叶绿素含量无显著性影响(图1)。其中,对照组的叶绿素相对含量最大(43.60),复氮组次之,而缺氮组最小(42.47),后两者分别比对照降低0.34%和2.59%。这说明氮素的盈亏对叶绿素含量虽有直接的影响,但影响的程度较低,其含量变化不大。

表1 缺氮和复氮对菘蓝幼苗各生长指标的影响
注:同行不同小写字母表示处理间差异达到5%显著水平。
Note:Thedifferent normal letters in the same row mean significantdifference among treatments at 0.05 level.
2.2.2NR活性缺氮和复氮处理对菘蓝幼苗硝酸还原酶活性的影响差异显著(图2),各处理组NR活性从高到低依次为缺氮组、对照组、复氮组,缺氮组显著高于对照组和复氮组(P<0.05),复氮组则显著低于对照(P<0.05)。其中,NR的活性在缺氮条件下比对照组高出26.70%,但在复氮条件下则极低,比对照组大幅降低85.37%。可见,菘蓝幼苗在短期缺氮处理之后恢复氮供应会严重影响到NR的活性,而适当的缺氮处理有利于提高NR的活性。
2.2.3GS活性由图2还可知,3个处理下菘蓝幼苗的谷氨酰胺合成酶活性间存在显著性差异,其中GS活性在对照组最高(58.91 U/mg),显著高于缺氮组与复氮组(P<0.05),缺氮和复氮处理后GS活性均有所减弱,在缺氮处理后比对照组下降了19.92%,而在复氮处理下虽然重新提供了氮素营养,但其GS活性不升反降,显著低于对照组29.01%。这说明正常供给氮素能提高菘蓝幼苗GS活性,缺氮处理对于GS活性有抑制作用,复氮后反使GS的活性更低,难以恢复到正常供氮水平时的状态。
2.3 缺氮和复氮对菘蓝幼苗氮类化合物含量影响
2.3.1硝态氮含量图3,A显示,3个处理组菘蓝幼苗叶内硝态氮含量间存在显著差异(P<0.05),在正常供氮情况下(对照)最高(7.49 mg/g),显著高于缺氮组与复氮组(P<0.05),缺氮组则显著低于对照组和复氮组(P<0.05),且比正常供氮处理降低了67.95%,而复氮组也显著低于对照组(P<0.05),比对照降低了36.91%。由此可见,氮素的盈亏会直接影响到植物体内的硝态氮积累,在菘蓝幼苗生长过程中短期缺氮之后继续供氮,其硝态氮含量也难以快速恢复到正常供氮时的水平。
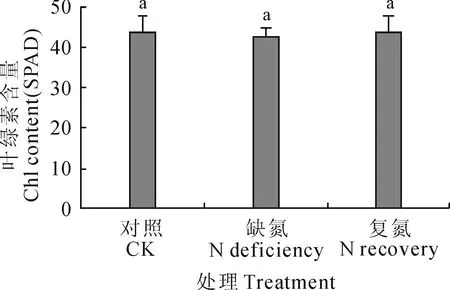
图1 缺氮和复氮处理下菘蓝幼苗叶绿素含量的变化
2.3.2游离氨基酸含量菘蓝幼苗游离氨基酸含量在不同处理下差异较大,且其在根和叶的含量受到的影响程度不同(图3,B)。其中,叶中游离氨基酸含量在3个处理间有差异,缺氮处理组的含量最高(2.60 mg/g),且显著高于对照组与复氮组(P<0.05),分别比对照组和复氮组升高37.57%和34.72%;而对照组与复氮组叶内的含量间无显著性差异(P>0.05)。根中游离氨基酸含量3个处理间存在显著性差异,其中复氮组最高(2.01 mg/g),显著高于对照组与缺氮组(P<0.05),缺氮组最低(1.15 mg/g),显著低于对照组与复氮组(P<0.05),且分别比对照组和复氮组降低了24.84%和42.50%。说明水培条件下缺氮对菘蓝幼苗根中的氮素同化有直接的影响,使游离氨基酸难以在根中积累,却有利于其在叶中积累。另外,对照组叶中游离氨基酸含量略高于根中;复氮组根中游离氨基酸含量略大于叶中,且无论是在根还是叶中,复氮处理后的游离氨基酸含量均高于对照组。这说明经过暂时的缺氮处理后,当氮素供应恢复正常条件后游离氨基酸含量有所升高。
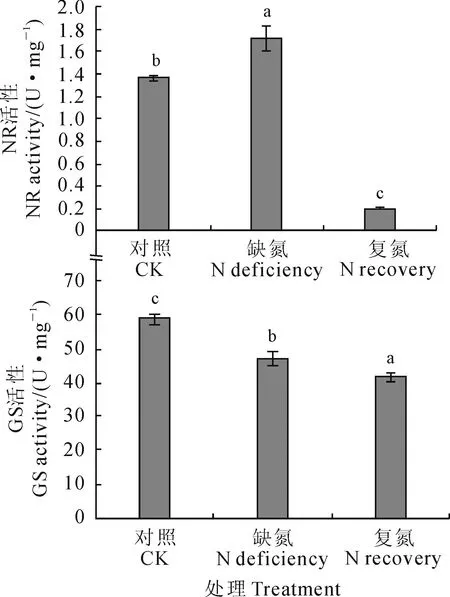
图2 缺氮和复氮处理下菘蓝幼苗叶的GS和NR活性
2.3.3可溶性蛋白含量3个处理组菘蓝幼苗叶中的可溶性蛋白含量差异较小(图3,C),复氮组的可溶性蛋白含量最高,且显著高于缺氮组(P<0.05),与对照组间无显著性差异(P>0.05),但仍高于对照组33.76%;缺氮组含量最低,低于对照组14.30%,这表明缺氮抑制了菘蓝幼苗叶中可溶性蛋白的合成,而复氮处理则能恢复并促进叶中可溶性蛋白的合成。
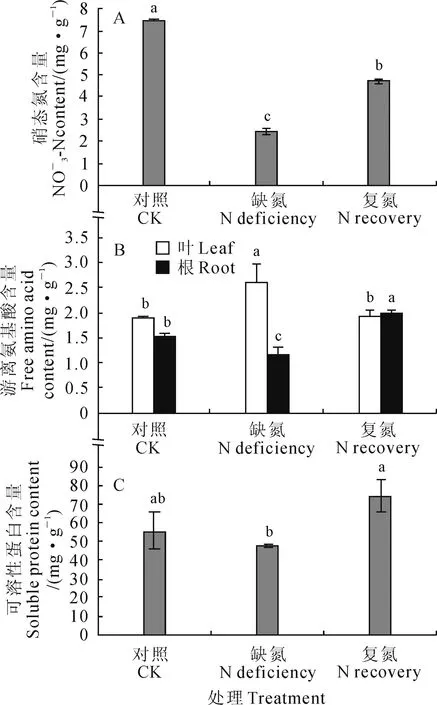
图3 缺氮复氮处理下菘蓝幼苗叶的硝态氮、

图4 缺氮复氮处理下菘蓝幼苗叶的靛蓝与靛玉红含量
2.4 缺氮和复氮对菘蓝幼苗的活性成分含量影响
由图4可知,菘蓝幼苗中靛蓝含量在3个处理间有一定差异,其中复氮处理下最大(2.42 mg/g),显著高于缺氮组与对照组(P<0.05),分别比缺氮组和对照组高出26.04%和27.03%;而缺氮组与对照组间则无显著性差异(P>0.05)。菘蓝幼苗中靛玉红含量在3个处理间有一定差异,其中缺氮组含量最小(1.41 mg/g),显著低于复氮组与对照组(P<0.05),分别比复氮组和对照组降低了24.19%和25.40%。这说明缺氮之后恢复供氮有利于靛蓝的积累,而长时间缺氮处理则不利于靛玉红的积累。另外,缺氮处理和复氮处理下靛蓝的含量均高于靛玉红含量,而在对照组中此二者含量接近,这说明适当缺氮处理有利于叶中靛蓝含量的增加。
3讨论
3.1 菘蓝幼苗生长指标对缺氮和复氮的响应特征
氮素是植物生长的必须营养元素,Zhu等研究发现柳枝稷的6个品种在低氮处理下的生物量、叶面积、根表面积等均显著低于Hoagland营养液处理组,但定植后柳枝稷在缺氮下依然能存活[17]。本研究中缺氮可以使菘蓝幼苗的主根增粗,促进根的干物质积累,这可能是菘蓝幼苗的根系为了适应氮素亏缺的状态,产生了一种寻找氮源的补偿效应,与Zhu的研究结果有类似之处。而复氮能使株高、主根长、根和叶的鲜重、叶干重有所增加,即正常供氮过程中短时间缺氮能使菘蓝幼苗的长势更好。这说明在施用氮肥的过程中,适当缺氮更有利于菘蓝的生长,因此在生产中可以考虑采用缺氮胁迫的方式来获得更高的产量。复氮处理的菘蓝幼苗根鲜重最大,但干重却较小,说明复氮组根系中的水分含量较大,具体原因还有待进一步研究。
根系是植物吸收养分的主要器官,其生长和生理代谢直接影响作物生长发育、营养状况与产品品质的形成。武永军[21]研究表明,玉米经缺氮处理后,其根系活力显著下降,即使是恢复正常供氮后,根系活力仍远低于正常处理。但缺氮对于提高菘蓝幼苗根系活力有一定的积极作用,而复氮后根系活力最高,可能是由于氮素供应不足反而促使主根更发达来提高氮素的吸收能力,复氮组由于正常供氮途中的缺氮使其根系更为发达,当供氮恢复之后其根系吸收能力更强,生理活性更高。
3.2 菘蓝幼苗生理指标对缺氮和复氮的响应特征
氮肥能促进植物的营养生长,与叶片生长关系密切,缺氮胁迫会对叶绿体产生影响,正常供氮能促进菘蓝幼苗叶绿素合成,且其相对含量在复氮处理下比缺氮处理下要高,这与武新红[22]和盛束军[23]的研究结果一致。
在菘蓝的生长过程中,适当增施硝态氮能提高NR活性[24],可见NR和GS作为氮代谢过程的关键酶势必影响着菘蓝幼苗的代谢,缺氮和复氮处理对于GS的活性均有抑制作用,并且缺氮条件下的抑制作用更为明显,这与张智猛等[25]报道的适当提高氮素水平能提高GS活性结论一致。一般认为,缺氮可导致NR的活性下降,如林春华等[26]对芥蓝的研究等。而本研究中菘蓝NR的活性在缺氮处理下比对照有所升高,在复氮处理下则明显降低,这可能是由于缺氮时间较长或者氮素亏缺而刺激植物发生其它的氮代谢途径,从而提高了NR的活性,其具体影响机制还有待进一步研究。
3.3 菘蓝幼苗中氮类化合物含量对缺氮和复氮的响应特征
硝酸盐是植物从土壤中吸收氮素的主要形式,体内硝态氮的含量在一定程度上反映了植物对氮素吸收的情况。在本研究的正常供氮情况下菘蓝幼苗中硝态氮的含量高于缺氮组和复氮组,说明氮肥已被菘蓝有效吸收,但还未被利用。氮素参与植物生理活动必须要先将无机氮同化为氨基酸,故而研究根与叶中游离氨基酸含量对于氮素水平变化的敏感度至关重要。本研究缺氮处理的菘蓝幼苗叶中的游离氨基酸含量显著升高,而其根中游离氨基酸显著降低,可能是由于在缺氮条件下根系吸收的氮素减少而导致根中同化的氨基酸变少,同时根中原有游离氨基酸转移至叶中以帮助地上部分的生长;复氮组叶中游离氨基酸含量只是略高于正常供氮处理,而其根中游离氨基酸含量明显高于对照,说明短期缺氮后继续供氮情况下根系迅速吸收了氮素并同化成了氨基酸。另外,缺氮组菘蓝幼苗的可溶性蛋白含量最低,而复氮组的可溶性蛋白含量更高,说明增施氮肥可提高可溶性蛋白的含量,且缺氮胁迫后复氮更能促进蛋白质的合成,这与武新红[22]的研究结果一致。
3.4 菘蓝幼苗中活性成分含量对缺氮和复氮的响应特征
靛蓝和靛玉红是菘蓝叶内的主要活性成分,也是含氮的次生代谢产物。初级代谢愈旺盛,其初生代谢产物以及与蛋白质、脂肪、核酸代谢相联结的关键中间产物愈充足,次级代谢只有在初级代谢中间产物积累到一定程度并在调节次级代谢的酶促作用下,才会出现高峰[24],使次生代谢产物增加。氮素营养是影响菘蓝体内这两种活性成分合成的重要环境因子。本研究中菘蓝幼苗叶片中靛玉红含量在缺氮组最低,靛蓝含量则在复氮组最高,这说明了氮素供应变化对菘蓝合成这两种成分的影响不同,在生产实践中若要同时获得两种有效成分含量都较高的大青叶药材,需考虑合适的氮素处理方式进行培养。
参考文献:
[1]陆景陵.植物营养学[M].北京:中国农业大学出版社,2002:23-35.
[2]LIUd H(刘大会),GUO L P(郭兰萍),HUANG L Q(黄璐琦),etal.Effect of mineral nutrition on metabolism of flavonoids in medicinal plant[J].ChinaJournalofChineseMateriaMedica(中国中药杂志),2010,35(18):2 367-2 371(in Chinese).
[3]蔡红梅.超量表达谷氨酰胺合成酶、硝酸根转运蛋白和铵离子转运蛋白家族1基因对水稻氮代谢的功能研究[D].武汉:华中农业大学,2009.
[4]ZHANG Y(张燕),WANG J Y(王继永),LIU Y(刘勇),etal.Nitrogen nutrition inGlycyrrhizauralensisFisch[J].JournalofBeijingForestryUniversity(北京林业大学学报),2005,3:57-60(in Chinese).
[5]SU W H(苏文华),ZHANG G F(张光飞),ZHOU H(周鸿),etal.Effects of nitrogen on the growth and accumulation of secondary metabolites ofErigeronbreviscapus(Compositae)[J].ActaBotanicaYunnanica(云南植物研究),2010,1:41-46(in Chinese).
[6]WANG Y(王艳),MI G H(米国华),ZHANG F S(张福锁).Effect on nitrate levels ondynamic changes of root morphology indifferent maize inbred lines[J].ChineseJournalofEco-Agriculture(中国生态农业学报),2003,11(3):69-71(in Chinese).
[7]LI C F(李彩凤),MA F M(马凤呜),ZHAO Y(赵越),etal.Effects of nitrogen forms on key enzyme activities and related products in sugar and nitrogen metabolism of sugar beet(BetavulgarisL.)[J].ActaAgronomicaSinica(作物学报),2003,29(1):128-132(in Chinese).
[8]HUANG Q N(黄勤妮),YIN L P(印莉萍),CHAI X Q(柴晓清),etal.Influence of nitrogen sources on glutamine synthetase in wheat seedling[J].ActaBotanicaSinica(植物学报),1995,37(11):856-862(in Chinese).
[9]BUCHANAN B B,GRUISSEM W,JONES R L.Biochemistry and molecular biology of plants[M].Beijing:Science Press,2002.
[10]TAN Y(谭勇),LIANG Z S(梁宗锁),WANG W L(王渭玲),etal.Effect of nitrogen,phosphorus and potassium on root vigor and free amino acid content ofAstragalusmembranaceusseedlings[J].ActaBot.Boreal.-Occident.Sin.(西北植物学报),2006,26(3):478-483(in Chinese).
[11]ENSLEY Bd,RATZKIN B J,OSSLYUND Td,etal.Expression of naphthalene oxidation genes inEscherichiacoliresult in the biosynthesis of indigo[J].Science,1983,22(2):167.
[12]MAUGARD T,ENAUD E,CHOISY P,etal.Identification of an indigo precursor from leaves of Isatis tinctoria (Woad)[J].Photosynthesis,2001,58(6):897-904.
[13]XIAO Y H(肖云华),ZHAO X L(赵雪玲),WANG K C(王康才),etal.Effect ofdifferent nitrogen forms and concentration on biomass and alkaloids of Isatidis Forlium[J].ChinaJournalofChineseMaeriaandMedica(中国中药杂志),2013,39(17):2 755-2 760(in Chinese).
[14]武新红.矿质元素对菘蓝生长及有效成分积累的影响[D].长沙:湖南农业大学,2008.
[15]DUAN F(段飞),YANG J X(杨建雄),ZHOU X K(周西坤),etal.Effects of stress on the indirubin content ofIsatisindigoticaFort.seedlings[J].AgriculturalResearchintheAridAreas(干旱地区农业研究),2006,24(3):111-114,120(in Chinese).
[16]LONG Y(龙云),YANG R(杨睿),ZHONG ZH CH(钟章成),etal.Effect ofdifferent water and nitrogen on biomass and gypenosides inGynostemmapentaphyllum[J].ChineseTraditionalandHerbalDrugs(中草药),2008,39(12):1 872-1 876(in Chinese).
[17]ZHU Y,FAN X F,HOU X C,etal.Effect ofdifferent levels of nitrogendeficiency on switchgrass seedling growth[J].TheCropJournal,2014,(2):223-234.
[18]张志良,翟伟菁.植物生理学实验指导(第3版)[M].北京:高等教育出版社,2003:23-24.
[19]王学奎.植物生理生化实验原理和技术(第2版)[M].北京:高等教育出版社,2006,215:122-123,200-201.
[20]国家药典委员会.中华人民共和国药典(一部)[M].北京:中国医药科技出版社,2010.
[21]WU Y J(武永军),SHEN Y F(沈玉芳),YAN Q F(颜秦峰),etal.Effect of Ndeficiency and N recovery treatment on root growth,root activity,content of NO3--N and amino acids[J].ActaAgriculturaeBoreali-OccidentalisSinica(西北农业学报),2012,21(12):61-64(in Chinese).
[22]WU X H(武新红),PENG K Q(彭克勤),LIANG Z S(梁宗锁),etal.Effects of nitrogen and phosphorus on root and shoot growth ofIsatisindigoticaFort.[J].ActaAgriculturaeBoreali-occidentalisSinica(西北农业学报),2008,17(4):274-278(in Chinese).
[23]SHENG SH J(盛束军),ZHEN J B(郑俊波),YU X P(俞旭平),etal.Influence to the growth ofLeonurusartemisia(Lour.) S.Y.Hu by various fertilizer level[J].JournalofPlantResourcesandEnvironment(植物资源与环境),1998,7(1):31-34(in Chinese).
[24]YAN F X (晏枫霞),WANG K C(王康才),LUO Q Y(罗庆云),etal.Effects of NH4+-N /NO3--N ratio in applied supplementary fertilizer on nitrogen metabolism,photosynthesis and growth ofIsatisindigotica[J].ChinaJournalofChineseMaeriaandMedica(中国中药杂志),2009,34(166):2 039-2 042(in Chinese).
[25]ZHANG ZH M(张智猛),WAN SH B(万书波),DAI L X(戴良香),etal.Effects of nitrogen application rates on nitrogen metabolism and related enzyme activities of twodifferent peanut cultivars[J].ScientiaAgriculturaSinica(中国农业科学),2011,42(2):280-290(in Chinese).
[26]LIN CH H(林春华),HUANG L H(黄亮华).Effect of N,P,K,Ca and Mgdeficiency on nitrate accumulation,nitrate reductase and peroxidase activity in Chinese kale[J].SouthChinaAgric.Univ.(华南农业大学学报),1994,19(4):55-58(in Chinese).
(编辑:裴阿卫)

