miRNA-25对人食管鳞状细胞癌细胞株TE1增殖的影响
miRNA-25对人食管鳞状细胞癌细胞株TE1增殖的影响
张伟1,2△,周勇慧3,庞一强4
(内蒙古科技大学包头医学院1病理教研室,2第一附属医院病理科,3第一附属医院普外科二病区, 内蒙古 包头 014010;4包头市第四医院神经外科, 内蒙古 包头 014030)
[摘要]目的: 探讨过表达/沉默微小RNA-25(microRNA-25,miRNA-25)对人食管鳞状细胞癌细胞株TE1增殖能力的影响及其作用机制。方法: RT-PCR检测各临床样品组织中miRNA-25的表达水平。建立miRNA-25过表达/沉默的TE1细胞株,采用CCK-8法、BrdU实验和流式细胞术检测TE1细胞增殖能力的变化及细胞周期状态;Western blot法和RT-PCR法检测细胞周期调控因子细胞周期蛋白E1(cyclin E1)和细胞周期蛋白依赖性激酶2(CDK2)的蛋白与mRNA表达水平。结果: miRNA-25在食管黏膜组织中具有特异性表达并在TE1细胞中呈高表达。CCK-8法和BrdU实验结果显示过表达miRNA-25的TE1细胞的增殖能力显著增加(P<0.05),而沉默miRNA-25抑制TE1细胞的增殖;流式细胞术检测结果显示过表达miRNA-25可明显促进TE1细胞从G0/G1期向S期转换,沉默miRNA-25则抑制其转换。同时Western blot和RT-PCR实验结果显示过表达miRNA-25后,cyclin E1和CDK2的蛋白和mRNA表达水平均显著增加(P<0.05),沉默miRNA-25后则显著减少(P<0.05)。结论: miRNA-25能够促进人食管鳞状细胞癌细胞株TE1的增殖,其作用机制可能与促进细胞周期转换及上调cyclin E1和CDK2的表达水平有关,提示miRNA-25可作为治疗食管鳞状细胞癌的一个潜在靶点。
[关键词]微小RNA-25; 人食管鳞状细胞癌细胞株TE1; 细胞增殖; 细胞周期蛋白E1; 细胞周期蛋白依赖性激酶2
[中图分类号]R363.1+4[文献标志码]A
doi:10.3969/j.issn.1000-4718.2015.11.009
Effects of miRNA-25 on proliferation of human esophageal squamous-cell carcinoma cell line TE1ZHANG Wei1,2, ZHOU Yong-hui3, PANG Yi-qiang4
(1DepartmentofPathophysiology,2DepartmentofPathology,FirstAffiliatedHospital,3WardIIofGeneralSurgeryDepartment,FirstAffiliatedHospital,BaotouMedicalCollege,InnerMongoliaUniversityofTechnology,Baotou014010,China;4DepartmentofNeurosurgery,FourthHospitalofBaotou,Baotou014030,China.E-mail:xbkld@163.com)
ABSTRACT[]AIM: To investigate the effects and mechanisms of microRNA-25 (miRNA-25) on the proliferation of human esophageal squamous-cell carcinoma cell line TE1. METHODS: The abundance of miRNA-25 in different tissues was measured by RT-PCR. After silencing or over-expression of miRNA-25 with mimics or inhibitor in TE1 cells, the cell proliferation, cell cycle distribution and the expression of cyclin E1 and cyclin-dependent kinase 2 (CDK2) at mRNA and protein levels were measured by CCK-8 assay, BrdU detection, flow cytometry, RT-PCR and Western blot, respectively. RESULTS: miRNA-25 was prominent in esophageal mucosal tissue and highly expressed in TE1 cells (P<0.05). Over-expression of miRNA-25 increased TE1 cell proliferation, promoted the cell cycle progression and enhanced the entrance of the cells into S phase (P<0.05). Inverse results were obtained after down-regulation of miRNA-25 (P<0.05). Furthermore, the expression of cyclin E1 and CDK2 at mRNA and protein levels was significantly increased after over-expression of miRNA-25, but decreased after down-regulation of miRNA-25 (P<0.05). CONCLUSION: miRNA-25 enhances cell cycle transition by increasing the expression of cyclin E1 and CDK2, thus accelerating TE1 cell proliferation. This study provides a novel mechanism by which miRNA-25 increases the proliferation of human esophageal squamous-cell carcinoma cell line TE1, suggesting that down-regulation of miRNA-25 may be a potential new therapeutic strategy for treating esophageal squamous-cell carcinoma.
[KEY WORDS]MicroRNA-25; Human esophageal squamous-cell carcinoma cell line TE1; Cell proliferation; Cyclin E1; Cyclin-dependent kinase 2
依据全球恶性肿瘤统计资料显示,食管癌的5年生存率小于15%[1],死亡率排名第4位,是常见的十大恶性肿瘤之一[2]。其发病率具有显著的人群种族差异。食管癌主要分为食管腺癌(esophageal adenocarcinoma,EA)和食管鳞状细胞癌(esophageal squamous-cell carcinoma,ESCC),其中鳞状细胞癌占食管癌的90%以上。食管鳞状细胞癌的发生尚无确定病因,可能由多种因素综合作用,主要有吸烟、酗酒、空气污染、病毒感染等,且发病率呈现逐年增加的趋势。目前的治疗手段主要有手术、放射治疗、化学治疗以及手术与放射治疗结合[3]。
目前已发现约有一万多种miRNAs,广泛存在于动物、植物及病毒等不同的细胞和组织中,表达形式各异[4]。近年研究发现microRNA(miRNA)可能作为一种潜在的肿瘤早期诊断指标以及潜在治疗靶点。miRNA-25在多种肿瘤组织中存在异常表达。miRNA-25属于miRNA-106b-25簇,有研究表明该家族成员在人类脑内呈高表达状态,并在癌症的发生发展中起重要作用[5]。本研究建立了过表达/沉默miRNA-25的人食管鳞状细胞癌细胞株TE1,通过CCK-8法、流式细胞术方法检查癌细胞周期变化,以及Western blot和RT-PCR检测TE1细胞的周期调控因子细胞周期蛋白E1(cyclin E1)及细胞周期蛋白依赖性激酶2(cyclin-dependent kinase 2, CDK2)的蛋白与mRNA表达的变化,探讨miRNA-25表达的变化对食管鳞状细胞癌发生发展的潜在影响。
材料和方法
1材料与试剂
胎牛血清、RPMI-1640培养基和Opti-NEM培养基购于Gibco;LipofectamineTMRNAiMAX购于Invitrogen;人食管鳞状细胞癌细胞株TE1购于中国科学院上海细胞库;cyclin E1和CDK2抗体购于Santa Cruz;BrdU细胞增殖分析试剂盒购于Chemicon;miRNA-25-mimic/inhibitor由上海吉玛制药技术有限公司合成;其余试剂均为国产分析纯。
2样本收集
收集内蒙古科技大学包头医学院第一附属医院2012年8月~2014年2月食管鳞状细胞癌患者的肿瘤组织及癌旁组织样本49例,另取正常食管黏膜组织46例、正常鼻咽黏膜组织40例、正常胃黏膜组织38例、正常肠黏膜组织37例和正常卵巢组织29例,样本年龄均大于18岁。所有组织样本存放于-80 ℃液氮中保存。所有活体组织经内蒙古科技大学包头医学院第一附属医院病理专家诊断证实,临床标本的获取经伦理委员会同意,患者签署知情同意书。
3实验方法
3.1细胞培养、转染和分组将TE1细胞置于含10%胎牛血清的RPMI-1640培养基中,在37 ℃、5% CO2恒温培养箱中培养,每隔1~2 d换液1次。细胞消化并种植于24孔培养板中,待细胞融合至40%~50%左右,将处于对数生长期的细胞置于无血清的培养基中,37 ℃、5% CO2恒温培养箱中培养24 h,随后进行下一步处理,组别分为空白对照(control,Con)组;阴性对照组(negative control-mimics,NC-m或negative control-inhibitor,NC-i);转染组(miRNA25-mimics,25-m或miRNA-25-inhibitor,25-i) 。将以上miRNA分别溶解于Opti-MEM培养基中,加入LipofectamineTMRNAiMAX,轻柔混合,室温静置20~30 min,形成复合体。将复合体加入细胞培养板中,室温孵育4 h,转换为正常细胞培养基培养48 h。
3.2CCK-8法和BrdU法测定细胞增殖水平将各组的TE1细胞以每孔2×103个细胞,加入96孔培养板中,每孔加入Opti-MEM培养基100 μL,继续培养,分别在24 h、48 h、72 h和96 h加入10 μL CCK-8溶液,置于37 ℃、5% CO2培养箱中孵育1 h。选择450 nm波长,用酶联免疫检测仪测定各孔吸光度值(A)。另设单孔只加入培养基不加入TE1细胞作为空白对照。
将细胞以每孔1 000个接种至96孔板中,培养24 h后加入BrdU,培养24 h,加入100 μL固定液,放置30 min,洗板3次,5% 胎牛血清封闭30 min。加入甲酰胺100 ℃变性5 min,洗涤,加入抗小鼠BrdU单抗,苏木素衬染,显微镜下计数。
3.3流式细胞术检测细胞周期将对数期的TE1细胞培养于Opti-MEM培养基24 h,消化处理后,800 r/min离心5 min,用PBS漂洗2次,再次800 r/min离心5 min,PBS重悬,加入70%预冷无水乙醇,4 ℃避光过夜。900 r/min离心8 min,PBS洗去乙醇,加入碘化丙啶,避光孵育30 min,记录流式细胞仪于激发波长488 nm处的荧光强度,重复3次。
3.4TE1细胞中cyclin E1和CDK2的蛋白表达水平测定提取TE1细胞蛋白定量,调整蛋白量。取等量裂解产物,加入4倍体积上样缓冲液进行SDS-PAGE电泳。电泳后转移至PVDF膜上,脱脂牛奶室温封闭2 h,加入 I 抗4 ℃孵育4 h,TBST洗涤3次,每次10 min;再加入相对应 II 抗室温孵育1 h,TBST洗涤3次,每次10 min,暗室中进行荧光显色。
3.5RT-PCR检测取适量食管癌组织、癌旁组织、正常食管黏膜组织、正常鼻咽黏膜组织、正常胃黏膜组织、正常肠黏膜组织、正常卵巢组织和经过相应处理的TE1细胞,按照TRIzol说明书提取总RNA,测定RNA样品的A280值并定量。以逆转录酶催化合成cDNA,并在聚合酶催化下进行PCR扩增。扩增条件为:95 ℃ 30 s,60 ℃ 30 s,72 ℃ 30 s,共30个循环;72 ℃ 10 min。扩增样品在2.0%琼脂糖凝胶中电泳,以β-actin为内参照,于凝胶成像系统观察目的基因条带并进行定量分析。采用Genetool软件设计的相应引物序列见表1。

表1 RT-PCR的引物序列
F: forward; R: reverse.
4统计学处理
应用SPSS 13.0统计软件进行统计分析。实验结果以均数±标准差(mean±SD)表示,多组数据采用单因素方差分析(one-way ANOVA),并用Bonferroni法进行组间均数的两两比较,以P<0.05为差异有统计学意义。
结果
1miRNA-25在不同组织中的表达水平
RT-PCR的结果显示,miRNA-25在正常食管黏膜组织中呈高表达;在正常胃黏膜组织和卵巢组织中低表达;在正常鼻咽黏膜组织和正常肠黏膜组织中几乎不表达,见图1。同时,与正常食管黏膜以及癌旁组织相比,miRNA-25在食管癌组织中表达明显增加,见图2。以上结果提示,miRNA-25的高表达与食管癌的发生发展有密切关系。
2RT-PCR法检测miRNA-25-mimic/inhibitor在TE1细胞中的表达效率
通过脂质体转染miRNA25-mimic/inhibitor至TE1细胞,采用RT-PCR检测miRNA-25表达水平的变化,结果显示转染了miRNA25-mimic后,TE1细胞的miRNA-25水平显著升高;而转染了miRNA-25 inhibitor后,TE1细胞的miRNA-25水平则显著降低,与空白对照组相比均有显著差异(P<0.05),见图3。
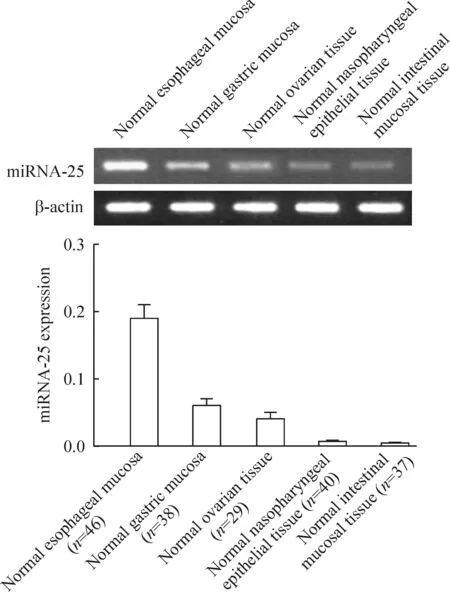
Figure 1.The expression of miRNA-25 in different normal tissues. Mean±SD.
图1食管、胃、卵巢、鼻和肠道正常粘膜组织中miRNA-25的表达水平

Figure 2.The expression levels of miRNA-25 in normal, paracancerous and cancerous esophageal tissues. Mean±SD.*P<0.05vsnormal esophageal mucosa.
图2正常食管黏膜组织、癌旁组织和食管癌组织中miRNA-25的表达水平
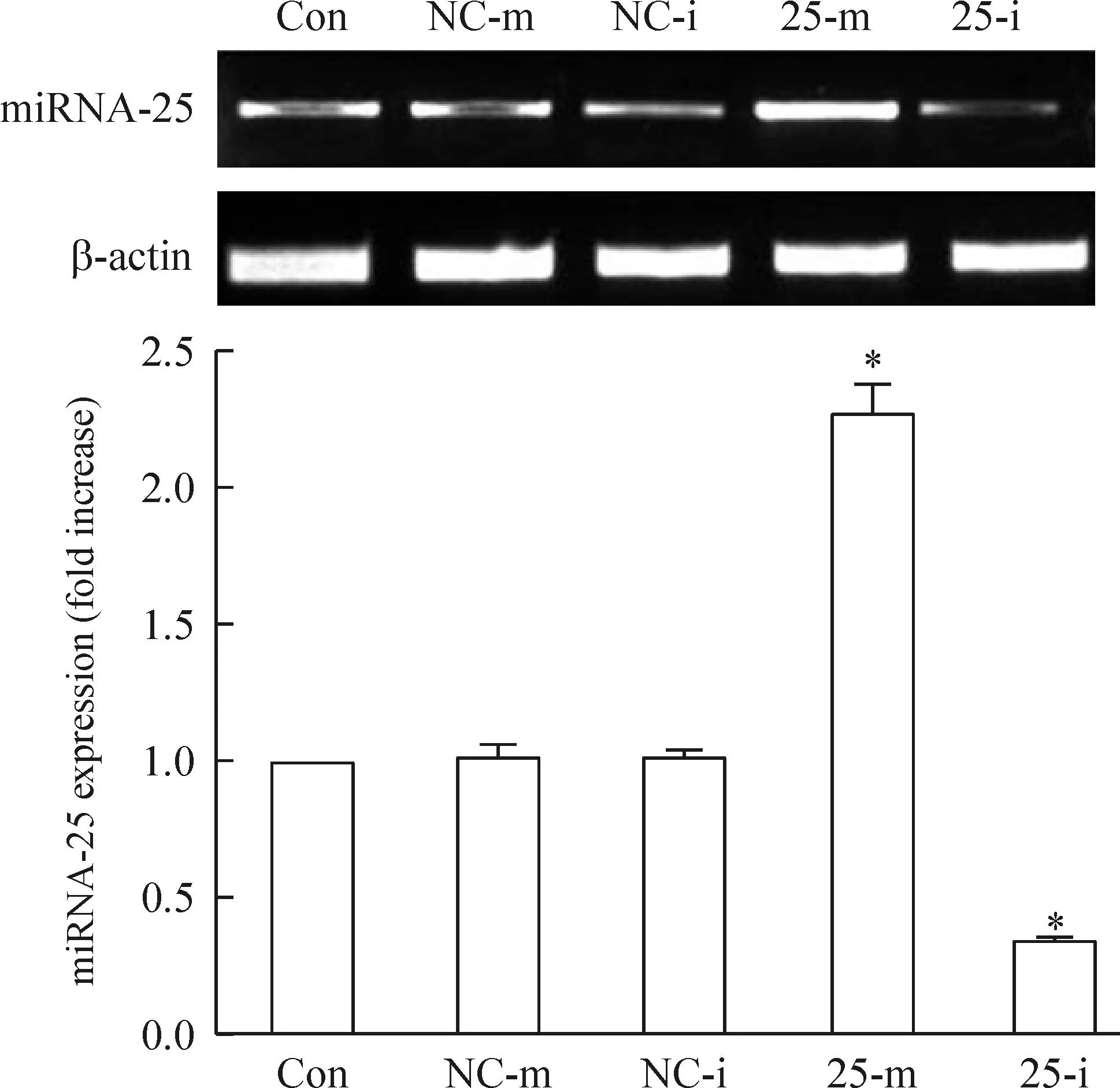
Figure 3.The expression levels of miRNA-25 in the TE1 cell after over-expression/down-regulation of miRNA-25. Mean±SD.n=6.*P<0.05vsCon.
图3TE1细胞转染后miRNA-25的表达水平
3CCK-8法和BrdU实验测定TE1细胞的增殖水平
采用CCK-8法,在miRNA-25-mimic/inhibitor转染TE1细胞后,分别于24 h、48 h、72 h和96 h时检测细胞活力,结果发现过表达miRNA-25后,TE1的细胞活力显著高于空白对照组(P<0.05),而沉默miRNA-25后,TE1的细胞活力显著低于空白对照组(P<0.05);而NC-m、NC-i与空白对照组间的差异不显著,见表2。
BrdU实验结果表明,过表达miRNA-25后,DNA合成显著高于空白对照组;而沉默miRNA-25后,结果相反;而NC-m、NC-i与空白对照组间的差异不显著,见图4。
4流式细胞术检测细胞周期
应用流式细胞术分析过表达/沉默miRNA-25后TE1细胞周期的变化。结果显示,过表达miRNA-25后,G0/G1期的细胞数占百分比为减少至(46.52±5.08)%,S期细胞数所占百分比增加至(43.96±4.67)%,而沉默miRNA-25后,G0/G1期的细胞数占百分比为增加至(84.52±4.78)%,S期细胞数所占百分比减少至(6.05±2.64)%,说明过表达miRNA-25促进TE1细胞周期从G0/G1期向S期转换,而沉默miRNA-25则抑制其转换,见图5。
5Cyclin E1和CDK2的蛋白表达水平
收集成功转染miRNA-25-mimic/inhibitor的TE1细胞,提取蛋白,通过Western blot检测TE1细胞中cyclin E1 和CDK2的蛋白表达水平。结果显示,相对于未转染的TE1细胞,过表达miRNA-25后cyclin E1和CDK2的蛋白表达水平显著增加(P<0.05),而沉默miRNA-25后,则显著降低二者的蛋白表达水平(P<0.05),见图6。
表2miRNA-25对TE1细胞活力的影响
Table 2.The effect of miRNA-25 on the viabiliy of the TE1 cells transfected with miRNA-25-mimic/inhibitor determined by CCK-8 assay (%. Mean±SD.n=6)

Group0h24h48h72h96hCon08.51±0.7352.69±5.4192.64±8.99111.64±10.24NC-m09.61±0.6456.84±6.92100.42±8.59126.97±11.42NC-i09.42±0.7354.31±5.6796.47±7.63118.34±10.3425-m034.93±2.98*100.48±8.97*189.72±12.34*243.53±15.64*25-i03.46±0.31*19.47±0.97*46.51±3.14*64.25±5.43*
*P<0.05vsCon.

Figure 4.The quantitative analysis of DNA synthesis in the TE1 cells transfected with miRNA-25-mimic/inhibitor determined by BrdU assay. Mean±SD.n=6.*P<0.05vsCon.
图4各组TE1细胞的DNA合成量比较
6Cyclin E1和CDK2的mRNA表达水平
采用RT-PCR测定TE1细胞转染miRNA25-mimic/inhibitor后,cyclin E1和CDK2的mRNA表达水平。结果显示,过表达miRNA-25后,cyclin E1和CDK2的mRNA表达水平显著增加,而沉默miRNA-25后,两者的表达降低,两者与空白对照组相比均具有显著差异(P<0.05),见图7。
讨论
食管癌是一种人类常见的消化道恶性肿瘤,在我国,食管癌主要表现为食管鳞状细胞癌。以太行山周边的河北、河南,以及广东的部分地区为高发地区[6]。本实验通过对食管鳞状细胞癌患者的临床样本进行分析,发现癌变组织中miRNA-25的表达水平显著高于癌旁组织和正常食管黏膜组织,表明miRNA-25在食管鳞状细胞癌中呈高表达。再者,通过对临床收集的正常食管黏膜组织、正常鼻咽黏膜组织、正常胃黏膜组织、正常肠黏膜组织、正常卵巢组织样本检测发现,正常食管黏膜组织中的miRNA-25的表达高于实验中的其他组织,正常鼻炎黏膜组织和正常肠黏膜组织中几乎不表达,提示miRNA-25在食管组织中具有特异性的表达,可作为治疗食管鳞状细胞癌的一个潜在靶点。
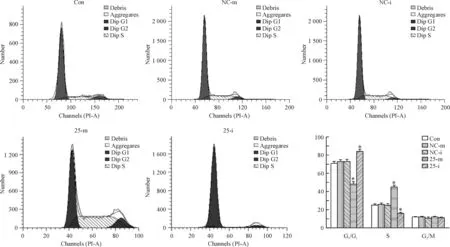
Figure 5.The cell cycle of the TE1 cells transfected with miRNA-25-mimic/inhibitor analyzed by flow cytometry. Mean±SD.n=6.*P<0.05vsCon.
图5TE1细胞的细胞周期变化

Figure 6.The protein expression of cyclin E1 and CDK2 in the TE1 cells transfected with miRNA-25-mimic/inhibitor. Mean±SD.n=6.*P<0.05vsCon.
图6Cyclin E1和CDK2的蛋白表达水平
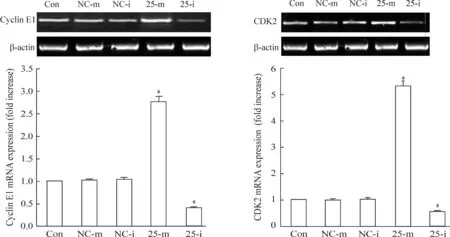
Figure 7.The mRNA expression of cyclin E1 and CDK2 in the TE1 cells transfected with miRNA-25-mimic/inhibitor. Mean±SD.n=6.*P<0.05vsCon.
图7Cyclin E1和CDK2的mRNA表达水平
miRNA是一类内源性非编码单链小分子RNA,通过与特定的mRNA分子的3’非翻译区(3’UTR)相作用,从而调节相应蛋白翻译的过程来调控基因表达。在不同的组织器官中,miRNAs的表达具有明显差异,提示miRNA可能参与调控基因的转录及表达[7-8]。本实验建立过表达/沉默miRNA-25的人食管鳞状细胞细胞株TE1,采用CCK-8法和BrdU实验检测转染miRNA-25-mimics/inhibitor后TE1细胞的增殖情况,随着时间的延长,发现过表达miRNA-25的TE1细胞增殖率随时间增加而明显增加,显著高于空白对照组,沉默miRNA-25的TE1细胞增殖率虽然随时间增加而增加,但显著低于空白对照组,表明过表达miRNA-25使得TE1细胞的增殖加快,可能与食管鳞状细胞癌的发展有一定的相关性。
细胞增殖周期由cyclin、CDK和CDK抑制因子(CDK inhibitor,CKI)共同调节。细胞的分裂与分化主要发生在G1期,cyclin E1在细胞分裂G1期转换至S期的过程中作为调控因子[9],当细胞受到生长信号刺激时,产生视网膜母细胞瘤基因蛋白(pRb)磷酸化,释放出核转录因子E2F,促使细胞完成DNA复制[10],从而促进细胞增殖[11]。而在国内外多项临床试验中也发现在多种肿瘤中长检测到cyclin E1蛋白过表达以及基因扩增[12-13]。李丽等[14]研究在食管上皮癌变过程中细胞周期调控因子的表达时,发现cyclin E1和CDK2的蛋白和mRNA阳性表达率逐渐上升。本实验采用免疫印迹法和RT-PCR检测转染miRNA-25-mimics/inhibitor TE1细胞后,细胞周期调控因子cyclin E1和CDK2的蛋白和mRNA表达水平,并采用流式细胞术检测转染后TE1细胞的细胞周期,结果显示,过表达miRNA-25后,TE1细胞中cyclin E1和CDK2的蛋白和mRNA表达水平均显著增加,G0/G1期细胞数所占百分比明显减少,S期细胞数所占百分比明显增加,提示过表达miRNA-25可加快TE1细胞的增殖;而沉默miRNA-25后,TE1细胞中cyclin E1和CDK2的蛋白和mRNA表达水平均显著降低;G0/G1期细胞数所占百分比明显增加,S期细胞数所占百分比明显减少,提示沉默miRNA-25可减缓TE1细胞的增殖。TE1细胞增殖的加速,可引起食管鳞状细胞癌的迅速恶化,扩散和转移,提示miRNA-25的高表达可能与食管鳞状细胞癌的发生有关,可能促进肿瘤细胞的过度增殖,最终产生恶化迁移。但其确切机制还需进一步深入的研究。
[参考文献]
[1]赫捷,邵康. 中国食管癌流行病学现状、诊疗现状及未来对策[J]. 中国癌症杂志, 2011, 21(7):501-504.
[2]Wani S, Sharma P. Challenges with endoscopic therapy for Barrett’s esophagus [J]. Gastroenterol Clin North Am, 2015, 44(2):355-372.
[3]郑娇娇,吴清明,陈建华,等. P162对食管癌细胞株Eca109的放射增敏作用及其对p75NTR表达的影响[J]. 中国病理生理杂志,2013, 29(1):103-107.
[4]Fitzpatrick JM, Anderson RC, McDermott KW. MicroRNA: key regulators of oligodendrocyte development and pathobiology[J]. Int J Biochem Cell Biol, 2015, 65: 134-138.
[5]Ventura A, Young AG, Winslow MM, et al. Targeted deletion reveals essential and overlapping functions of the miR-17~92 family of miRNA clusters[J]. Cell, 2008, 132(5):875-886.
[6]Jemal A, Bray F, Center MM, et al. Global cancer statistics[J]. CA Cancer J Clin, 2011, 61(2):69-90.
[7]Chen S, Zhang Y, Kuzel TM, et al. Regulating tumor myeloid-derived suppressor cells by microRNAs[J]. Cancer Cell Microenviron, 2015, 2: e637.
[8]Rigoutsos I. New tricks for animal microRNAs: targeting of amino acid coding regions at conserved and nonconser-ved sites[J].Cancer Res, 2009, 69(8):3245-3248.
[9]张彩苹,杜永成,许建英,等.细胞周期蛋白E在哮喘大鼠肺组织中的表达及其与气道重塑的关系[J].中国病理生理杂志,2010, 26(5):853-837.
[10]Rosenberg E, Demopoulos RI, Zeleniuch-Jacquotte A, et al. Expression of cell cycle regulators p57KIP2, cyclin D1, and cyclin E in epithelial ovarian tumors and survival[J]. Hum Pathol, 2001,32(8):808-813.
[11]Martinsson HS, Starborg M, Erlandsson F, et al. Single cell analysis of G1check points: the relationship between the restriction point and phosphorylation of pRb[J]. Exp Cell Res, 2005, 305(2):383-391.
[12]Zhao LW, Zhong XH, Yang SY, et al. Inotodiol inhibits proliferation and induces apoptosis through modulating expression of cyclinE, p27, bcl-2, and bax in human cervical cancer HeLa cells[J]. Asian Pac J Cancer Prev,2014, 15(7):3195-3199.
[13]Dai L, Liu Y, Liu J, et al. A novel cyclinE/cyclinA-CDK inhibitor targets p27Kip1degradation, cell cycle progression and cell survival: implications in cancer therapy[J]. Cancer Lett, 2013, 333(1):103-112.
[14]李丽,齐凤英,左连富,等. Cyclin E、CDK2和p21WAF1在食管上皮癌变过程中的表达及意义[J].肿瘤,2005, 25(2):158-162.
(责任编辑:卢萍, 罗森)


