兔胰腺不可逆电穿孔消融
·短篇论著·
兔胰腺不可逆电穿孔消融
曾健滢牛立志梁冰周亮方刚周序珑汪媛姚飞李家亮刘建国徐克成
近年来,微创消融外科的兴起为胰腺癌患者的治疗开辟了新的方向,如射频消融、微波消融与冷冻消融都分别成为不能手术切除胰腺癌患者的治疗选择之一。目前,一种新兴的肿瘤消融技术——不可逆电穿孔(irreversible electroporation,IRE)消融崭露头角,并开始运用于治疗肝癌[1-2]、肺癌[3-4]与肾癌[5-6]。由于该技术不受热降效应的影响,可有效消融大血管周边组织,并限制细胞外基质损伤和保护大血管及胆管架构,对治疗邻近门静脉、深静脉以及胆总管等重要管腔的胰腺癌可能是一种有重要意义的选择。本研究利用最新引进的美国纳米刀设备对兔胰腺进行纳米刀消融,探讨纳米刀对胰腺肿瘤消融的安全性及有效性,为后续深入研究提供参考依据。
一、材料与方法
1.实验动物:普通级新西兰白兔3只,购自暨南大学实验动物管理中心,雄性,体质量(2.3±0.1)kg。动物生产许可证号为SCXK(粤)2009-0023。动物合格证号 [粤监证字44007600000827]。
2.不可逆电消融术:不可逆电穿孔消融系统包括主机及单电极活化探针(电极长度15 cm、有效距离0~4 cm),均购自美国AngioDynamics公司。
动物禁食24 h,禁水12 h。术前在实验兔腿部肌内注射0.1 mg长托宁,并以44 mg/kg体质量的盐酸氯胺酮注射液(福建古田药业有限公司)诱导麻醉。仰卧位固定家兔,切开气管,置入2.5号气管导管,肌内注射维库溴铵0.1 mg/kg体质量(浙江仙琚药业)。选用婴儿型呼吸囊控制呼吸,控制潮气量为50 ml,呼吸频率为30~50次/min、呼吸比为1∶1和氧分压为100%。皮肤消毒,沿腹中线开口,暴露胰腺。取单电极活化探针(+)和探针(-)各一支,使用拇指推片调整移动绝缘套,露出使用电极长度为1.0 cm。设定电压为1 500 V,脉冲长度为70 μs。用针固定板固定电极探针间距为1 cm。使电极探针紧贴胰腺组织后电击约1 min,结束后于胰腺消融区正上方肠管置一缝线作为标记,将脏器回纳腹腔,常规关腹。手术结束后,从首次注射维库溴铵起每隔30 min给予阿托品及新斯的明各0.1 mg,术后持续供氧并维持呼吸,直至兔恢复自主呼吸后拔除气管导管。待兔苏醒后送恒温机械通风动物房单笼饲养,禁水、禁食12 h。
3.观察指标:术前及术后第2、4、6天采抗凝血2 ml,离心

DOI:10.3760/cma.j.issn.1674-1935.2015.02.016
作者单位:510665广州,暨南大学医学院附属复大肿瘤医院
通信作者:牛立志,Email:kzgdo-01@163.com
分离血浆,自动生化仪检测血淀粉酶活性。
术中观察不可逆电穿孔消融时胰腺表面形态变化,用游标卡尺测量并记录组织表面消融区域最大半径。术后第7天对兔实行安乐死,观察胰腺消融区域及周边脏器形态变化。
取胰腺及十二指肠段组织,甲醛液固定,常规石蜡包埋、切片、HE染色,封片后镜下观察。
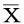
二、结果
1.一般情况:实验兔术后1~2 d内精神萎靡,食欲废绝,饮水减少,急剧消瘦,体质量平均减轻0.3 kg,2~3 d后开始恢复进食,5 d后精神明显好转。
2.胰腺消融区的变化:不可逆电消融术中及术后即刻未见胰腺消融区有显著外观改变,外周组织形态及颜色无异常(图1A)。7d后,肉眼可见胰腺充血水肿,消融灶平均大小为(1.0±0.2)cm×(0.5±0.1)cm,消融灶内见淡黄色酪样病变(33.3%,图1B),消融灶周边胰腺组织颜色变深,呈暗红色。消融区与肝叶轻度粘连(100%),少量腹腔积液(33.3%),大网膜与胃壁轻度粘连(33.3%),肝叶与十二指肠轻度粘连(33.3%),相邻肠管小片段发白(33.3%)。

图1 不可逆电消融术即刻(1A)及术后7d(1B)胰腺消融区的形态变化
3.血淀粉酶活性变化:术前及术后2、4、6 d实验兔血淀粉酶活性分别为(199.7±23.4)、(542.0±151.2)、(281.7±69.5)、(211.7±32.8)U/L,术后2 d较术前有所升高,但差异无统计学意义(P=0.07)。
4. 胰腺及十二指肠病理改变:镜下见消融灶区胰腺腺泡细胞大范围凋亡和坏死(图2A),大量核碎裂(凋亡小体)形成核尘(图2B),部分腺泡细胞轮廓尚可辨,间质充血出血,轻度水肿,少量炎细胞(淋巴细胞、巨噬细胞和中心粒细胞等)浸润,炎性肉芽组织增生。外围胰腺小导管显著增生,呈簇状(图2C)。十二指肠形态结构正常,损伤轻微,部分表层上皮细胞脱落(图2D),未见坏死,其中1只兔见炎性肉芽组织大量增生。

图2 胰腺及十二指肠病理改变(2A ×40,2B、2C、2D ×400)
讨论不可逆电穿孔是2012年4月美国FDA批准应用于临床的一项肿瘤消融新技术。该技术利用微创电极针传递毫秒级电脉冲,形成外来电场改变细胞膜磷脂双分子层的跨膜电位,使细胞膜进行重排,细胞表面出现很多纳米级孔隙,导致细胞膜渗透压升高。当脉冲能超过某个电场阙值时,造成不可逆的细胞损伤,引起细胞凋亡并最终导致细胞死亡[7-8]。
该技术具有以下几个特点: (1)无须热能,不受“热降效应”的影响[9];(2)消融区和非消融区之间可产生明显的边界,极大地减少对正常组织的损伤,减少并发症的发生[9-10];(3)消融时间短,可在微秒到毫秒治疗时间内有效导致细胞凋亡;(4)不损伤胆囊、胆管和大血管的基本结构[10];(5)通过诱导细胞凋亡而引发肿瘤组织坏死[11-12];(6)对神经和大血管有保护作用[13-15]。因此,可预期该技术在胰腺癌治疗领域将有着非常广阔的应用前景。
为寻求更理想的胰腺癌治疗方法,本研究采用该技术对兔胰腺进行不可逆电穿孔消融。结果显示,术后2 d血清淀粉酶活性呈一过性升高,但术前的差异无统计学意义,且在术后6 d随即降至术前水平。术后7 d消融区的细胞大范围凋亡和坏死,周边胰腺组织及十二指肠无明显损伤,仅见消融区与周边脏器有轻度粘连,未发现重度胰腺炎或胰瘘等并发症发生,提示纳米刀技术可有效消融胰腺实质,且安全性较好。
由于纳米刀设备特别是一次性耗材电极活化探针的价格较高,故本研究采用的实验动物数量较少。另外,没有对多种不同强度电压、针尖距等消融参数进行研究,有待进一步深入探讨。
参考文献
[1]Ball C, Thomson KR, Kavnoudias H. Irreversible electroporation: a new challenge in "out of operating theater" anesthesia[J]. Anesth Analg, 2010, 110(5):1305-1309.
[2]Kasivisvanathan V, Thapar A, Oskrochi Y, et al. Irreversible electroporation for focal ablation at the porta hepatis[J]. Cardiovasc Intervent Radiol, 2012, 35(6):1531-1534.
[3]Thomson KR, Cheung W, Ellis SJ, et al. Investigation of the safety of irreversible electroporation in humans[J]. J Vasc Interv Radiol, 2011, 22(5):611-621.
[4]Fanta J, Horak P, Marvan J, et al. The NanoKnife and two successful cases of intracavitary irreversible electroporation of main bronchus tumours[J]. Rozhl Chir, 2012, 91(11):625-630.
[5]Pech M, Janitzky A, Wendler JJ, et al. Irreversible electroporation of renal cell carcinoma: a first-in-man phase I clinical study[J]. Cardiovasc Intervent Radiol, 2011, 34(1):132-138.
[6]Wendler JJ, Pech M, Porsch M, et al. Urinary tract effects after multifocal nonthermal irreversible electroporation of the kidney: acute and chronic monitoring by magnetic resonance imaging, intravenous urography and urinary cytology[J]. Cardiovasc Intervent Radiol, 2012, 35(4):921-926.
[7]Neal RE 2nd, Garcia PA, Robertson JL, et al. Experimental characterization of intrapulse tissue conductivity changes for electroporation[J]. Conf Proc IEEE Eng Med Biol Soc, 2011, 2011:5581-5584.
[8]Long G, Bakos G, Shires PK, et al. Histological and finite element analysis of cell death due to irreversible electroporation[J]. Technol Cancer Res Treat, 2013,13(6):561-569.
[9]Rubinsky B, Onik G, Mikus P. Irreversible electroporation: a new ablation modality-clinical implications[J]. Technol Cancer Res Treat, 2007, 6(1):37-48.
[10]Au JT, Kingham TP, Jun K, et al. Irreversible electroporation ablation of the liver can be detected with ultrasound B-mode and elastography[J]. Surgery, 2013, 153(6):787-793.
[11]Xiao D, Yao C, Liu H, et al. Irreversible electroporation and apoptosis in human liver cancer cells induced by nanosecond electric pulses[J]. Bioelectromagnetics, 2013, 34(7):512-520.
[12]Schmidt CR, Shires P, Mootoo M. Real-time ultrasound imaging of irreversible electroporation in a porcine liver model adequately characterizes the zone of cellular necrosis[J]. HPB(Oxford), 2012, 14(2):98-102.
[13]Li W, Fan Q, Ji Z, et al. The effects of irreversible electroporation (IRE) on nerves[J]. PLoS One, 2011, 6(4):e18831.
[14]Lee YJ, Lu DS, Osuagwu F, et al. Irreversible electroporation in porcine liver: short- and long-term effect on the hepatic veins and adjacent tissue by CT with pathological correlation[J]. Invest Radiol, 2012, 47(11):671-675.
[15]Kingham TP, Karkar AM, D′Angelica MI, et al. Ablation of perivascular hepatic malignant tumors with irreversible electroporation[J]. J Am Coll Surg, 2012, 215(3):379-387.
收稿日期:(2014-09-26)
(本文编辑:屠振兴)

