强胰降糖胶囊对鹌鹑高尿酸血症的影响
宋振辉 皮渤淼 王乔姬 李 春 李旋珠
云南中医学院,云南昆明 650500
高尿酸血症是一种常见和多发疾病。血液中尿酸饱和度为420μmol/L(7mg/dL),当人体在37℃时,血尿酸长时间持续超过这个饱和点,则称之为高尿酸血症[1]。近年来,高尿酸血症患病率正逐年升高,且发病年龄趋向年轻化[2],已成为威胁人类健康的重要疾病[3]。血尿酸水平升高与脂代谢紊乱、糖尿病及心血管疾病等密切相关。高尿酸血症患者中有10%~20%发展为痛风,而降低血尿酸水平也是治疗痛风的的关键因素之一,因此高尿酸血症在临床上更受关注。
强胰降糖胶囊是临床应用近20年的院内制剂,2014年获得发明专利1项。该制剂由黄芪、葛根、丹参、三七等纯中药制成。课题组在前期临床和实验研究中发现该制剂具有降低血糖、血尿酸、调节血脂和防治糖尿病肾病等作用[4-8]。基于前期的研究成果,本实验主要观察该制剂对高尿酸血症鹌鹑的影响,为临床新应用提供实验依据。
1 材料与方法
1.1 动物
迪法克种鹌鹑,雄性,体重100~120g,5周龄,由昆明市艾尼莫实验动物中心提供。
1.2 药物
强胰降糖胶囊由三七、葛根、丹参、黄芪等组成。每粒(0.5g)含生药1.3g,由课题组提供,临用时除去胶囊壳,用蒸馏水配成3个浓度:高剂量1.0g/mL,中剂量0.5g/mL,低剂量0.25g/mL。阳性药选择别嘌醇片(重庆青阳药业有限公司生产,生产批号140602),给药浓度为26mg/kg[9]。酵母干粉(英国OXOID公司生产,批号:1214989-02),临用时用蒸馏水配制成1g/mL溶液。
表1 强胰降糖胶囊对高尿酸血症鹌鹑血清中尿酸水平的影响(±s,μmol/L,n=10)
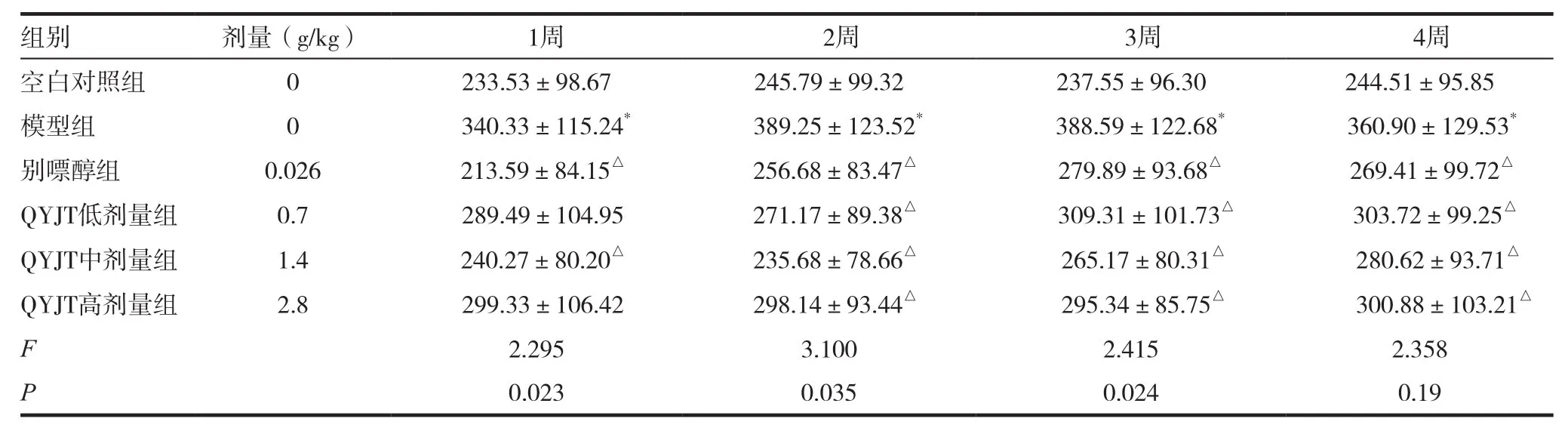
表1 强胰降糖胶囊对高尿酸血症鹌鹑血清中尿酸水平的影响(±s,μmol/L,n=10)
注:与空白组对比,*P<0.05,**P<0.01;与模型组对比,△P<0.05,△△P<0.01;各组间比较:模型组与空白组,1周P=0.019,2周P=0.011,3周P=0.016,4周P=0.013;别嘌醇组与模型组,1周P=0.032,2周P=0.027,3周P=0.031,4周P=0.019;QYJT低剂量组与模型组,1周P=0.055,2周P=0.039,3周P=0.047,4周P=0.041;QYJT中剂量组与模型组,1周P=0.021;2周P=0.012;3周P=0.025;4周P=0.017;QYJT高剂量组与模型组,1周P=0.030,2周P=0.034,3周P=0.041,4周P=0.039
组别 剂量(g/kg) 1周 2周 3周 4周空白对照组 0 233.53±98.67 245.79±99.32 237.55±96.30 244.51±95.85模型组 0 340.33±115.24* 389.25±123.52* 388.59±122.68* 360.90±129.53*别嘌醇组 0.026 213.59±84.15△ 256.68±83.47△ 279.89±93.68△ 269.41±99.72△QYJT低剂量组 0.7 289.49±104.95 271.17±89.38△ 309.31±101.73△ 303.72±99.25△QYJT中剂量组 1.4 240.27±80.20△ 235.68±78.66△ 265.17±80.31△ 280.62±93.71△QYJT高剂量组 2.8 299.33±106.42 298.14±93.44△ 295.34±85.75△ 300.88±103.21△F 2.295 3.100 2.415 2.358 P 0.023 0.035 0.024 0.19
1.3 试剂
尿酸(UA)临床诊断试剂盒,批号140581;甘油三酯(TG)临床诊断试剂盒,批号146951,均为中生北控生物科技股份有限公司生产;黄嘌呤氧化酶(XOD)测试盒(南京建成生物工程研究所生产,生产批号20150327)。
1.4 仪器
Infinite M200 PRO酶标仪,瑞士Tecan公司生产;LG10-2.4A高速离心机,北京医用离心机厂生产;HH-6数显恒温水浴锅,常州国华电器有限公司生产;UV-4802H型紫外分光光度计,尤尼柯(上海)仪器有限公司;JJ1000型电子天平,常熟市双杰测试仪器厂。
1.5 方法
1.5.1 动物分组 迪法克种雄性鹌鹑,根据体重大小分层后,随机分为6组:空白对照组、模型组、阳性药组、强胰降糖胶囊(QYJT)低、中、高剂量组,每组10只。除空白对照组正常饮食外,其余各组早上灌胃酵母干粉15g/(kg·d),晚上模型组灌胃等体积的蒸馏水,用药组分别给予别嘌醇26mg/(kg·d)和强胰降糖胶囊低[0.7g/(kg·d)临床2倍等效剂量]、中[1.4g/(kg·d)临床4倍等效剂量]、高[2.8g/(kg·d)临床8倍等效剂量]剂量灌胃。
1.5.2 检测指标 每周监测鹌鹑体重变化,灌胃给药第7、14、21天,动物禁食12h,于翼根静脉取血1mL左右,3000r/min离心10min,分离血清,用酶比色法测定血清中UA和TG含量,给药第28天鹌鹑断头取血处死,同上测定血清中UA和TG含量,取肝脏组织,0~4℃环境下手工匀浆,4℃,3000r/min离心10min,取上清液按照试剂盒说明书方法用紫外分光光度计检测肝脏中黄嘌呤氧化酶(XOD)活性。
1.6 统计学处理
2 结果
2.1 强胰降糖胶囊对高尿酸血症鹌鹑血清中尿酸水平的影响
强胰降糖胶囊各剂量组均具有降低鹌鹑血尿酸的作用,其中以中剂量效果最佳,高剂量组降尿酸效果较其他两个剂量组稳定,见表1。
2.2 强胰降糖胶囊对高尿酸血症鹌鹑血清中甘油三酯水平的影响
强胰降糖胶囊各剂量组均呈现降甘油三酯作用,以中剂量效果为最佳,见表2。
2.3 强胰降糖胶囊对高尿酸血症鹌鹑肝脏黄嘌呤氧化酶活性的影响
各个剂量组均具有明显的抑制鹌鹑肝脏XOD活性的作用,且其降低的程度与降尿酸的程度基本保持抑制,说明该制剂降尿酸作用与其抑制XOD活性存在着密切的联系,见表3。
2.4 各组鹌鹑实验过程中体重变化
整个实验过程中,各组鹌鹑的体重无明显变化,见表4。
表2 强胰降糖胶囊对高尿酸血症鹌鹑血清中甘油三酯水平的影响(±s,mmol/L,n=10)
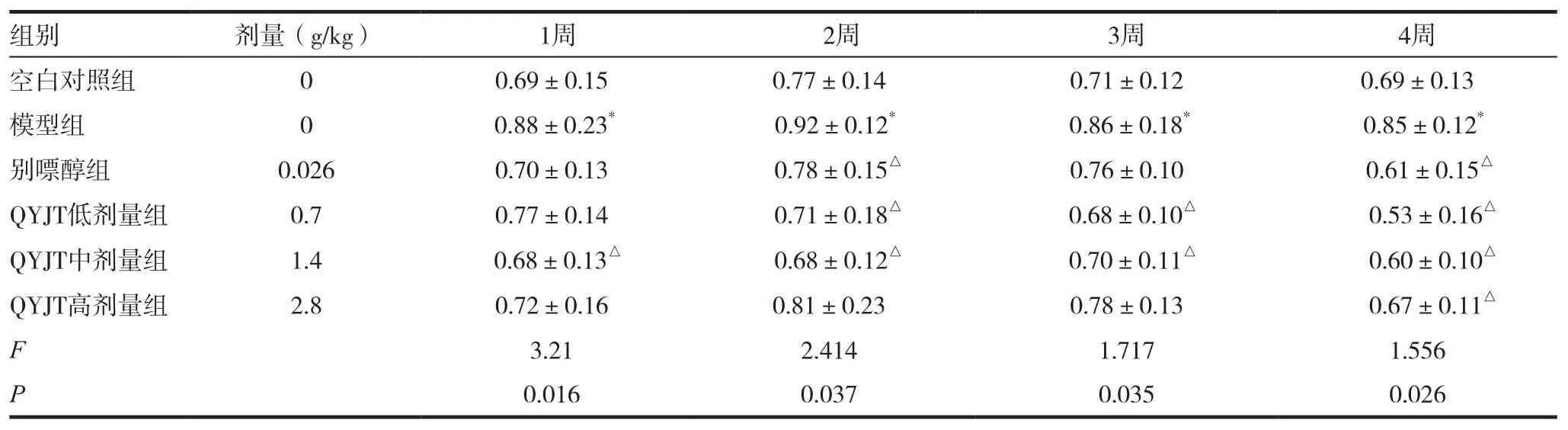
表2 强胰降糖胶囊对高尿酸血症鹌鹑血清中甘油三酯水平的影响(±s,mmol/L,n=10)
注:与空白组对比,*P<0.05,**P<0.01;与模型组对比,△P<0.05,△△P<0.01。各组间比较:模型组与空白组,1周P=0.025,2周P=0.033,3周P=0.042,4周P=0.037;别嘌醇组与模型组,1周P=0.029,2周P=0.042,3周P=0.067,4周P=0.035;QYJT低剂量组与模型组,1周P=0.048,2周P=0.047,3周P=0.035,4周P=0.013;QYJT中剂量组与模型组,1周P=0.047,2周P=0.035,3周P=0.029,4周P=0.023;QYJT高剂量组与模型组,1周P=0.035,2周P=0.039,3周P=0.025,4周P=0.037
组别 剂量(g/kg) 1周 2周 3周 4周空白对照组 0 0.69±0.15 0.77±0.14 0.71±0.12 0.69±0.13模型组 0 0.88±0.23* 0.92±0.12* 0.86±0.18* 0.85±0.12*别嘌醇组 0.026 0.70±0.13 0.78±0.15△ 0.76±0.10 0.61±0.15△QYJT低剂量组 0.7 0.77±0.14 0.71±0.18△ 0.68±0.10△ 0.53±0.16△QYJT中剂量组 1.4 0.68±0.13△ 0.68±0.12△ 0.70±0.11△ 0.60±0.10△QYJT高剂量组 2.8 0.72±0.16 0.81±0.23 0.78±0.13 0.67±0.11△F 3.21 2.414 1.717 1.556 P 0.016 0.037 0.035 0.026
表3 强胰降糖胶囊对高尿酸血症鹌鹑肝脏黄嘌呤氧化酶活性的影响(±s,U/gprot,n=10)
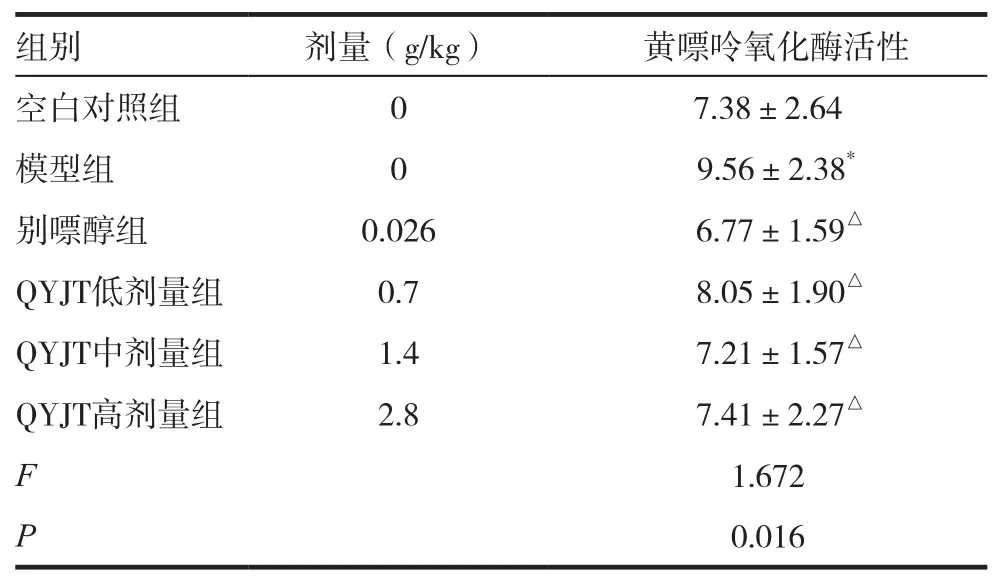
表3 强胰降糖胶囊对高尿酸血症鹌鹑肝脏黄嘌呤氧化酶活性的影响(±s,U/gprot,n=10)
注:与空白组对比,*P<0.05,**P<0.01;与模型组对比,△P<0.05,△△P<0.01。各组间比较,模型与空白组:P=0.018;别嘌醇组与模型组:P=0.011;QYJT低剂量组与模型组:P=0.026;QYJT中剂量组与模型组:P=0.021;QYJT高剂量组与模型组:P=0.035
组别 剂量(g/kg) 黄嘌呤氧化酶活性空白对照组 0 7.38±2.64模型组 0 9.56±2.38*别嘌醇组 0.026 6.77±1.59△QYJT低剂量组 0.7 8.05±1.90△QYJT中剂量组 1.4 7.21±1.57△QYJT高剂量组 2.8 7.41±2.27△F 1.672 P 0.016
表4 各组鹌鹑体重的变化(±s,g/只,n=10)
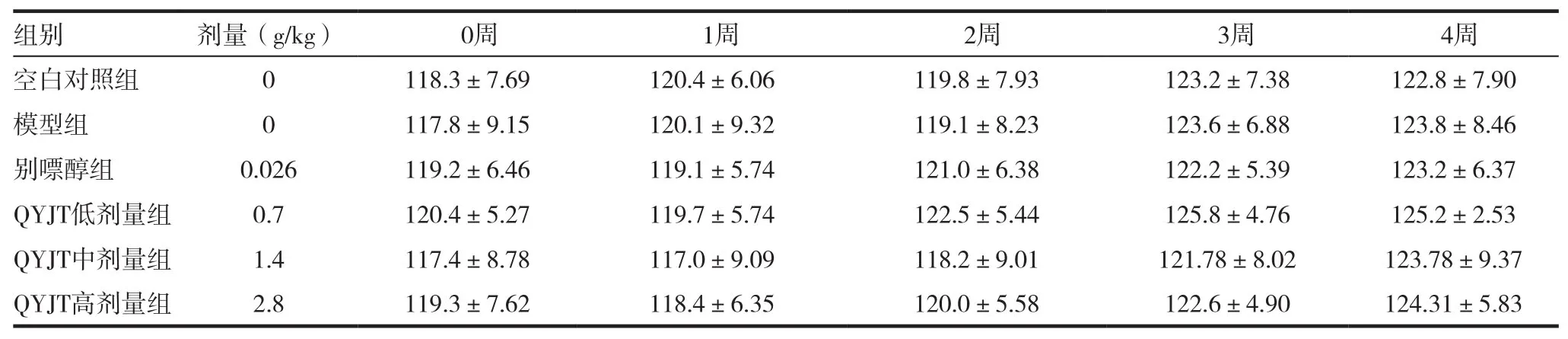
表4 各组鹌鹑体重的变化(±s,g/只,n=10)
注:各组间比较无统计学意义
组别 剂量(g/kg) 0周 1周 2周 3周 4周空白对照组 0 118.3±7.69 120.4±6.06 119.8±7.93 123.2±7.38 122.8±7.90模型组 0 117.8±9.15 120.1±9.32 119.1±8.23 123.6±6.88 123.8±8.46别嘌醇组 0.026 119.2±6.46 119.1±5.74 121.0±6.38 122.2±5.39 123.2±6.37 QYJT低剂量组 0.7 120.4±5.27 119.7±5.74 122.5±5.44 125.8±4.76 125.2±2.53 QYJT中剂量组 1.4 117.4±8.78 117.0±9.09 118.2±9.01 121.78±8.02 123.78±9.37 QYJT高剂量组 2.8 119.3±7.62 118.4±6.35 120.0±5.58 122.6±4.90 124.31±5.83
3 讨论
高尿酸血症与痛风是由嘌呤代谢紊乱引起的疾病,尿酸结晶沉积到软组织引起的病变称为痛风[10]。实验研究表明,高血糖(GLU)、高尿酸血(UA)与高甘油三酯(TG)存在着非常密切的联系,血清Glu、UA、TG三者呈正相关关系,一个指标的紊乱会引起其他指标的紊乱[11]。高尿酸血症可作用于血管和晶体形成,进而引发炎症和血管内皮损伤;能够提高肾素活性,增加血小板黏附促进血栓形成;高水平尿酸可促进低密度脂蛋白胆固醇的氧化和加速脂质的氧化反应;另外高尿酸血症还可以引发代谢紊乱[12],因此,高尿酸血症常常伴有高血压、糖尿病、高血脂、冠心病、肥胖等疾病的发生。高尿酸血症对人类健康存在极大的危害,因而日益受到学术界的关注。
大多数哺乳动物肝脏中存在尿酸酶,可将尿酸分解为更易溶解的尿囊素排出体外,而灵长类在进化过程中产生该酶类的基因发生突变,而缺少尿酸酶[13]。禽类与人的嘌呤代谢途径相似,因缺乏尿酸酶都以尿酸为最终代谢产物排出体外,因此选择禽类作为高尿酸血症模型更能确切的反应体内嘌呤代谢水平[14],故本实验选择鹌鹑作为实验对象。
本实验研究了强胰降糖胶囊对高尿酸血症伴高甘油三酯血症鹌鹑模型的作用,结果显示强胰降糖胶囊能明显降低鹌鹑血清中UA和TG含量,通过3个不同剂量的比较,3个剂量的强胰降糖胶囊均具有明显的效果,其中以中剂量降尿酸效果最佳。通过对鹌鹑肝脏中黄嘌呤氧化酶活性的测定发现强胰降糖胶囊3个剂量均能够明显降低鹌鹑肝脏组织中黄嘌呤氧化酶活性,而XOD是尿酸生成过程中重要的酶类,XOD能够连续氧化黄嘌呤、次黄嘌呤生成尿酸[15-16]。而强胰降糖胶囊能降低XOD活性,且各个剂量组降低XOD活性的程度与降低血清中尿酸的程度基本保持一致,说明其降尿酸的作用机制与其降低XOD活性存在必然的联系。强胰降糖胶囊为复方制剂,其降尿酸和降低甘油三酯应该是多靶点、多方面的,其降尿酸和降脂的机制值得进一步研究。
[1]陈灏珠.实用内科学[M].第12版.北京:人民卫生出版社,2005:2602-2609.
[2]杨雅静,鲍龙,崔月.高尿酸血症发病机制及治疗研究[J].中外健康文摘,2011,8(7):142-144.
[3]拜淑萍.高尿酸血症的现代研究进展[J].中外健康文摘,2012,9(9):88-91.
[4]李璇珠,曹东,李文军,等.强胰降糖胶囊对高脂食料与链脲佐菌素诱导的大鼠糖尿病模型血脂的影响[J].中国中医药科学,2005,12(2):101.
[5]李旋珠,熊洪艳,林青.强胰降糖胶囊对糖尿病模型大鼠的影响[J].中国中西医结合杂志,2005,25(12):1109-1111.
[6]吴荣,李旋珠,王阶.强胰降糖胶囊治疗2型糖尿病临床观察[J].中华中医药学刊,2008,26(8):1749-1751.
[7]熊凡.强胰降糖胶囊敢于实验性糖尿病及其早期肾病的部分药效学研究[D].昆明:云南中医学院,2013:35.
[8]李春.强胰降糖胶囊对2型糖尿病大鼠胰腺和肾脏保护作用的研究[D].昆明:云南中医学院,2015:29-32.
[9]赵恒立.六味痛风饮防治痛风性关节炎作用机理的实验研究[D].济南:山东中医药大学,2009:26-28.
[10]赵占正,肖静,刘长锁.苯溴马龙与别嘌醇治疗高尿酸血症/痛风的疗效观察[J].中国误诊学杂志志,2005,5(2):281-282.
[11]孙悦,张冰.菊苣提取物对高甘油三酯、高尿酸并高血糖大鼠影响的实验研究[J].中华中医药杂志,2005,20(6):379-380.
[12]杨瑾,于晓玲.高尿酸血症与冠心病之间的关系[J].医学与哲学,2014,35(2B):53-55.
[13]Wu XW,Muzny DM,Lee CC,et al.Two indenpendent mutational events in the loss of urate oxidase during hominoid evolution[J].Mol Evol J,1992,34:78-84.
[14]陈光亮,徐叔云.高尿酸血症动物模型研究进展[J].中国药理学通报,2004,20(4):369-373.
[15]孙悦,张冰.黄嘌呤氧化酶活性在高尿酸血症动物模型中的变化[J].北京中医药大学学报,2004,27(6):38-40.
[16]陈代国.高尿酸血症合并高血压的药物选择探讨[J].中国现代医生,2014,52(35):154-156.

