异甘草素对黄嘌呤氧化酶抑制的影响及机制
异甘草素对黄嘌呤氧化酶抑制的影响及机制
张瑞城钟良宝梁海琴周桔丰
(海南医学院附属医院肾内科,海南海口570102)
摘要〔〕目的探讨异甘草素对黄嘌呤氧化酶(XO)的抑制作用机制。方法采用酶抑制动力学方法,研究异甘草素对XO的抑制作用和失活动力学,研究异甘草素对高尿酸小鼠尿酸(BUA)、肌酐(Cr)和尿素氮(BUN)含量及XO活性的影响。结果异甘草素对XO有良好的抑制作用〔半抑制浓度(IC50)为(19.32±2.23)μmol/L〕,失活动力学分析木犀草素能够快速抑制XO的活性,此外异甘草素能够明显的降低高尿酸小鼠BUA、Cr和BUN含量及XO活性(Pc<0.05,Pb<0.01)。结论异甘草素作为一种XO抑制剂,能够快速诱导了XO活性的降低和BUA、Cr和BUN含量的降低,对调节患者尿酸水平起到重要作用,为临床抗高尿酸血症和痛风提供理论基础。
关键词〔〕异甘草素;黄嘌呤氧化酶;高尿酸小鼠;尿酸
中图分类号〔〕R285.5〔文献标识码〕A〔
基金项目:海南省自然科学基金资助项目(20158333)
通讯作者:周桔丰(1979-),女,营养师,主管护师,主要从事肾脏疾病营养与代谢研究。
第一作者:张瑞城(1976-),男,硕士,副主任医师,主要从事慢性肾脏疾病基础与临床研究。
黄嘌呤氧化酶(XO)可以在机体内催化嘌呤类物质产生尿酸(BUA),并伴随着自由基的生成,当体内XO活性异常活跃时,嘌呤代谢而产生的BUA量增加,BUA在血液中最大饱和度为416.5 μmol/L,当浓度超过这个临界值时,BUA在体内就会产生结晶〔1〕,出现急性的生理炎症反应,从而引发高BUA血症〔2〕,进而引起痛风的发作〔3〕。通过抑制XO的活性能够抑制BUA的生成,并调整BUA在新陈代谢中的平衡,因此,XO抑制剂可以从根源上很好地控制、减轻高BUA血症和痛风。异甘草素属于黄酮类中的异黄酮类化合物,存在于豆科植物〔4~6〕中,具有较强的抗病毒、抗炎、抗血管生成、催眠等活性,其中,其降BUA作用是近年来研究的热点。本课题研究异甘草素对XO的抑制作用和失活动力学,以期为异甘草素在降BUA治疗领域更有效的应用提供理论参考。
1材料与方法
1.1仪器与试剂本实验选用动物模型为ICR小鼠30只,质量为(20±2)g(湖南斯莱克景达实验动物有限公司);XO从牛乳中提取、氧嗪酸钾盐(Sigma公司),其标准溶液用pH 7.5的磷酸盐缓冲液(0.05 mol/L)进行配制;黄嘌呤(Sigma公司),异甘草素、别嘌呤醇(阿拉丁试剂有限公司);缓冲体系为pH 7.5的磷酸盐(50 mmol/L)。
UV-2450紫外-可见分光光度计(日本岛津公司);血BUA检测试剂盒(北京普析通用仪器有限责任公司);Millipore Simplicity水纯化系统(法国密理博公司);pHs-3C型酸度计(上海雷磁仪器厂);肌酐(Cr)、XO、 尿素氮(BUN)检测试剂盒(阿拉丁试剂有限公司)。
1.2方法
1.2.1异甘草素对XO的抑制能力测定XO催化黄嘌呤产生BUA(在290 nm处有特征吸收峰),参考文献〔7〕的方法,在37℃下、XO(1×10-7mol/L)和不同浓度的异甘草素孵化3 h后,加入黄嘌呤,利用UV-2450紫外分光光度计的动力学/时间软件,在290 nm处的吸光值每隔30 s测定1次,计算在含有不同异甘草素浓度的体系下XO的相对活性。
1.2.2异甘草素存在下,XO的失活动力学测定在37℃,相同的缓冲体系下,每隔3 min从不同浓度的异甘草素与XO孵化体系中取出相同体积的孵化液,加入底物,利用紫外-可见分光光度计的动力学/时间软件测定XO失活的时间进程,并测定异甘草素存在下XO的失活速率。
1.2.3小鼠BUA、Cr和BUN含量及XO活性测定除正常组外,其他组均给予腹腔注射氧嗪酸钾盐,作为高BUA血症模型。在对小鼠注射氧嗪酸钾盐1 h后,从小鼠的眼眶后静脉丛进行采血,25℃静置1 h,之后3 500 r/min离心15 min,分离血清,采用全自动生化分析仪检测Cr、BUA和BUN含量;同时取小鼠肝脏的同一部位约100 mg,加入10 ml生理盐水,并以8 000 r/min的速度匀浆20 min,使其组织充分匀浆化,之后将匀浆液以3 500 r/min的速度离心15 min,进行XO活性检测。实验均重复3次。
1.3统计学分析采用SPSS13.0软件进行方差分析。
2结果
2.1异甘草素对XO的抑制作用随着异甘草素(0~100 μmol/L)和别嘌呤醇(0~50 μmol/L)浓度的增加,XO的活性不断降低;当异甘草素的浓度达到50 μmol/L时,其对XO的抑制能力趋于平缓,解析异甘草素和别嘌呤醇对XO的半数抑制浓度(IC50)为(19.32±2.23)μmol/L和(6.21±0.63)μmol/L。见图1。
2.2XO的失活动力学研究在不同异甘草素浓度存在下,XO的相对活性随着异甘草素孵化时间的增加并没有发生变化。见图2。
2.3异甘草素对小鼠BUA、Cr和BUN含量及XO活性的影响模型组的BUA、Cr和BUN含量及XO活性明显高于空白对照组(P<0.01);阳性对照别嘌呤醇组的BUA、Cr和BUN含量及XO活性明显低于模型组(P<0.01);随着异甘草素组浓度的增大,BUA、Cr和BUN含量及XO活性越来越明显的低于模型组,在中剂量(25 μmol/L,P<0.05)和高剂量(75 μmol/L,P<0.01)时,BUA、Cr和BUN含量及XO活性明显低于模型组。见表1。
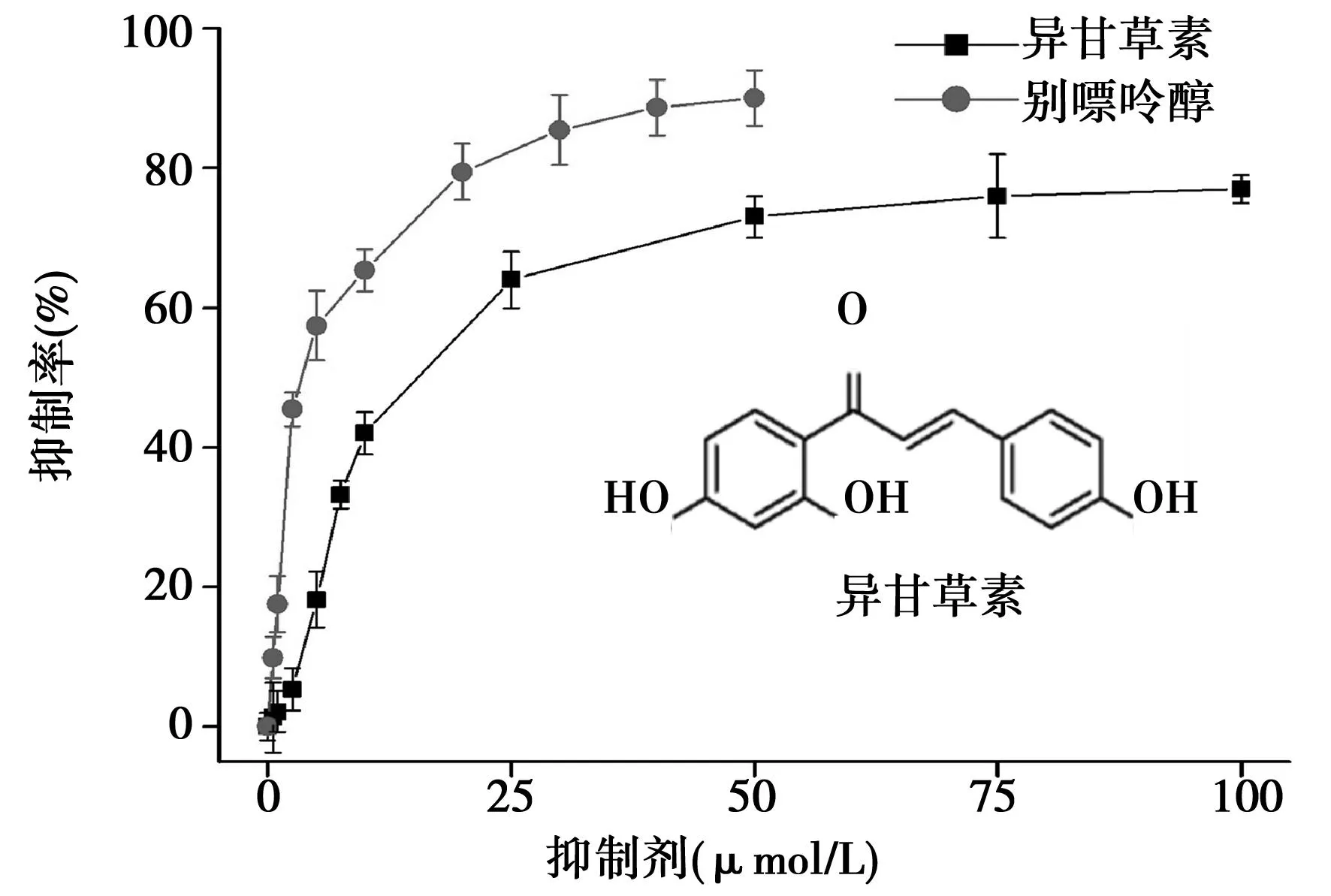
图1 异甘草素对XO活性的影响
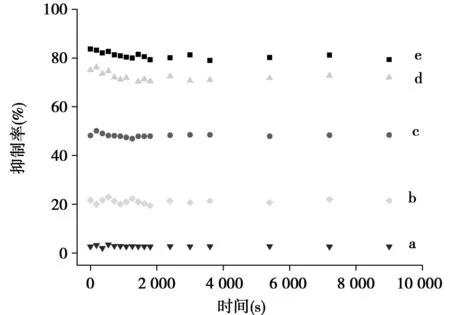
图2 异甘草素抑制XO的时间进程
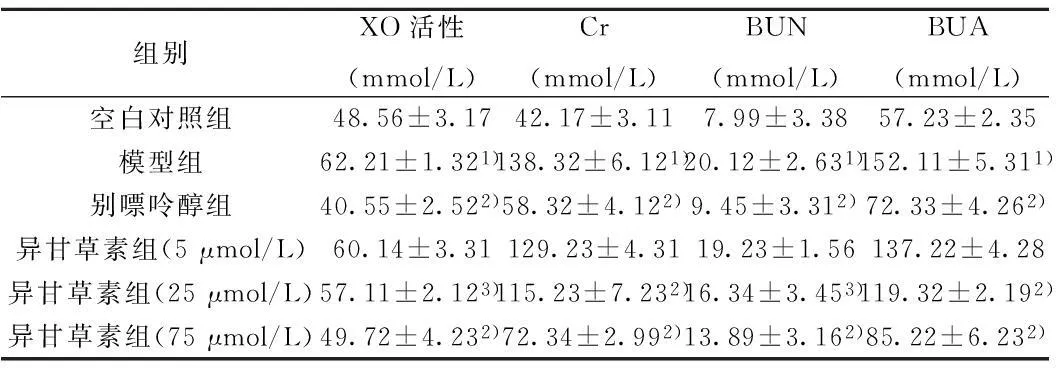
组别XO活性(mmol/L)Cr(mmol/L)BUN(mmol/L)BUA(mmol/L)空白对照组48.56±3.1742.17±3.117.99±3.3857.23±2.35模型组62.21±1.321)138.32±6.121)20.12±2.631)152.11±5.311)别嘌呤醇组40.55±2.522)58.32±4.122)9.45±3.312)72.33±4.262)异甘草素组(5μmol/L)60.14±3.31129.23±4.3119.23±1.56137.22±4.28异甘草素组(25μmol/L)57.11±2.123)115.23±7.232)16.34±3.453)119.32±2.192)异甘草素组(75μmol/L)49.72±4.232)72.34±2.992)13.89±3.162)85.22±6.232)
与空白对照组相比:1)P<0.01,与模型组相比:2)P<0.01,3)P<0.05
3讨论
目前是对高UA血症和痛风的药物治疗可分为三种类型:一类是药物通过降低或者减轻痛风带来的炎症反应来达到治疗的目的。第二种是通过生物体内BUA排泄的增加,而达到降低血BUA的效果。第三种是能够抑制BUA生成的药物,即XO抑制剂〔8〕。目前临床上用于抑制XO活性的抑制剂主要是别嘌呤醇,是一种竞争性嘌呤类似物抑制剂,也是次黄嘌呤的异构体,它能够与酶活性中心的 Mo(Ⅳ)牢固结合,使 Mo(Ⅳ)不能轻易转变为 Mo(Ⅵ),进而抑制了BUA的生成〔9〕。但别嘌呤醇会引发毒副作用,因此,研究新的安全无副作用的XO抑制剂具有十分重要的意义。天然产物有效成分的XO的抑制剂来源广泛,安全性高,引起了广泛的关注。(1)食物来源的XO抑制剂,主要为生姜、山药和蒜〔10〕,蜂胶〔11〕,玉米〔12〕;(2)中药来源的XO抑制剂,主要为樗白皮〔13〕,卷柏属种〔14〕,买麻藤〔15〕、丹参〔16〕、土连翘〔17〕,金银花〔18〕。从以上抑制剂来源结果发现,黄酮类物质和酚酸类成分具有良好的XO抑制活性。且黄酮类化合物安全、有效,越来越成为治疗痛风药物开发的重点。然而,植物成分的药理药效不明,又制约了它的开发,因此,探讨具有功能性因子的天然活性成分对XO抑制机制的研究是迫切需要的。本文研究表明,异甘草素能够有效降低高BUA小鼠BUA、Cr和BUN含量及XO活性,此外,异甘草素对XO的抑制作用具有浓度依赖性,并能够改变酶的生理结构和性质〔10〕。
抑制剂与酶的结合强弱、结合速度等直接关系到其对酶的抑制作用,药物的治疗效应以及药物的副作用。本研究结果还发现异甘草素能够轻松的与XO发生作用或者改变XO的构象,使酶的活性得到快速的抑制,且在短时间内失活,这意味着异甘草素能够使XO的稳定态活力均快速下降,逐渐干扰底物与XO的结合,使尿酸含量在短时间内得以控制,及时缓解病人痛苦,值得临床推广。
4参考文献
1中国医师协会心血管内科医师分会.无症状高尿酸血症合并心血管疾病诊治建议中国专家共识〔J〕.中国医学前沿杂志,2010;2(3):49-55.
2郑小微,夏道宗,张英,等.梅花总黄酮对黄嘌呤氧化酶的抑制作用及其抗氧化活性评价〔J〕.食品工业科技,2011;32(11):168-73.
3Perez-Ruiz F,Hernando I,Villar I,etal.Correction of allopurinol dosing should be based on clearance of creatinine,but not plasmacreatinine levels:another insight to allopurinol-related toxicity〔J〕.Clin Rheumatol,2005;11(3):129-33.
4Gong H,Zhang BK,Yan M,etal.A protective mechanism of licorice(Glycyrrhiza uralensis):isoliquiritigenin stimulates detoxification system via Nrf2 activation〔J〕.J Ethnopharmacol,2015;162(2):134-9.
5Zhao Z,Park SM,Guan L,etal.Isoliquiritigenin attenuates oxidative hepatic damage induced by carbon tetrachloride with or without buthionine sulfoximine〔J〕.Chem Biol Interact,2015;225(1):13-20.
6Takahama U,Koga Y,Hirota S,etal.Inhibition of xanthine oxidase activity by an oxathiolanone derivative of quercetin 〔J〕.Food Chem,2011;126(4):1808-11.
7Lin L,Dong Y,Zhao H,etal.Comparative evaluation of rosmarinic acid,methyl rosmarinate and pedalit isolated from Rabdosia serra(MAXIM)HARA as inhibitors of tyrosinase and α-glucosidase 〔J〕.Food Chem,2011;129(3):884-9.
8赵雪梅,谭昌恒,张辉.猫须草提取物对黄嘌呤氧化酶的抑制作用〔J〕.中药药理与临床,2009;25(3):45-7.
9赵莹,张启虹,冯明声,等.降尿酸药物黄嘌呤氧化酶抑制剂的研究进展〔J〕.药学进展,2009;33(2):55-61.
10祁鑫,王昌禄,李风娟,等.常见蔬菜提取物对黄嘌呤氧化酶抑制作用的筛选研究〔J〕.现代食品科技,2011;27(5):511-4.
11吉积一真,贺玉琢.蜂胶降低黄嘌呤氧化酶活性及血浆尿酸值的作用〔J〕.国际中医中药志,2006;28(2):100-1.
12姜彤伟,徐建,王晓明,等.玉米须中抑制黄嘌呤氧化酶活性组分的筛选及其作用〔J〕.吉林大学学报·医学版,2011;37(3):433-5.
13程富胜,胡庭俊,董鹏程,等.樗白皮提取物对小白鼠体内黄嘌呤氧化酶活性的影响〔J〕.中国兽医科学,2006;36(8):665-7.
14黎莉,陈科力,牛田密,等.卷柏属7种药用植物的提取物抑制黄嘌呤氧化酶的活性研究〔J〕.中药材,2007;30(4):445-7.
15杨琴芳,袁红宇,钱雅璐,等.买麻藤提取物抑制黄嘌呤氧化酶活性实验研究〔J〕.江苏中医药,2009;41(12):77-8.
16尚雁君,黄才国,蒋三好,等.迷迭香酸对黄嘌呤氧化酶的抑制作用〔J〕.第二军医大学学报,2006;27(2):189-91.
17杨增明,杨树娟.土连翘体外抑制黄嘌呤氧化酶活性研究〔J〕.中药材,2010;33(6):964-7.
18李英,陈君,李萍.金银花中酚酸类和黄酮类成分的黄嘌呤氧化酶抑制活性〔J〕.中国药科大学报,2011;42(5):407-11.
〔2015-04-17修回〕
(编辑袁左鸣)

