有机胺控制AlCl3与LiH合成AlH3的研究
万 剑,赵云鹏,楚合涛,朱朝阳,3,高跃岳,杨玉林
(1.齐齐哈尔大学,黑龙江 齐齐哈尔 161000;2.哈尔滨工业大学,哈尔滨 150000;
3.湖北航天化学技术研究所,湖北 襄阳 441003)
有机胺控制AlCl3与LiH合成AlH3的研究
万剑1,2,赵云鹏1,楚合涛2,朱朝阳2,3,高跃岳2,杨玉林2
(1.齐齐哈尔大学,黑龙江 齐齐哈尔161000;2.哈尔滨工业大学,哈尔滨150000;
3.湖北航天化学技术研究所,湖北 襄阳441003)
摘要:以LiH和AlCl3为原料,且采用N,N-二甲基乙胺(DMEA)控制反应合成N,N-二甲基乙胺合氢化铝(DMEAA)。然后进行DMEAA与三乙胺(TEA)胺转换反应,得到三乙胺合氢化铝(TEAA);最后经过真空加热得到目标产物AlH3;同时用红外光谱(FT-IR)、粉末X-射线衍射(XRD)和热重分析(TG)对反应中间物及产物进行分析和表征。实验表明,该合成路线可行,以廉价的LiH代替LiALH4有效降低AlH3的制备成本。
关键词:有机胺;N,N-二甲基乙胺氢化铝;三乙胺氢化铝;胺转换反应;AlH3
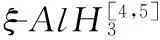
本研究尝试使用廉价原料LiH和AlCl3反应成功合成出AlH3。据文献报道[10],LiH与AlCl3反应在无胺控制剂的情况,直接反应得到LiAlH4。本研究以LiH和AlCl3为原料,采用N,N-二甲基乙胺(DMEA)控制合成N,N-二甲基乙胺合氢化铝(DMEAA),DMEAA与三乙胺(TEA)进行胺转换反应得到三乙胺合氢化铝(TEAA),再经过加热可获得AlH3,运用红外光谱(FT-IR)、粉末X-射线衍射(XRD)和热重分析(DTG)对反应中间物及产物进行分析和表征。
1实验部分
1.1 试剂与仪器
LiH,分析纯,河北廊坊市烨联商贸有限公司;AlCl3,分析纯,天津市风船化学试剂科技有限公司;LiAlH4,分析纯,河北廊坊市烨联商贸有限公司;N,N-二甲基乙胺,分析纯,TCI东京化成株式会社;三乙胺,ACROS;四氢呋喃,分析纯,天津光复精细化工研究所;α-AlH3由合成实验室得到。
日本理学D/max-rB型X-射线衍射仪(Cu靶);美国尼高力Avatar-360型红外光谱仪;法国塞塔拉姆DSC141型差热扫描量热仪;德国NETZSCHSTA449CTG-DSC分析仪。
1.2 实验过程
1.2.1DMEAA的合成
在150mL单口烧瓶中,加入2.67g(20mmol)AlCl3、40 mL DMEA,30 mL四氢呋喃作为溶剂;另取250 mL三口烧瓶,加入0.64 g (80 mmol) LiH和30 mL四氢呋喃;将溶有AlCl3的混合液室温缓慢滴加到LiH的四氢呋喃悬浮液中,滴加完毕后,继续搅拌4 h。过滤得到滤液,然后减压蒸馏,除去四氢呋喃和多余的DMEA,得到白色固体粉末1.29g (DMEAA样品)。
1.2.2胺转换反应
在100mL三口烧瓶中,加入1.03g(10mmol)DMEAA、20mLTEA,20mL四氢呋喃作为溶剂,搅拌30min。不断用氮气吹扫反应瓶将反应温度控制在70℃,搅拌9h后停止,室温冷却。减压蒸馏除去多余的TEA,得到无色透明液体(TEAA样品)。
1.2.3AlH3的制备
在装有TEAA烧瓶中加入少量LiAlH4搅拌10 min后,将其放入真空干燥箱中,在70℃条件下反应4 h后。室温用乙醚洗涤(3×15 mL),然后干燥后得到了白色的固体粉末 0.14 g (AlH3样品)。
1.2.4标准DMEAA与TEAA的制备
根据文献报道[11],标准DMEAA和TEAA可通过胺类化合物与α-AlH3直接反应制备得到。首先,将胺类化合物加入到甲苯中搅拌几分钟;然后,缓慢加入α-AlH3,加入完毕后,加热并继续搅拌若干小时;最后,通过过滤和减压蒸馏除去未反应的α-AlH3和胺化合物及反应溶剂。本文用上述的方法制备标准DMEAA和TEAA。
2结果与讨论
2.1 DMEAA样品的表征
由图1(b) 可知2 982cm-1和2 762cm-1处的吸收峰为CH3,CH2的不对称伸缩振动吸收峰;1 452 cm-1处的吸收峰为CH3,CH2的对称变形振动吸收峰;1 382 cm-1处的吸收峰为CH3的对称变形振动,1 656 cm-1处为Al-H的拉伸振动吸收峰,1 321cm-1处弱的吸收峰为Al-N键的伸缩振动吸收峰,618cm-1处的吸收峰为Al-N键的弯曲吸收峰。将DMEAA样品红外光谱图1(b)与标准DMEAA红外光谱图1(a) 进行了对比,样品红外吸收峰与标准DMEAA一致的。因此,从以上分析结果可知本研究合成了DMEAA。根据有关文献报道[9],LiH可以直接与AlCl3反应得到产物LiAlH4。本研究通过使用配位剂,改变原有的反应路径,得到反应产物AlH3胺配合物。发生这种反应的原因是DMEA作为一种配位剂,它可以在LiH和AlCl3反应之前,先与AlCl3发生配位反应,生成的AlCl3配合物再与LiH反应,最终生成目标产物DMEAA。
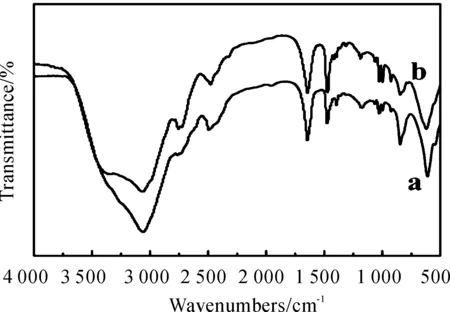
图1 标准DMEAA(a)与DMEAA样品(b)的红外光谱
为了验证DMEAA的分子结构,对DMEAA进行热重分析(图2),并根据热重分析结果作了相应计算。由DMEAA样品的热重曲线图可知,DMEAA样品的分解过程经历了两个阶段。两个失重阶段推测发生了两个分解反应,反应方程式如失重图中所示。第一阶段从182℃到376℃,此阶段发生的反应是DMEAA受热分解为甲烷和乙烷以及AlN,失重是由于甲烷和乙烷的缺失造成的(实际失重为60.2%,理论计算失重为60.1%),。第二阶段从376℃到750℃,生成的AlN分子分解为单质铝和氮气,失重原因是氮气的缺失(实际失重为13.9%,理论计算失重为13.6%)。可以看出两步的理论失重率与实验失重率相近。从初始温度升温到末端温度,样品总失重率大约为74.1%,与理论计算值73.7%基本上是一致的(理论计算值来自于假设可以从一分子DMEAA样品中移除一分子DMEA和3个氢原子)。进一步,对DMEAA热重分析后的剩余物进行计算与分析。根据热重测试样品总用量计算,残余物比重为25.9%(理论计算值为26.3%)。由以上分析及计算结果可知,合成出的DMEAA分子中AlH3与DMEA配位比为1:1。此外,还可以得到DMEAA分子不能通过热处理使之失去配位分子DMEA这一结论。因为根据热重分析可知,DMEAA分子分解产生的是AlN分子而不是AlH3分子,说明DMEAA分子中Al-N键的键力要强于Al-H键,这也是本研究用三步法合成AlH3根本原因所在。
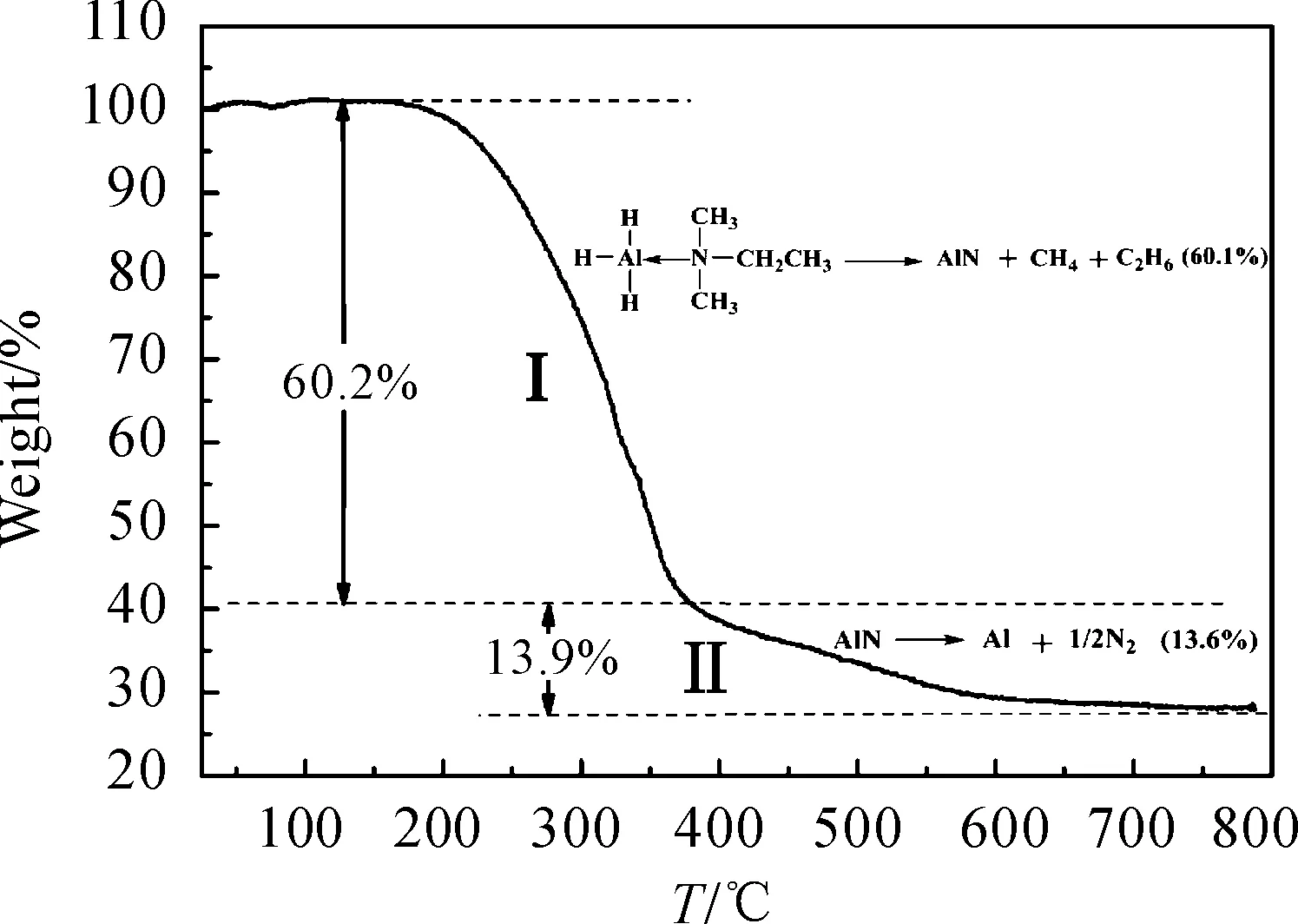
图2 DMEAA样品的失重曲线
2.2 胺转换反应
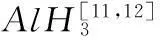
如图3所示,氢化铝胺配合物中包含三个Al-H键,它们的吸收峰通常以单宽峰的形式出现,1 756cm-1处的吸收峰为TEAA中Al-H键的不对称伸缩振动。在这一系列红外光谱图中,标准TEAA(Al-H键的伸缩振动位于1 756cm-1处)的红外光谱,如图3(c)所示。将20mLTEA加入到DMEAA和四氢呋喃的混合液中,搅拌反应一段时间。在刚加入TEA时,红外光谱图并没有变化,如图3(a)所示。在氮气吹扫反应瓶且反应加热到60℃开始发生转胺反应。可以通过位于1 756cm-1的处新的吸收峰的出现来判断形成了产物TEAA,如图3(b)。反应9h后,转胺反应基本完成。转胺反应发生的原因是DMEAA的蒸汽压比TEA或TEAA高。在一定温度下(TEA为气态,而DMEA为液态),DMEA优先从DMEAA中脱除,在DMEA从配合物中脱除的同时TEA取代了DMEA位置,从而发生了胺转换反应生成TEAA。
2.3 真空加热TEAA样品的XRD分析
通过上述胺转换反应得到中间产物TEAA,再经过真空加热TEAA,脱除配合物中的胺,就可能得到目标产物非溶剂化AlH3。实验过程中加入少量的LiAlH4是为了促进TEAA发生脱溶剂化反应。真空加热TEAA样品之后的XRD图谱如图4所示。将其与粉末衍射图库中α-AlH3和γ-AlH3标准图谱进行比较,发现α-AlH3和γ-AlH3分别与对应的标准图(PDF卡片号23-076和38-0757)标峰位一致。此实验结果表明,通过真空加热TEAA可以得到非溶剂AlH3。
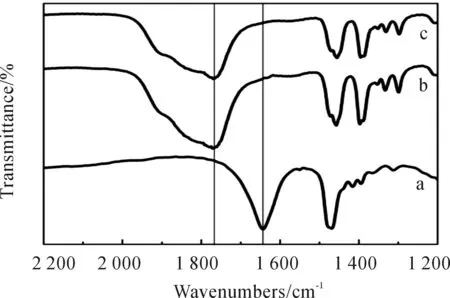
a.胺转换反应发生之前; b.胺转换反应
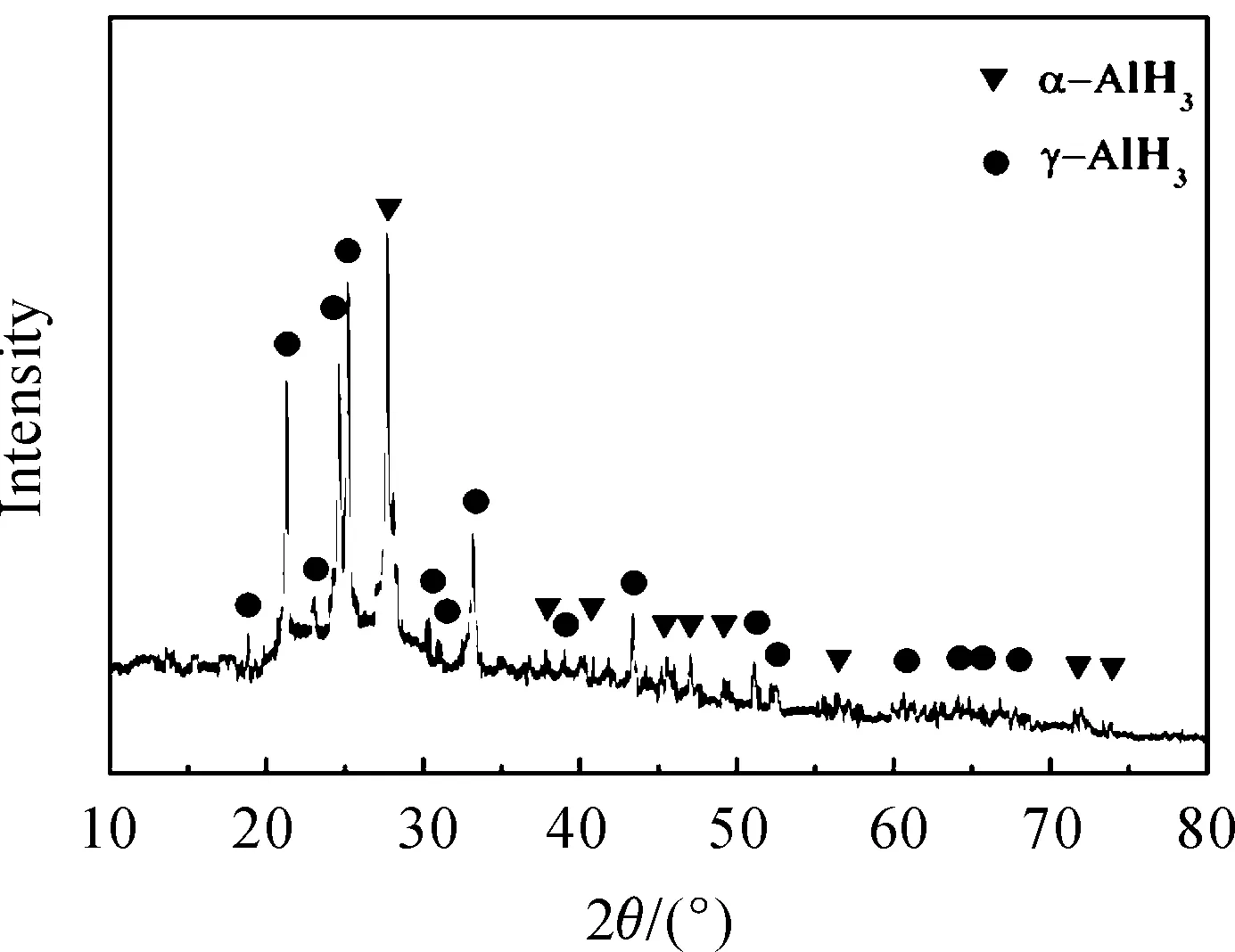
图4 真空加热TEAA样品后产物的XRD谱
3结论
本研究尝试使用LiH和AlCl3反应,采用有机胺转移控制合成出AlH3,设计出一种制备非溶剂AlH3的新方法,并用IR、XRD和TG证明了反应路线的可行性。使用廉价原料LiH代替传统原料LiAlH4,较大地降低制备AlH3的成本,为AlH3的实际生产提供了参考。
参考文献:
[1]唐安江,史永永,潘红艳,等.新型储氢材料三氢化铝的研究进展[J].无机盐工业,2012,43(12):5-8.
[2]刘明星,何金选,曹一林.三氢化铝的合成及性能研究[J].固体火箭技术,2008,31(6): 75-78.
[3]BrowerFM,MatzekNE,ReiglerPF,etal.Preparationandpropertiesofaluminumhydride[J].JournaloftheAmericanChemicalSociety,1976,98(9): 2450-2454.
[4]HumphriesTD,MunroeKT,DeWinterTM,etal.NMRspectroscopicandthermodynamicstudiesoftheetherateandtheα,α′andγphasesofAlH3[J].International Journal of Hydrogen Energy,2013,38(11): 4577-4586.
[5]SandrockG,ReillyJ,GraetzJ,etal.Alkalimetalhydridedopingofα-AlH3for enhanced H2desorption kinetics[J].Journal of Alloys and Compounds,2006,421(1): 185-189.
[6]MarlettEM,Park.WS.Dimethylethylamine-alaneandN-methylpyrrolidine-alane.aconvenientsynthesisofalane,ausefulselectivereducingagentinorganicsynthesis[J].TheJournalofOrganicChemistry,1990(9),55: 2968-2969.
[7]FinholtAE,BondAE,SchlesingerHI.Lithiumaluminumhydride,aluminumhydrideandlithiumgalliumhydride,andsomeoftheirapplicationsinorganicandinorganicchemistry[J].JournaloftheAmericanChemicalSociety,1947,69(5): 1199.
[8]BulychevBM,VerbetskiiVN,StorozhenkoPA.“Direct”SynthesisofUnsolvatedAluminumHydrideInvolvingLewisandBronstedAcids[J].RussianJournalofInorganicChemistry,2008,53(7): 1000-1005.
[9]BulychevBM,VerbetskiiVN,SizovAI,etal.Non-solvatedaluminumhydride.Crystallizationfromdiethylether-benzenesolutions[J].RussianChemicalBulletin,InternationalEdition,2007 56,(7): 1305-1312.
[10]FinholtAE,BondJrAC,SchlesingerHI.Lithiumaluminumhydride,aluminumhydrideandlithiumgalliumhydride,andsomeoftheirapplicationsinorganicandinorganicchemistry[J].JournalofAmericanChemicalSociety,1947,69(5): 1199- 1203.
[11]LacinaD,WegrzynJ,ReillyJ,etal.Regenerationofaluminiumhydrideusingdimethylethylamine[J].Energy&EnvironmentalScience,2010,3(8): 1099-1105.
[12]DavidH.Synthesisofaluminumhydrideandtertiaryamineadductsthereof[P].U.S.Patent3642853,1972-2-15.
(责任编辑唐定国)
收稿日期:2015-01-12
作者简介:万剑(1986—),男,硕士研究生,主要从事含能材料研究。
doi:10.11809/scbgxb2015.07.040
中图分类号:TJ55;O621
文献标识码:A
文章编号:1006-0707(2015)07-0157-04
本文引用格式:万剑,赵云鹏,楚合涛,等.有机胺控制AlCl3与LiH合成AlH3的研究[J].四川兵工学报,2015(7):157-159.
Citationformat:WANJian,ZHAOYun-peng,CHUHe-tao,etal.ResearchofAluminumHydrideSynthesis by AlCl3and LiH Under Control of Organic Amine [J].Journal of Sichuan Ordnance,2015(7):157-159.
ResearchofAluminumHydrideSynthesis by AlCl3and
LiHUnderControlofOrganicAmine
WANJian1,2,ZHAOYun-peng1, CHU He-tao2,
ZHUZhao-yang2,3,GAOYue-yue2, YANG Yu-lin2
(1.QiqiharUniversity,Qiqihar161000,China; 2.HarbinInstituteofTechnology,Harbin150000,China;
3.HubeiInstituteofAerospaceChemicalTechnology,Xiangyang441003,China)
Abstract:The dimethylethylaminealane (DMEAA) was synthesized by LiH and AlCl3with the participation of dimethylethylamine (DMEA). Then, through the transamination reaction of DMEAA and triethylamine (TEA), triethylaminealane (TEAA) could be obtained. Finally, well-defined target products AlH3were obtained after vacuum heating. During the meantime, all of the intermediate and target products were characterized by Fourier transform infrared (FT-IR) spectra, powder X-ray diffraction (XRD) and thermogravimetric analysis (TG). The experimental results present that the synthetic route is effective, and the cost of AlH3preparation would be reduced obviously through adopting the economical LiH instead of LiALH4.
Key words:organic amine;N,N-DMEAA;TEAA;transamination reaction;AlH3
【化学工程与材料科学】

