梅山猪与三元杂交猪肉宰后成熟过程品质变化比较
王 娟,张万刚*,刘 念,周光宏,徐幸莲
梅山猪与三元杂交猪肉宰后成熟过程品质变化比较
王 娟,张万刚*,刘 念,周光宏,徐幸莲
(南京农业大学食品科技学院,肉品加工与质量控制教育部重点实验室,食品安全与营养协同创新中心,江苏 南京 210095)
目的:比较梅山猪与三元杂交猪的肉品质以及影响两个猪种持水力的因素,为梅山猪肉质性状的选择提供一定的参考。方法:选取6 头梅山猪和6 头三元杂交猪,在宰后45 min取胴体左侧背最长肌,采用低场核磁共振技术测定肌肉中水分分布情况以及酪蛋白酶原分析法测定钙蛋白酶的活性,在成熟过程中的1、3、7 d测定肌肉的持水力。结果:梅山猪肉色的L*值和a*值与三元杂交猪差异显著(P<0.05)。梅山猪宰后成熟1、3 d的贮藏损失率和宰后1 d的蒸煮损失率显著低于三元杂交猪(P<0.05),说明梅山猪肉具有较高的保水性。梅山猪宰后45 min的pH值显著高于三元杂交猪(P<0.05)。低场核磁共振T2弛豫测定结果表明,梅山猪肉中结合水含量显著高于三元杂交猪,自由水含量显著低于三元杂交猪(P<0.05)。肌肉水分分布的差异在一定程度上解释了两种猪肉的持水力的变化。梅山猪与三元杂交猪肉中的钙蛋白酶活性在成熟第1天差异显著(P<0.05),成熟第3天和第7天差异不显著。结论:钙蛋白酶活性对这两个猪种的保水性影响不大,肌肉的水分分布及宰后45 min、pH值的差异解释了梅山猪具有较高的保水性。
梅山猪;肉色;持水力;pH值;低场核磁;钙蛋白酶活性
三元杂交猪(杜洛克猪×长白猪×大白猪)是我国主要养殖的商品猪,具有价格便宜、胴体瘦肉率高等优点。而随着人们生活水平的提高,人们更加注重肉的口感和安全。因此,我国地方猪种生产的黑猪肉逐渐受到消费者的青睐。梅山猪作为我国的地方猪种,其肉质具有细嫩多汁的优点[1]。而关于梅山猪与三元杂交猪的保水性的差异以及可能影响两猪种的保水性因素的研究还不多。
肉色是消费者直观评定猪肉品质的重要指标,肉色鲜红在一定程度上代表猪肉较新鲜[2]。猪肉的持水力也是影响猪肉品质的重要因素。持水力是指当肌肉受到外力作用时,其保持原有水分的能力[3]。过多的汁液流失不但影响肉的外观、嫩度和经济价值,还会造成大量蛋白质的流失(主要是肌浆蛋白和水溶性蛋白)[4],降低其营养价值。影响猪肉持水力的因素有很多,品种、pH值、蛋白降解等。Jiang等[5]研究表明“梅山猪×长白猪”杂交猪的保水性比国外三元杂交猪(杜洛克猪×长白猪×大白猪)的保水性好。pH值的下降对猪肉持水力的影响也很大。当肌肉pH值下降到主要蛋白质的等电点时(pI 5.4),蛋白质分子之间会发生聚集紧缩,这种聚集紧缩会导致肌纤维的内部空间减小,猪肉的系水力下降[6]。在pH值较低的情况下,部分重链蛋白的变性也会导致肌原纤维晶体结构的收缩,这种收缩力导致胞内水分流向胞外,从而增加了水分的流失。钙蛋白酶是一类高度可调的、依赖于钙离子的蛋白酶水解系统,对宰后肌肉成熟过程中的持水力具有重要作用。μ-钙蛋白酶通过调控关键结构蛋白质的降解而影响猪肉在冷藏成熟过程中的持水力的变化,而这些关键结构蛋白对于维持细胞结构的完整性具有重要的作用。在宰后成熟过程中,这些细胞骨架蛋白(如肌间线蛋白)的降解减少了肌细胞间的收缩,从而减少胞内水分流向胞外,增加了猪肉的保水性[7]。因此,可以通过比较两个猪种μ-钙蛋白酶的活性,为猪肉持水力的变化提供一定的依据。
低场核磁共振技术是通过对肌肉样品中水分弛豫时间的测定,分析样品中水分的存在状态以及不同状态下的水分含量,为肌肉保水性的形成与变化提供理论依据[8]。肌肉中的水分主要以3 种状态存在:结合水、不易流动水和自由水[9]。在宰后成熟过程中,由于细胞结构和pH值的变化,肌肉中的3 种水分分布也会有一定的变化。根据各种水分对肌肉持水力的作用不同,水分分布的变化也会影响猪肉的持水力。
本实验以我国地方猪种梅山猪和国内主要养殖的三元杂交猪(杜洛克猪×长白猪×大白猪)为研究对象,采用低场核磁共振技术和酪蛋白酶原分析法分别比较两个猪种背最长肌的水分分布情况以及钙蛋白酶的活性,在成熟过程中的1、3、7 d测定肌肉的持水力,为梅山猪肉优质性状的选择提供一定的参考。
1 材料与方法
1.1 材料与试剂
分别各选取6 头达到出栏日龄的公梅山猪和公三元杂交猪为研究对象,梅山猪由江苏常州金坛永康农牧科技有限公司提供,三元杂交猪由江苏淮安苏食屠宰场提供。宰后45 min,取下胴体左侧背最长肌并于4 ℃冷库中冷藏。
蒸煮袋 北京华盾塑料有限公司;二喹啉甲酸(bicinchoninic acid,BCA)蛋白检测试剂盒 美国赛默飞世尔科技公司;其他试剂均为分析纯。
1.2 仪器与设备
CR-400型色差仪 日本柯尼卡美能达公司;RSU70T型超低温冰箱 日本日立公司;Test0 735-2型热电偶测温仪 南京科尔仪器设备有限公司;Ultra Turrax T25 BASIS型高速匀浆机 德国IKA公司;Avanti J-E型落地式高速冷冻离心机 美国Beckman Coulter公司;ASC-30电子秤 沈阳朝阳衡器厂;HI8424型便携式pH计 意大利Hanna仪器公司;PQ001型核磁共振成像分析仪 上海纽曼电子科技有限公司;PowerPac1000电泳仪 美国Bio-Rad公司;Image scanner Ⅲ扫描仪 美国GE公司。
1.3 方法
1.3.1 肉色的测定
剔除肉样的表面脂肪并保证表面平整,在室温条件下进行色差仪校正,使用色差仪进行肌肉色泽的测定。每个肉样3 个平行。测定色泽的参数为亮度值L*、红绿值a*和黄蓝值b*。L*值范围在0~100之间,其值越大,表示样品亮度越高;+a*表示红色方向,-a*表示绿色方向;+b*表示黄色方向,-b*表示蓝色方向[2]。
1.3.2 贮藏损失率的测定
参考Zhang等[10]方法,并稍作修改。肌肉宰后排酸24 h后,将剔除结缔组织的肉样均匀地分成3份,用纸巾吸干表面的水分,称量,记作原始质量(M1)。将肉样放入真空包装袋中,在4 ℃冷库内成熟1、3、7 d。在达到不同的成熟时间时,分别将肉样取出,再次用纸巾吸干表面的水分,称量,记作最终质量(M2)。按式(1)计算贮藏损失率。

1.3.3 蒸煮损失率的测定
在肌肉宰后排酸24 h后,剔除肉样表面的脂肪和肌膜,并将其切成2 cm×3 cm×5 cm左右的肉块,擦干表面的水分,称量,置于蒸煮袋内,在72 ℃水浴锅中加热到肉样中心温度为70 ℃(用热电偶记录中心温度变化)并保持稳定,之后用冷水冷却至室温,用吸水纸吸干肉样表面汁液,再次称量。按式(2)计算蒸煮损失率。

1.3.4 pH值的测定
在猪宰后45 min时,取下胴体左侧背最长肌,用便携式pH计测定背最长肌的pH值,用剪刀将肉样剪出小口,将便携式pH计插入背最长肌的内部测定pH值,每个样本3 个平行,每次测定后用双蒸水冲洗pH计头并校准。
1.3.5 低场核磁共振横向弛豫时间(T2)的测定
称取2 g左右立方体的肉样(约1 cm×1 cm×1 cm)放入核磁管中,在核磁共振成像分析仪上进行测定。每个样品3 个平行。测定步骤为:将硬脉冲界面自动调整到中心频率,设置自旋回波序列(Carr-Purcell-Meiboom-Gill,CPMG)参数:90°脉冲和180°脉冲之间的时间为250 μs。重复扫描32次、重复间隔时间6.5 s,得到12 000 个回波串峰点[7]。对测定的数据进行反演,得到不同状态水的相对含量。
1.3.6 钙蛋白酶的提取与活性测定
参考Veiseth等[11]方法,并稍作修改。称取约0.5 g剔除结缔组织的肉样,切碎后,加入3 倍体积预冷后的提取缓冲液(10 mmol/L EDTA,0.05% β-巯基乙醇,100 mmol/L Tris-HCl,pH 8.3),在冰浴条件下进行匀浆。匀浆条件为:15 000 r/min匀浆30 s,10 s/次,中间间隔15 s。然后以16 000×g低温离心30 min。取上清液,用BCA试剂盒测定蛋白质量浓度。按1∶1(V/V)加入样品处理液(20%甘油、0.75% β-巯基乙醇,0.02%溴酚蓝、150 mmol/L Tris-HCl、pH 6.8),使最终质量浓度为4 mg/mL。样品分装后,放于-80 ℃冰箱备用。
钙蛋白酶活性测定采用酪蛋白酶原底物分析法,该方法具有分别检测μ-钙蛋白酶和m-钙蛋白酶的优点。采用4%的浓缩胶(m(丙烯酰胺)∶m(甲叉双丙烯酰胺)=75∶1,125 mmol/L Tris-HCl pH 6.8,0.05 g/100 mL N,N,N’,N’-四甲基二乙胺(N,N,N’,N’-tetramethylethylenediamine,TEMED),0.05 g/100 mL过硫酸铵和12.5%的分离胶(m(丙烯酰胺)∶m(甲叉双丙烯酰胺)=75∶1,375 mmol/L Tris-HCl pH 8.8,0.05 g/100 mL TEMED,0.05 g/100 mL过硫酸铵,2.1 mg/mL酪蛋白)进行活性电泳。上样量为60 μg,每块胶中加入同一个标准样品以消除不同批次电泳的误差。在4 ℃条件下恒压100 V电泳6 h,上样前进行预跑15 min。电泳结束后,将胶放入反应液(50 mmol/L Tris-HCl,1 mL/L β-巯基乙醇,5 mmol/L氯化钙,pH 7.5)中反应3 次,20 min/次,然后反应过夜。最后用考马斯亮蓝R-250染色液染色1 h,脱色,拍照。
1.4 统计分析
使用SPSS 18.0统计软件进行独立性T检验和Pearson相关系数进行相关性分析,显著水平为P<0.05。用Origin 8.0和Microsoft Office 2007进行图表的绘制和相关数据的处理,实验数据以±s表示。
2 结果与分析
2.1 肉色、贮藏损失率、蒸煮损失率和pH值的比较
肌肉的颜色主要取决于肌肉中的色素物质-肌红蛋白的含量和化学状态。肌红蛋白主要以3 种状态存在:紫色的还原型肌红蛋白(Mb)、红色的氧合肌红蛋白(MbO2)及褐色的高铁肌红蛋白(Met-Mb)[12],氧合肌红蛋白的含量越高,肉色越鲜艳。梅山猪和三元杂交猪的肉色比较见表1。与三元杂交猪相比,梅山猪肉具有较低的L*值和较高的a*值(P<0.05),b*值差异不显著(P>0.05)。L*值和a*值一般被认为是评价猪肉颜色的两个主要指标[13]。L*值越大表明肌肉样品越白,a*值越大表明肌肉样品越红。因此,与三元杂交猪相比,梅山猪的猪肉颜色较深且红。Jiang等[14]也指出与国外的猪种相比,我国地方猪种的肉色更深。
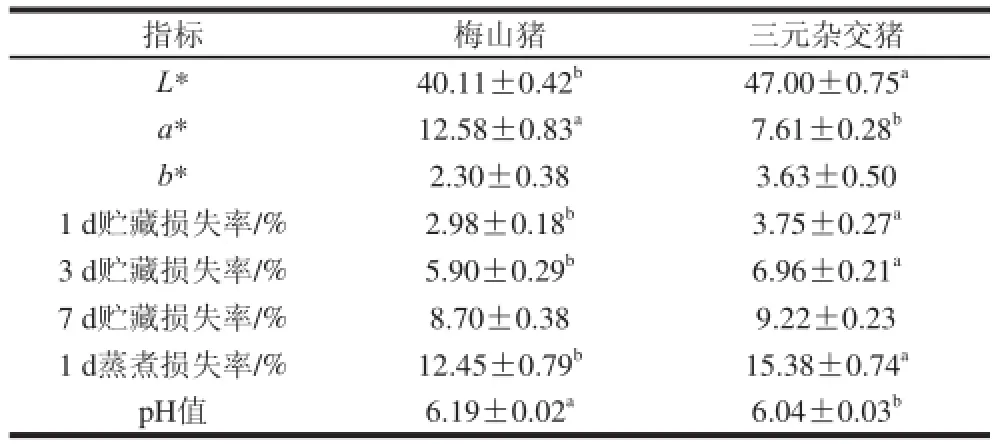
表 1 梅山猪和三元杂交猪的肉色、贮藏损失率、蒸煮损失率和pH值的比较(n=6)Table 1 Comparisons of meat color, purge loss, cooking loss and pH between Meishan and crossbred pork (n = 6)
由表1可知,随着猪肉成熟时间的延长,贮藏损失率呈现增加的趋势。Kristensen等[15]研究表明猪肉成熟过程中,其持水力有下降的趋势,但在成熟7 d后,猪肉的持水力又有上升的趋势,其主要原因可能是细胞骨架蛋白的降解增加猪肉的持水力。对于相同成熟时间,梅山猪在成熟1 d和3 d的贮藏损失率显著低于三元杂交猪(P<0.05),成熟7 d的贮藏损失率差异不显著(P>0.05),这说明梅山猪相对于三元杂交猪在宰后冷藏过程中具有较高的持水力。Suzuki等[16]研究表明中国地方猪种梅山猪的肉样比“长白×杜洛克”二元杂交猪的持水力好。Jiang等[5]也指出梅山杂交猪的滴水损失比其他杂交猪低。
蒸煮损失率是通过加热的方法使水分流失从而反映猪肉的保水性。从表1可以看出,梅山猪宰后24 h的蒸煮损失率显著低于三元杂交猪(P<0.05)。因此,梅山猪肉的保水能力较好,这与贮藏损失率的结果一致。在加热过程中,肌肉中蛋白会发生变性而导致肌纤维的收缩和疏水性区域的暴露,从而形成新的更密集的蛋白质结构,增加了水分的流失[17]。Fernandez等[18]研究表明肌肉中的肌内脂肪含量在一定程度上可以提高肌肉保水性。而梅山猪肉的肌内脂肪含量较高[14],因此对梅山猪肉的保水性具有一定的改善作用。
由表1 可以看出,在宰后45 min时,梅山猪的pH值显著高于三元杂交猪(P<0.05)。pH值对猪肉的持水力的影响很大,其实质是蛋白质分子的静电荷作用[6]。当肌肉中蛋白质所带的正负电荷达到平衡时,会减少蛋白质对水分的吸引从而增加水分的流失。Bee等[19]研究结果表明,在宰后45 min、6 h和24 h,肉样中较高的pH值会导致较少的滴水损失。Huff-Lonergan等[20]报道pH值通过影响钙蛋白酶的活性而影响细胞骨架蛋白的降解,进而影响牛肉的嫩度。Bertram[21]、余小领[22]等都指出猪肉的持水力与宰后早期的pH值呈正相关。对于梅山猪和三元杂交猪而言,梅山猪的pH值显著高于三元杂交猪,这在一定程度上解释了梅山猪肉较高的持水力。
2.2 梅山猪和三元杂交猪肌肉水分分布的比较
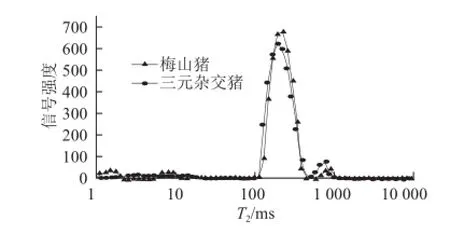
图 1 梅山猪和三元杂交猪低场核磁弛豫时间(T2)的比较Fig.1 T2relaxation time of water between Meishan and crossbred pork
在宰后排酸24 h后,梅山猪和三元杂交猪肉的水分分布情况见图1。拟合后的T2分布弛豫时间呈现3 个峰,其T2值范围分别为:1~10(T2b)、10~100 ms(T21)和100~400 ms(T22)。根据各峰的相对峰面积,确定3 个峰分别为:结合水、不易流动水和自由水[7]。横向弛豫时间的变化反映水分的自由程度,弛豫时间分布的变化反映水分分布的变化,即各种状态下水分的结合状态和自由移动程度。由图1可以看出,梅山猪的不易流动水含量比三元杂交猪含量多,自由水含量少。不易流动水存在于细胞内部,是决定猪肉保水性的关键部分。自由水存在于细胞间隙,在外力作用下很容易失去,因此自由水是潜在的贮藏损失率的水分,较多的自由水含量将导致较多的贮藏损失率[23]。

表 2 梅山猪和三元杂交猪的低场核磁弛豫时间和弛豫相对峰面积的比较Table 2 Comparisons of T2relaxation time and T2peak area fraction of water between Meishan and crossbred pork
由表2可以看出,梅山猪和三元杂交猪的T2b和T21弛豫时间差异不显著,T22弛豫时间差异显著(P<0.05)。梅山猪的T22弛豫时间显著低于三元杂交猪,表明梅山猪的第3个峰(T22)向快弛豫方向移动,自由水的弛豫速率增加,移动性减弱,结合性增强,猪肉的保水性较好。
与三元杂交猪相比,梅山猪的T2b的相对峰面积显著高于三元杂交猪(P<0.0 5),T22的相对峰面积显著低于三元杂交猪(P<0.05),T21的相对峰面积与三元杂交猪差异不显著(P>0.05)。T2b代表的是由肌肉蛋白质亲水电荷基所吸引的水分形成的紧密结合的水层,在外力作用下不易改变其结合状态,因此与猪肉的持水力没有太大关系。T21代表的是存在于肌原纤维及膜之间的不易流动水,容易受蛋白质结构和电荷变化的影响,因此肉的保水性主要取决于肌肉对此类水的保水能力。T22表示的是存在于细胞外间隙中能自由流动的水,仅依靠毛细管作用力而保持,在外力作用下容易流失,三元杂交猪较高的T22相对峰面积是贮藏损失较多的原因之一,这与Offer等[24]提出的“胞外渠道导致滴水损失的形成”理论相一致。Bertram等[23]研究表明T22与滴水损失的相关性为0.77,T21与滴水损失的相关性为-0.72。因此,不易流动水和自由水的水分分布与猪肉的保水性有一定的关系。
同时,pH值也影响着肌肉中T21和T22的含量[25]。有研究认为T22与pH值呈负相关[23],这与本研究梅山猪肉具有较高的pH值和较低的T22含量的结果相一致。pH值影响肌肉水分分布的主要原因是pH值影响肌肉中蛋白质的三维空间结构,这些蛋白的构象通过肌肉空间结构来影响水分的位置和流动性。
2.3 相关性分析
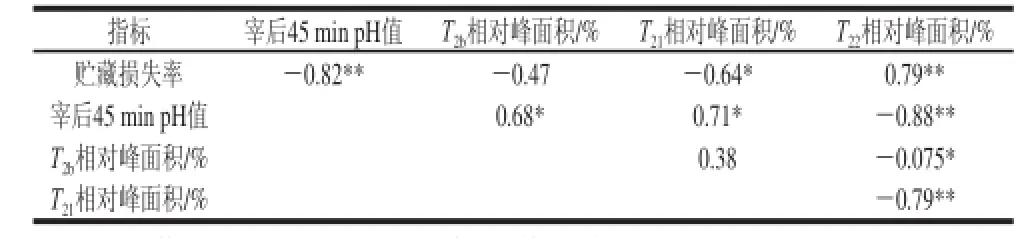
表 3 1 d贮藏损失率与宰后45 min pH值、T2bT21T22峰面积的相关性分析Table 3 Correlation between purge loss and pH at 45 min postmortem as well as the areas of T2b, T21and T22
从表3可以看出,贮藏损失率与宰后45 min的pH值呈负相关且差异极显著(r=-0.82),这说明pH值对猪肉的持水力的影响很大,pH值的差异在很大程度上可以解释猪肉持水力的变化。在低场核磁弛豫时间(T2)的分析中,贮藏损失率与T2b的相对峰面积没有相关性,与T21的相对峰面积呈负相关且差异显著(r=-0.64),与T22的相对峰面积呈正相关且差异显著(r=0.79)。这表明肌肉的水分分布在一定程度上影响着猪肉的持水力,因此可以通过改善肌肉的水分分布来提高猪肉的保水性。宰后45 min的pH值与T2b的相对峰面积和T21的相对峰面积呈显著正相关(r=0.68,r=0.71),与T22的相对峰面积呈负相关且差异极显著(r=-0.88)。这说明pH值对肌肉的水分分布情况具有一定的影响,pH值的变化在一定程度上可以改变肌肉的水分分布。T22相对峰面积与T2b相对峰面积和T21相对峰面积均呈负相关且差异显著(r= -0.75,r=-0.79),这说明肌肉内的水分分布呈现一定的规律性,自由水含量的变化会导致结合水和不易流动水含量的变化。
2.4 钙蛋白酶活性
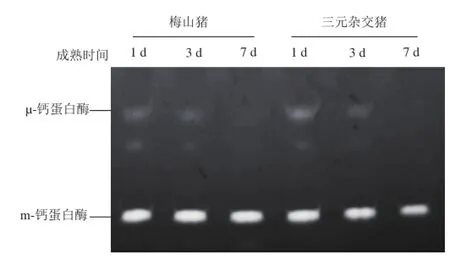
图 2 梅山猪与三元杂交猪成熟1、3、7 d钙蛋白酶活性的比较Fig.2 Comparison of calpain activity at day 1, 3 and 7 postmortem between Meishan and crossbred pork

表 4 梅山猪和三元杂交猪肉不同成熟时间Table 4 Relative optical density analysis ofμ-calpain between Meishan and crossbred pork at different aging times
从图2和表4可以看出,随着成熟时间的延长,梅山猪和三元杂交猪的m-钙蛋白酶几乎没有变化,但是μ-钙蛋白酶的活力逐渐减小。在宰后成熟第1天,梅山猪与三元杂交猪的钙蛋白酶活性差异显著(P<0.05)。在成熟第3天,两个猪种的钙蛋白酶活性差异不显著(P>0.05)。在成熟第7天检测不到活性。这是由于μ-钙蛋白酶的大亚基80 kD在钙离子的作用下降解为76 kD而具有活性,而该蛋白酶在逐渐溶解的过程中也会丧失自身活性[8]。钙蛋白酶之所以对猪肉的持水力具有改善作用,是因为其对肌原纤维的有限降解,而这些肌原纤维蛋白对于维持细胞结构的完整性具有重要作用[25]。Zhang等[10]研究表明:对于“杜洛克×约克夏”猪而言,成熟1 d的猪肉的μ-钙蛋白酶活力与贮藏损失率呈负相关。但是,钙蛋白酶与贮藏损失率的相关性一般是对于同一猪种而言,梅山猪作为我国的地方品种,其与三元杂交猪保水性的差异是由宰后肌肉的水分分布、pH值、肌内脂肪含量和钙蛋白酶等各种因素相互作用的结果。
3 结 论
与三元杂交猪相比,梅山猪肉的颜色较深红,具有较低的贮藏损失率和蒸煮损失率,为梅山猪优质性状的选择提供一定的参考。在宰后45 min时,梅山猪肉的pH
值显著高于三元杂交猪,高pH值减少了肌肉收缩,增加了肌肉的保水性。低场核磁共振技术通过T21和T22相对峰面积的比较可以看出,梅山猪肉具有较高的不易流动水和较低的自由水,使得梅山猪肉在宰后冷藏过程中具有较高的保水性。在宰后成熟第1天,梅山猪肉的钙蛋白酶活性显著低于三元杂交猪,随着成熟时间的延长,两个猪种的μ-钙蛋白酶活性差异不显著。总之,对于这两个猪种而言,钙蛋白酶活性对持水力并不是起到主要作用,肌肉的水分分布和pH值的差异在一定程度上解释了梅山猪肉高持水力的原因。
[1] TOURAILLE C, MONIN G, LEGAULT C. Eating quality of meat from European×Chinese crossbred pigs[J]. Meat Science, 1989, 25(3): 177-186.
[2] QIAO J, WANG N, NGADI M, et al. Prediction of drip-loss, pH, and color for pork using a hyperspectral imaging technique[J]. Meat Science, 2007, 76(1): 1-8.
[3] ZHANG W G, LONERGAN S M, GARDNER M A, et al. Contribution of postmortem changes of integrin, desmin and μ-calpain to variation in water holding capacity of pork[J]. Meat Science, 2006, 74(3): 578-585.
[4] ONIBI G E, SCAIFE J R, MURRAY I, et al. Supplementary α-tocopherol acetate in full-fat rapeseed-based diets for pigs: effect on performance, plasma enzymes and meat drip loss[J]. Journal of the Science of Food and Agriculture, 2000, 80(11): 1617-1624.
[5] JIANG Y, ZHU L, TANG G, et al. Carcass and meat quality traits of four commercial pig crossbreeds in China[J]. Genetics and Molecular Research, 2012, 11(4): 4447-4455.
[6] HUFF-LONERGAN E, LONERGAN S M. Mechanisms of waterholding capacity o f meat: the role of postmortem biochemical and structural changes[J]. Meat Science, 2005, 71(1): 194-204.
[7] KOOHMARAIE M, GEESINK G. Contribution of postmortem muscle biochemistry to the delivery of consis tent meat quality with particular focus on the calpain system[J]. Meat Science, 2006, 74(1): 34-43.
[8] 姜晓文, 韩剑众. 生鲜肉品持水性的核磁共振研究[J]. 食品工业科技, 2009, 30(1): 322-325.
[9] 夏天兰, 刘登勇, 徐幸莲, 等. 低场核磁共振技术在肉与肉制品水分测定及其相关品质特性中的应用[J]. 食品科学, 2011, 32(21): 253-256.
[10] ZHA NG W, LONERGAN S M, GARDNER M A, et al. Contribution of postmortem changes of integrin, desmin and μ-calpain to variation in water holding capacity of pork[J]. Meat Science, 2006, 74(3): 578-585.
[11] VEISETH E, SHACKELFORD S, WHEELER T, et al. Effect of postmortem storage on mu-calpain and m-calpain in ovine skeletal muscle[J]. Journal of Animal Science, 2001, 79(6): 1502-1508.
[12] MANCINI R, HUNT M. Current research in meat color[J]. Meat Science, 2005, 71(1): 100-121.
[13] HOLMER S, MCKEITH R, BOLER D, et al. The effect of pH on shelf-life of pork during aging and simulated retail display[J]. Meat Science, 2009, 82(1): 86-93.
[14] JIANG Y, ZHU L, LI X, et al. Evaluation of the Chinese indigenous pig breed Dahe and crossbred Dawu for growth and carcass chara cteristics, organ weight, meat quality and intramuscular fatty acid and amino acid composition[J]. Animal, 2011, 5(9): 1485-1492.
[15] KRISTENSEN L, PURSLOW P P. The effect of ageing on the water-holding c apacity of pork: role of cytoskeletal proteins[J]. Meat Science, 2001, 58(1): 17-23.
[16] SUZUKI A, KOJIMA N, IKEUCHI Y, et al. Carcass composition and meat quality of Chinese purebred a nd European×Chinese crossbred pigs[J]. Meat Science, 1991, 29(1): 31-41.
[17] STRAADT I K, RAS MUSSEN M, ANDERSEN H J, et al. Aginginduced changes in microstructure and water distribution in fresh and cooked pork in relation to water-holding capacity and cooking loss-a combined confocal laser scanning microscopy (CLSM) and low-field nuclear magnetic resonance relaxation study[J]. Meat Science, 2007, 75(4): 687-695.
[18] FERNANDEZ X, MONIN G, TALMANT A, et al. Influence of intramuscular fat content on the quality of pig meat. 1. Composition of the lipid fraction and sensory characteristics of m. longissimus lumborum[J]. Meat Science, 1999, 53(1): 59-65.
[19] BEE G, ANDER SON A L, LONERGAN S M, et al. Rate and extent of pH decline affect proteolysis of cytoskeletal proteins and waterholding capacity in pork[J]. Meat Science, 2007, 76(2): 359-365.
[20] HUFF-LONERGAN E, ZHANG W, LONERGAN S M. Biochemistry of postmortem muscle: lessons on mechanisms of meat tenderization[J]. Meat Science, 2010, 86(1): 184-195.
[21] BERTRAM H C, SCHÄFER A, ROSENVOLD K, et al. Physical changes of significance for early post mortem water distribution in porcine m. longissimus[J]. Meat Science, 2004, 66(4): 915-924.
[22] 余小领, 李学斌, 陈会. 猪肉色泽和保水性的相关性研究[J]. 食品科学, 2009, 30(23): 44-46.
[23] BERTRAM H C, ANDERSEN H J, KARLSSON A H. Comparative study of low-field NMR relaxation measurements and two traditional methods in the determination of water holdi ng capacity of pork[J]. Meat Science, 2001, 57(2): 125-132.
[24] OFFER G, KNIGHT P. The structural basis of water holding in meat. Part 2: Drip losses, developments in meat science[M]. London: Els evier Applied Science, 1988: 173-243.
[25] PEARCE K L, ROSENVOLD K, ANDERSEN H J, et al. Water distribution and mobility in meat during the conversion of muscle to meat and ageing and the impacts on fresh meat quality attributes: a review[J]. Meat Science, 2011, 89(2): 111-124.
Comparison of Meat Quality between Meishan and Three-Crossbred Pigs during Postmortem Aging
WANG Juan, ZHANG Wangang*, LIU Nian, ZHOU Guanghong, XU Xinglian
(Synergetic Innovation Center of Food Safety and Nutrition, Key Laboratory of Meat Processing and Quality Control, Ministry of Education, College of Food Science and Technology, Nanjing Agricultural University, Nanjing 210095, China)
Objective: To compare the difference in pork quality between Meishan and crossbred pigs, and to examine the possible factors contributing to the water holding capacity of two breeds. Methods: Six Meishan purebred pigs and six crossbred pigs were slaughtered and their left longissimus dorsi muscles were used as samples. Water distribution was measured using lower field-nuclear magnetic resonance (LF-NMR) and calpain activity was determined using casein zymography, purge loss at day 1, 3, and 7 sand cooking loss at day 1 postmortem were measured. Results: Compared with crossbred pork, Meishan pork presented lower L* values and greater a* values (P < 0.05). Purge loss of both Meishan and crossbred pork increased gradually during 1, 3 and 7 d of postmortem storage. Meishan pork presented less purge loss compared to crossbred pork at day 1 and 3 (P < 0.05), and no significant difference was found between two breeds at day 7. Muscles from Meishan pigs exhibited less cooking loss (P < 0.05) at day 1, indicating that Meishan pork has a better water holding capacity compared to crossbred pork. Additionally, samples from Meishan pigs showed significantly higher pH values at 45 min postmortem compared to crossbred samples (P < 0.05). LF-NMR T2relaxation data showed that Meishan pork had significantly bigger area of T2band smaller area of T22(P < 0.05). Finally, Meishan pork indicated significantly greater μ-calpain activity at day 1 postmortem (P < 0.05) but no significant difference at day 3 and 7 was found between the two breeds. Conclusions: Calpain activity has no si gnificant impacts on water holding capacity of the two breeds, whereas water distribution and 45 min pH could explain the higher water holding capacity of Meishan pork.
Meishan pig; meat color; water holding capacity; pH; lower field-nuclear magnetic resonance (LF-NMR); calpain activity
TS251.1
A
1002-6630(2015)08-0254-06
10.7506/spkx1002-6630-201508048
2014-05-26
“十二五”国家科技支撑计划项目(2012BAD28B03)
王娟(1991—),女,硕士研究生,研究方向为肉品质量安全控制。E-mail:wangjuan0322@163.com
*通信作者:张万刚(1977—),男,教授,博士,研究方向为畜产品加工与质量控制。E-mail:wangang.zhang@yahoo.com

