稳恒磁场联合抗肿瘤药物协同杀伤肝癌细胞Hepa1-6
徐玲玲,郭伟,刘颖,张雪青,于俊涛,吴文才,赵铁军
稳恒磁场联合抗肿瘤药物协同杀伤肝癌细胞Hepa1-6
徐玲玲1,郭伟2,刘颖2,张雪青1,于俊涛1,吴文才1,赵铁军1
1 浙江师范大学 化学与生命科学学院,浙江 金华 321004 2 陕西师范大学 生命科学学院,陕西 西安 710119

徐玲玲, 郭伟, 刘颖, 等. 稳恒磁场联合抗肿瘤药物协同杀伤肝癌细胞Hepa1-6. 生物工程学报, 2015, 31(9): 1363–1374.Xu LL, Guo W, Liu Y, et al. Synergistic inhibitory effect of static magnetic field and antitumor drugs on Hepa1-6 cells. Chin J Biotech, 2015, 31(9): 1363–1374.
化学疗法为肿瘤临床治疗的常规方法,存在毒副作用大、抗药性强等缺陷。为了提高药物的利用效率,减少药物引起的毒副作用,将8.8 mT稳恒磁场分别与顺铂、阿霉素联用,经MTT检测发现磁场与药物联用可对肝癌细胞Hepa1-6生长具有协同抑制的效应,经HE染色发现联合处理组细胞发生明显的形态学改变。流式细胞仪检测显示磁场能增加顺铂对G2/M期细胞的滞留,而磁场与阿霉素共同作用可将细胞阻止于G1期和G2/M期。经彗星电泳检测表明磁场能够增强药物对DNA的损伤,且原子力显微镜观察发现联合处理组细胞膜表面出现较大且较深的孔洞,表面结构破坏严重。实验结果表明,抗肿瘤药物与磁场联用技术可有效抑制肿瘤细胞的生长,减少药物的使用浓度,为将抗肿瘤药物与磁场应用于临床治疗恶性肿瘤提供了一个全新的思路与策略。
稳恒磁场,顺铂,阿霉素,协同杀伤
肿瘤是机体局部组织的细胞在各种致瘤因素作用下异常增生而形成的赘生物,恶性肿瘤除了细胞失控性的增殖外,还伴有浸润性的生长 (即扩散转移),严重危及到人类的生命与健康。因此,恶性肿瘤是危及人类生命与健康的严重疾病之一。肿瘤的内科治疗半个世纪以来取得很多重大进展,是常见肿瘤综合治疗中不可缺少的重要手段,已经和手术治疗、放射治疗并列成为防治肿瘤的三种主要手段之一。化学药物治疗是最原始、也是最基本的内科治疗手段,目前国际上临床常用的抗肿瘤药物已达近百种。
顺铂 (cis-Dichlorodiamineplatinum,HDDP) 和阿霉素 (Doxorubicin hydrochloride,ADM) 作为临床使用的经典抗肿瘤药物,对于卵巢癌、乳腺癌、肺癌、鼻咽癌及食道癌等多种类型肿瘤均能显示疗效,具有较强的广谱抗癌作用[1]。但与其他化疗药物一样,顺铂和阿霉素也面临着肿瘤细胞的耐药性和药物对人体的毒性,即抗癌药物的毒副作用等缺陷。为了克服这些不足,增强药物的治疗效果,提高患者的生存期限,人们尝试着联合多种物理或化学方法共同治疗肿瘤[2]。近年来核磁共振理论的发展与波谱技术的应用,使生物磁学得到进一步发展[3],有学者开始关注磁场结合化学药物在肿瘤治疗中应用的可行性。大量研究资料表明磁场在某些条件下能够影响肿瘤细胞生长[4-6],而抗肿瘤药物联合磁场的方法不仅能有效抑制肿瘤生长,还可以降低化疗药物的使用浓度,但其具体杀伤机制不明。本文将通过顺铂和阿霉素分别与稳恒磁场联合作用,研究对肿瘤细胞杀伤效果,重点探讨磁场与药物联合作用后协同杀伤肿瘤细胞的具体机制,为未来将其应用于临床治疗恶性肿瘤提供理论依据。
1 材料与方法
1.1 材料
肝癌细胞株Hepa1-6 (ATCC,CRL-1830) 购自中国科学院上海生命科学院生物化学与细胞生物学研究所;MTT购自生工生物工程 (上海) 股份有限公司;DNA荧光染料为美国Coulter公司DNA染色试剂盒;顺铂,阿霉素,1%低熔点琼脂糖及EB为美国Sigma公司产品;四季青胎牛血清 (FBS) 为浙江天杭生物科技有限公司产品;其他试剂均为国产分析纯。本实验所用磁场处理系统 (图1) 由直流稳压电源 (GWL-305-2,上海新神电子仪器厂)、数字高斯计 (HT20,上海亨通磁电)、长直螺线管 (自制) 和控温装置组成[7]。其中,螺线管直径78 mm,匝数2 000,工作电流2 A,高斯计 (HT20,亨通磁电,上海,中国) 测定磁通密度的值为 (8.800±0.106) mT。培养箱中的温度通过加热器和热控制器调控,以保持恒温箱温度恒定在 (36.5±0.5) ℃。
1.2 方法
1.2.1 细胞培养
Hepa1-6细胞培养于DMEM+10%胎牛血清和双抗 (青霉素100 IU/mL,链霉素0.1 mg/mL) 的完全培养基中,于37 ℃、5% CO2培养箱及饱和水蒸气条件下常规培养及传代,使用对数期细胞进行实验。
1.2.2 MTT法检测细胞毒性
细胞以1×105cells/mL的细胞密度接种至细胞培养瓶中,随机分为4组:1) 对照组,无SMF处理正常培养的细胞;2) 磁场组,磁场曝磁处理;3) 药物组,不同浓度梯度药物处理;4) 磁场加药物组,磁场加药物共同处理细胞。24 h后,制成细胞悬液接种于96孔板,加入MTT溶液10 μL,置于细胞培养箱中继续培养4 h后,加入100 μL裂解液室温处理15 min,最后在595 nm波长下检测值,检测细胞生长情况,每次实验均重复3次。
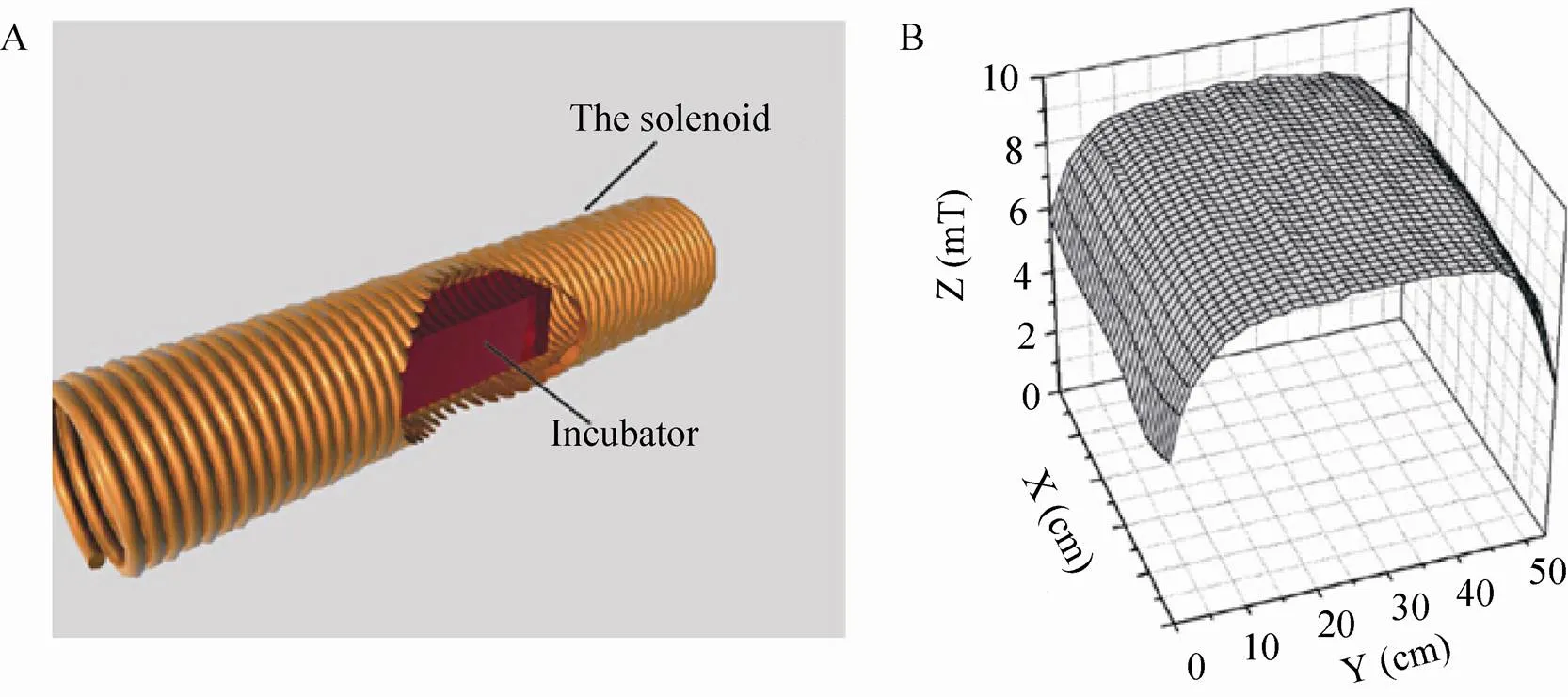
图1 静磁场 (SMF) 系统示意图
1.2.3 细胞周期分析
离心收集细胞 (1 000 r/min、3 min),磷酸盐缓冲液 (Phosphate buffered saline,PBS) 清洗2次后,用60%−70%冷乙醇重悬细胞,保存于4 ℃。测样时离心弃上清 (1 000 r/min、5 min),PBS清洗2次后,调整细胞密度为5×105−1×106cells/mL。加入DNA荧光染料 (美国Coulter公司DNA染色试剂盒),25 ℃避光染色30 min后,流式细胞仪 (美国BD公司) 检测,Mod Fit LT for Mac V3.0软件分析数据。
1.2.4 单细胞凝胶电泳 (Single cell gel electrophoresis,SCGE) 检测DNA损伤
取待测细胞悬液与等量1%低熔点琼脂糖混匀凝固。用裂解缓冲液 (2.5 mol/L NaCl,10 mmol/L Tris,100 mmol/L EDTA,200 mmol/L NaOH,1%肌苷酸钠,临用前加入1% Triton和10% DMSO,pH 10) 裂解细胞60 min。蒸馏水漂洗后,置于电泳液 (1 mmol/L EDTA,300 mmol/L NaOH,pH 13) 中解旋20 min,随后在0.86 V/cm强度下电泳20 min。电泳后,用中和液 (0.4 mol/L Tris-HCl,pH 7.4) 清洗3次,从裂解至中和温度控制在4 ℃下。随后用70%和100%乙醇各脱水5 min,EB (20 µg/mL) 染色15 min,荧光显微镜Eclipse e600 (日本尼康公司) 拍照成像。CASP软件进行数据分析。
1.2.5 原子力显微镜 (Atomic force microscope,AFM) 观察
Hepa1-6细胞接种于爬片,1%戊二醛固定15 min,PBS清洗后晾干。制好的细胞样品固定于AFM (SPM-9500J3,日本岛津公司) 的样品台上 (XY扫描台),扫描速度调整为1.0和1.5 hz之间的接触模式,Si3N4探针 (日本奥林巴斯公司) 在大气环境中用接触模式 (Contact mode) 扫描成像,具体方法参照文献[8]。
1.2.6 统计学分析
2 结果与分析
2.1 MTT法检测稳恒磁场分别与顺铂、阿霉素与联合作用后协同抑制细胞生长
肝癌细胞Hepa1-6经磁场与顺铂处理24 h后,MTT检测发现浓度为1 μg/mL的顺铂以及该浓度顺铂联合磁场后均对细胞有极显著的杀伤 (<0.01)。与单纯顺铂处理相比,磁场联合顺铂作用后极显著地降低了细胞活性 (<0.01) (图2A)。如图2B所示,肝癌细胞Hepa1-6经磁场与阿霉素处理24 h后,MTT检测发现浓度为50 ng/mL的阿霉素以及该浓度阿霉素联合磁场后均对细胞有极显著的杀伤 (<0.01)。与单纯阿霉素处理相比,磁场联合阿霉素作用后极显著地降低了细胞活性 (<0.01)。当浓度为20 ng/mL阿霉素作用细胞24 h后即可对细胞造成明显杀伤 (<0.05),磁场的存在显然促进了这一杀伤效果 (<0.01);同时磁场促进杀伤细胞的作用在两组之间 (即阿霉素与联合作用组之间) 形成显著差异 (<0.05)。实验结果表明,24 h曝磁磁场可促进顺铂或阿霉素对肿瘤细胞的杀伤作用。
2.2 HE染色观察稳恒磁场分别与顺铂、阿霉素联合作用后细胞形态变化
Hepa1-6细胞经磁场与不同抗肿瘤药物联合处理后,HE染色结果见图3。对照组细胞贴壁铺展充分,细胞核轮廊清晰,细胞膜完整,细胞内有多个细胞核;曝磁24 h后镜下可见细胞铺展充分,胞质染色略浅,细胞形态变化不明显;1 µg/mL顺铂处理后细胞界限不明显,胞浆空泡化且浅染,胞核染色变淡;磁场与1 µg/mL顺铂共处理后细胞形态变化明显,由多角形变为长梭形,细胞核浅染,核仁碎裂为多个。20 ng/mL阿霉素处理细胞质浅染,胞核胀大且出现众多较小的核仁;磁场与20 ng/mL阿霉素共处理后细胞内空泡增多,部分胞核深染,核仁碎裂或消失。
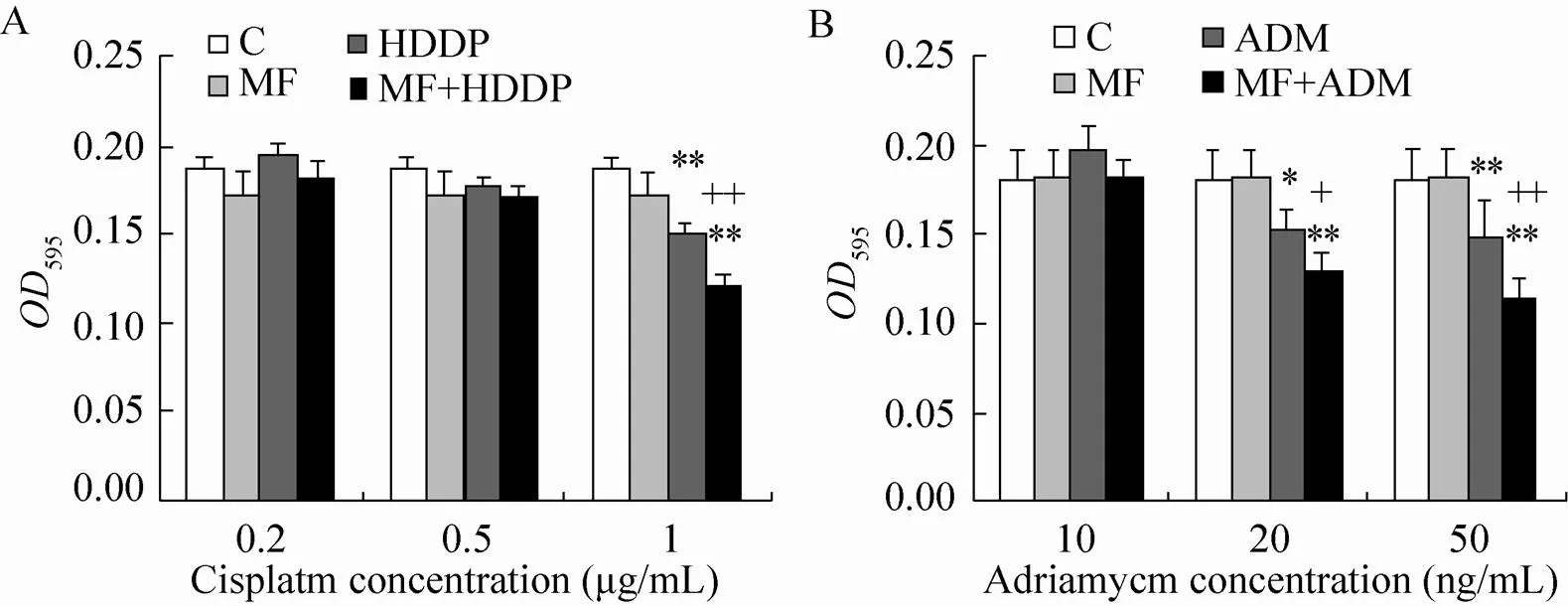
图2 顺铂、阿霉素分别联合磁场处理细胞增殖结果
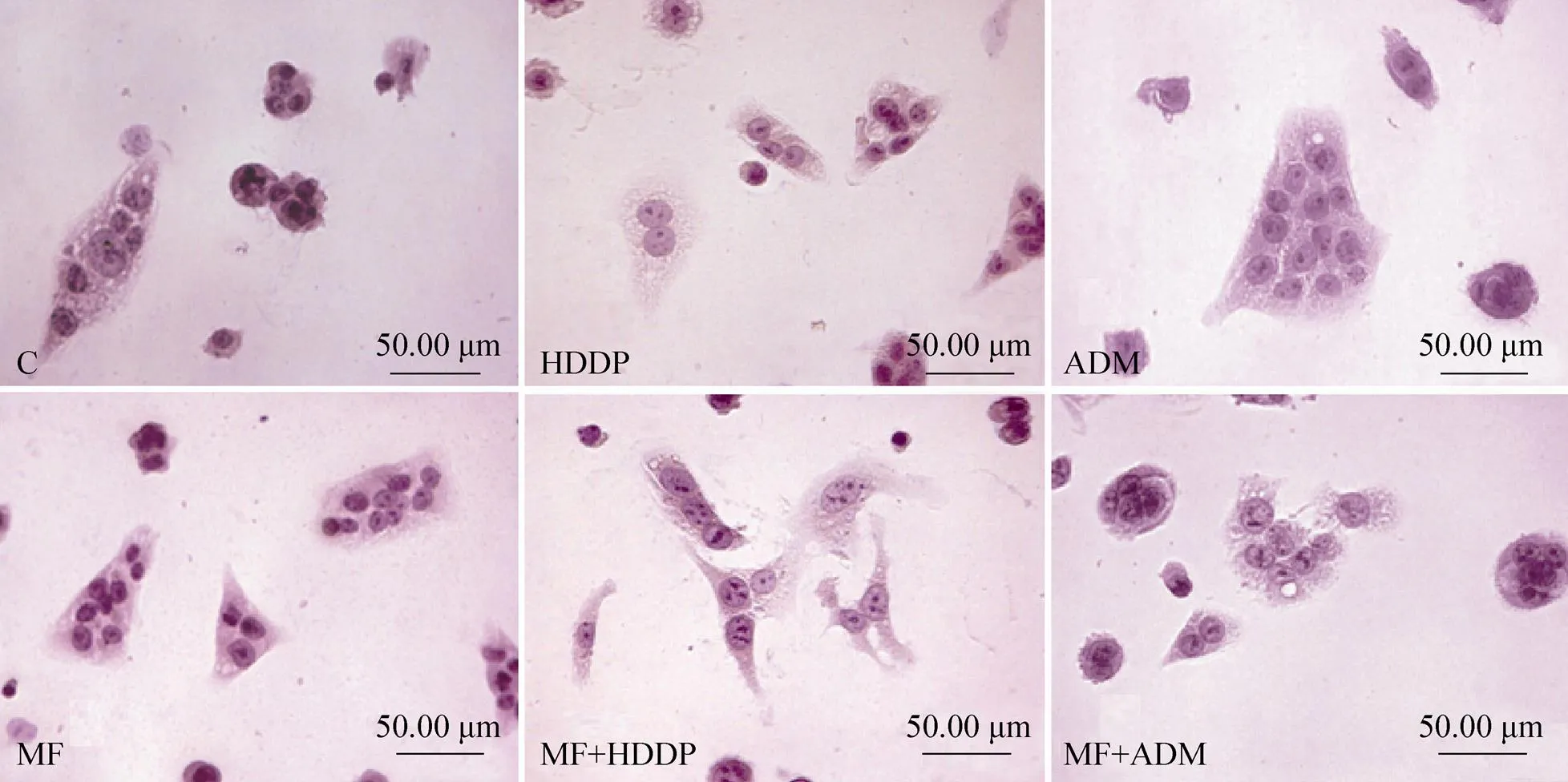
图3 磁场与不同抗肿瘤药物联合处理Hepa1-6细胞后的HE染色图(40×)
2.3 流式细胞仪检测稳恒磁场分别与顺铂、阿霉素联合作用后细胞周期分布
Hepa1-6细胞经磁场与1 µg/mL顺铂处理24 h后,流式细胞仪检测发现 (图4),单纯磁场处理后细胞周期较对照组相比变化不大。而顺铂处理24 h后,S期细胞数量较对照组相比显著增加 (<0.01),而G1期和G2/M期的细胞较对照组显著减少 (<0.01)。其原因是顺铂为细胞周期特异性的药物,能将细胞阻滞于S期[9]。磁场结合1 µg/mL顺铂处理细胞24 h后,流式结果显示细胞主要滞留于S期 (<0.01),而G1期细胞比例继续减少,为各组中细胞比例最少 (<0.01);联合组与单纯顺铂组相比G2/M期细胞数相比升高明显 (<0.01)。实验结果显示,磁场能增加顺铂作用后细胞在G2/M期的滞留。
Hepa1-6细胞经磁场与20 ng/mL阿霉素处理后,流式细胞仪检测发现 (图5),单纯曝磁对Hepa1-6细胞周期分布影响不大,而阿霉素作用后G2/M期细胞比例增多 (<0.05),提示阿霉素可将Hepa1-6细胞捕获于G2/M期,这一结果与Mittal等研究结果一致[10]。20 ng/mL阿霉素与磁场共处理细胞后,G1与G2/M期细胞的比例增高,为各处理组中最高,而S期细胞的比例显著降低 (<0.01),为各处理组中最低。联合组与阿霉素组相比G2/M期细胞数略有升高,G1期细胞数升高显著 (<0.01),而S期细胞数降低明显 (<0.01)。实验数据显示,磁场与阿霉素共同作用可将细胞阻止于G1期和G2/M期。
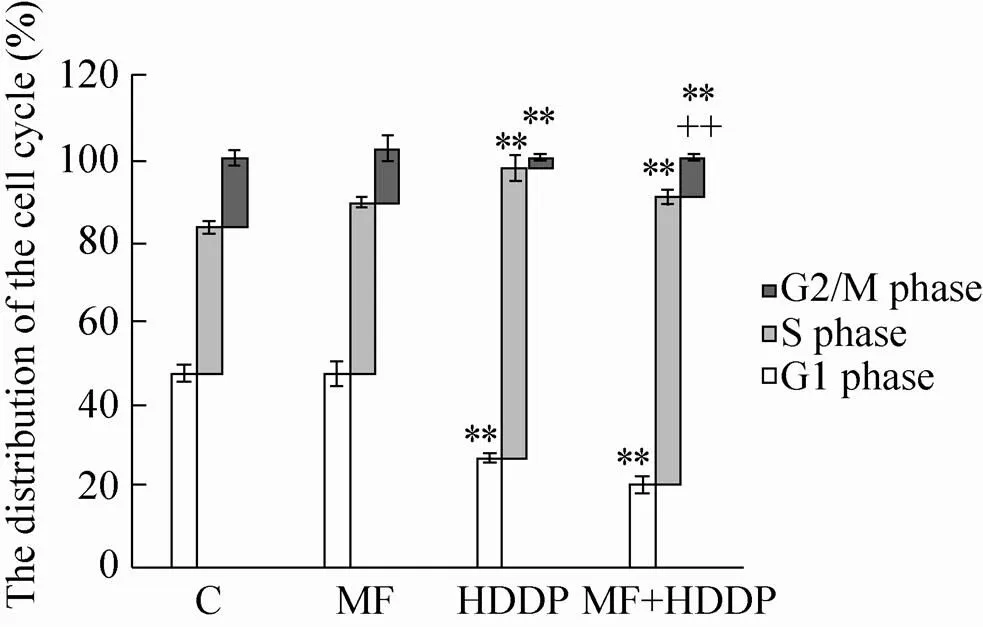
图4 稳恒磁场联合1 µg/mL顺铂处理Hepa1-6细胞后细胞周期的分布

图5 稳恒磁场联合20 ng/mL阿霉素处理Hepa1-6细胞后细胞周期的分布
2.4 SCGE检测稳恒磁场分别与顺铂、阿霉素联合作用后DNA损伤加剧
单细胞凝胶电泳又名彗星电泳 (Comet assay) 是一种测定和研究单个细胞DNA链断裂的微电泳技术。无DNA链断裂的细胞核荧光染色后呈圆形的细胞团,无拖尾现象;有DNA损伤的细胞核在电场作用下断链或碎片向阳极迁移,形成“彗星”样拖尾,损伤越重,断链或碎片越多,彗尾越长。经CASP软件分析后,选用DNA损伤最具有代表性的2个特征指标,尾长 (Tail length) 和尾部DNA含量为DNA损伤参数。图6为Hepa1-6细胞经磁场与顺铂处理后SCGE的检测结果,结果表明单纯磁场处理未对细胞DNA造成损伤 (>0.05);1 µg/mL顺铂可对细胞DNA形成明显损伤 (<0.01);磁场与1 µg/mL顺铂联合处理组与单纯顺铂组相比差异极显著 (<0.01)。表明磁场促进了顺铂对细胞DNA的损伤。
Hepa1-6细胞经磁场与阿霉素处理后,彗星电泳的检测表明单纯磁场处理未对细胞DNA造成损伤 (>0.05);20 ng/mL阿霉素可对细胞DNA形成明显损伤 (<0.01);磁场与20 ng/mL阿霉素联合处理组与单纯阿霉素组相比差异极显著 (<0.01)。表明阿霉素对细胞DNA损伤能力可被磁场促进。
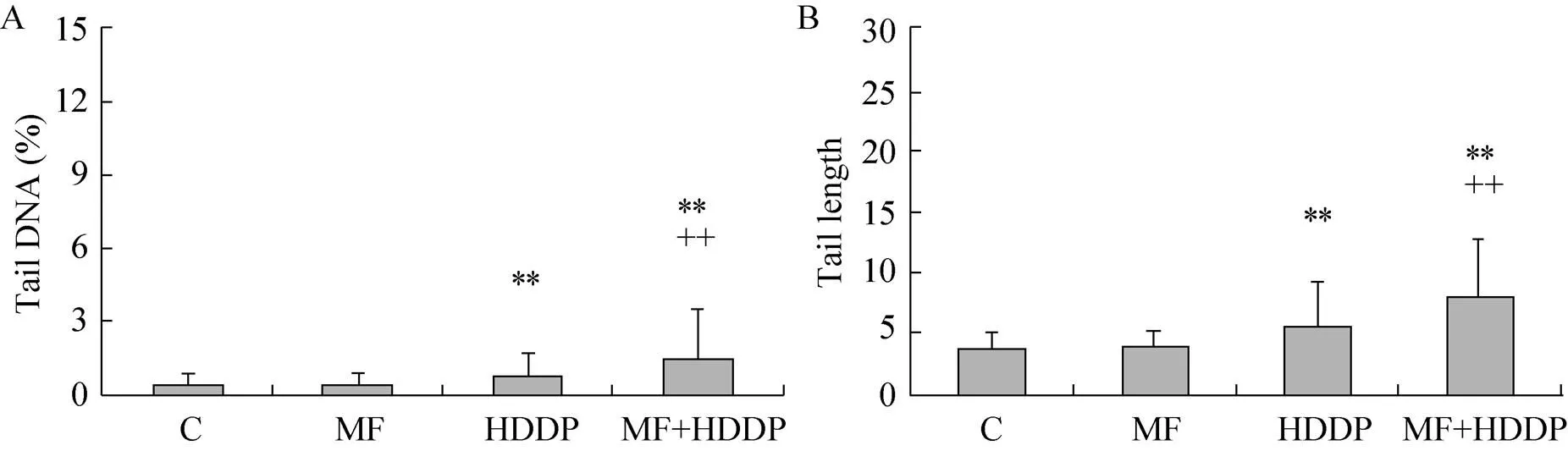
图6 彗星电泳检测Hepa1-6细胞经1 µg/mL顺铂(A)与磁场(B)处理24 h后DNA损伤的结果
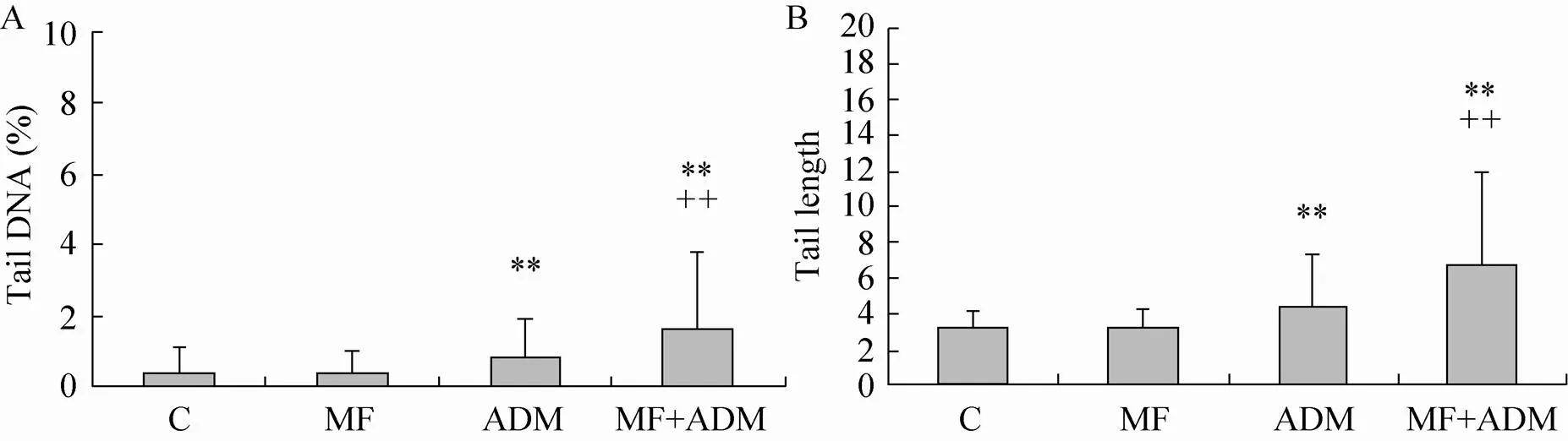
图7 彗星电泳检测Hepa1-6细胞经20 ng/mL阿霉素(A) 与磁场 (B)处理24 h后DNA损伤的结果
2.5 AFM观察稳恒磁场分别与顺铂、阿霉素联合作用后对细胞膜造成的损伤
Hepa1-6细胞经稳恒磁场分别与顺铂、阿霉素处理24 h后,原子力显微镜观察细胞表面形貌后发现,对照组细胞表面较为光滑,有少量较浅的凹陷存在 (图8,C);曝磁24 h后细胞表面更为光滑 (图8,MF)。1 µg/mL顺铂作用细胞后在其表面形成不同尺度的圆形孔洞,孔洞周边可见较为整齐的隆起围绕分布 (图8,HDDP);磁场联合1 µg/mL顺铂在细胞表面形成较大的孔洞,同时细胞表面变得较为粗糙,经放大观察到孔洞周边较为平滑 (图8,MF+HDDP)。20 ng/mL阿霉素可使细胞表面产生较大突起和许多较小的圆形孔洞 (图8,ADM);磁场与20 ng/mL阿霉素共处理后细胞表面粗糙度增加,孔洞样结构变大,表面突起增加 (图8,MF+ADM)。提示磁场可能增强了药物对细胞膜通透性的变化,导致细胞内吞活动增加,使摄入药物量加大,提高了用药效率。
3 讨论
3.1 抗肿瘤药物联合磁场在肿瘤治疗中的运用
恶性肿瘤严重威胁人类健康目前临床上虽然已有数几十种有效的抗肿瘤药物,但是因其疗效的不确定性,加之所存在的不良反应,使癌症患者的治愈情况依旧不容乐观,而且其预后效果不理想[11]。这主要原因在于,在临床使用抗癌药物的过程中发现多种肿瘤细胞能够产生耐药性,而使用大剂量药物,又对正常组织细胞和机体造成损伤,即所谓抗癌药物的毒副作用。因此,研发更加高效的新型抗肿瘤药物治疗方法迫在眉睫。大量研究工作表明磁场或电磁场能直接影响在体肿瘤或离体肿瘤细胞,使瘤体或肿瘤细胞的特性发生改变,生长被抑制[12-14]。如Rosen等报道了GH3细胞在0.5 T稳恒磁场长时间曝磁后,发现细胞生长降低了51%,细胞直径和细胞骨架都发生了明显的变化[15]。抗肿瘤药物联合磁场的方法如能有效抑制肿瘤生长,降低化疗药物的使用浓度,将为肿瘤治疗提供一个新的技术手段,因此已成为生物医学领域的新热点。例如,Sabo等用5-氟尿嘧啶、顺铂、阿霉素和长春新碱的混合药物联合稳恒磁场处理HL-60细胞,MTT法检测发现药物联合磁场可对HL-60细胞产生协同杀伤作用,得到磁场可能增强抗肿瘤药物毒性的推测[16]。Ruiz Gómez等研究发现,当抗肿瘤药物 (长春新碱、丝裂霉素C、顺铂) 联合脉冲电磁场同时处理HCA-2/1cch (人腺肿瘤细胞亚系) 细胞时,脉冲电磁场能削弱细胞对药物的耐受性,达到抑制细胞增殖的效果。但是先用药物处理细胞1 h,之后再经磁场处理2 d的实验,没有得到明显的抑制细胞增殖的效果[12]。表明抗肿瘤药物联合磁场对肿瘤细胞的协同杀伤效应不仅受到药物类型影响,还与药物浓度、磁场频率、处理时间有关。
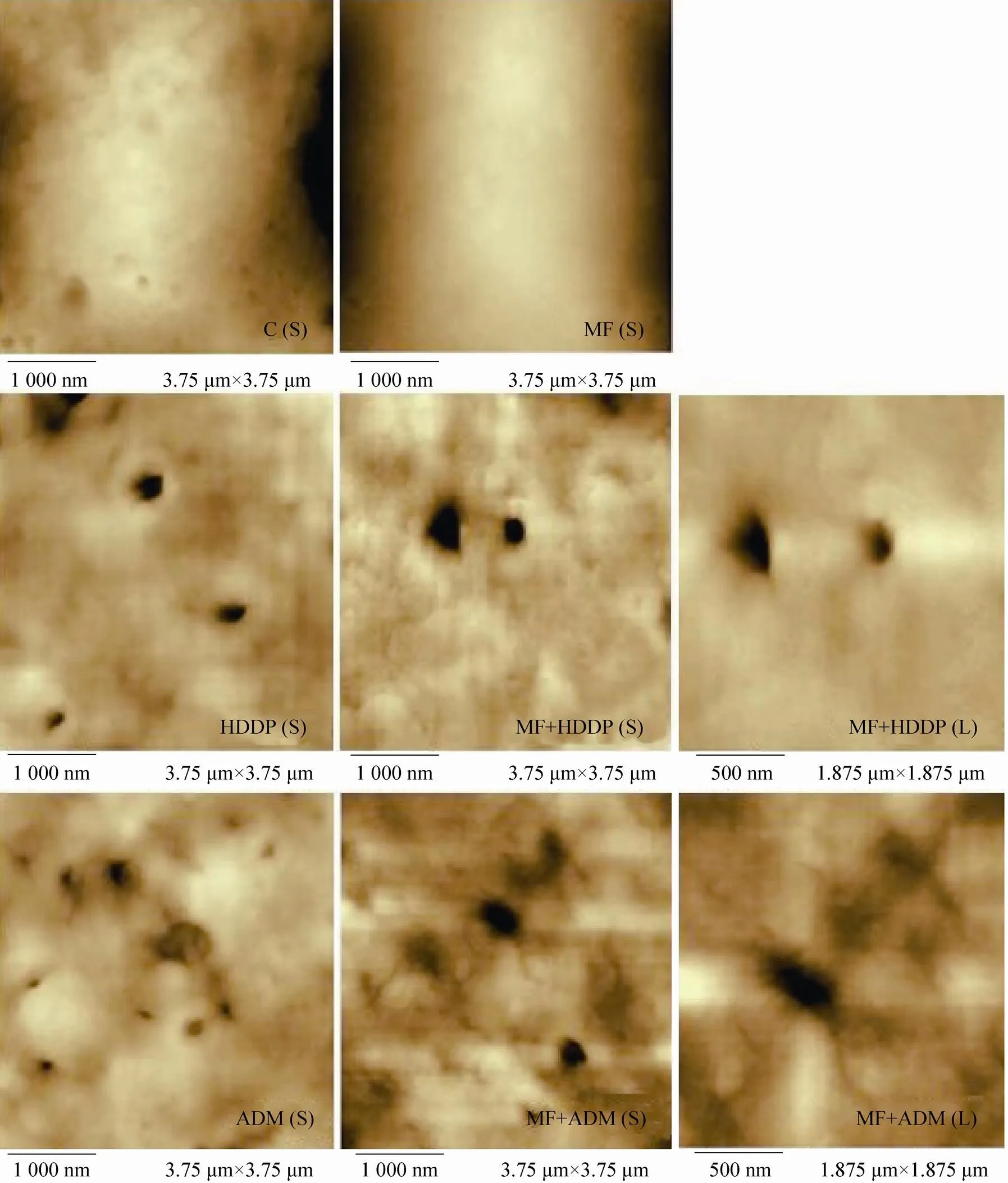
图8 磁场与不同抗肿瘤药物联合处理Hepa1-6细胞AFM观测细胞表面形貌图
3.2 抗肿瘤药物联合磁场协同杀伤机制的探讨
本文证实将抗肿瘤药物与8.8 mT稳恒磁场联合作用的方法不仅能有效抑制肿瘤生长,还可以提高药物的利用效率,减少药物引起的毒副作用。Teodori等研究发现,经6 mT静磁场处理后HL-60白血细胞的活性和凋亡率改变并不明显,但是药物与磁场联用后膜的完整性被加速破坏,凋亡细胞转向二级坏死细胞的速率明显提高[17]。本研究也发现抗肿瘤药物与磁场联合处理组的细胞膜表面出现较大且较深的孔洞,表面结构破坏严重。提示磁场可能增强了药物对细胞膜通透性的变化,提高抗肿瘤药物的内流,使摄入药物量加大,从而提高了用药效率。另外,Miyakoshi等还报道,10 T的静磁场可以诱导DNA损伤,当与X射线联合作用后可导致细胞微核形成率有极显著的增加[18]。我们的SCGE实验表明抗肿瘤药物顺铂、阿霉素分别单独作用时,皆可对细胞DNA造成损伤,但药物与磁场联用后,细胞DNA损伤加剧。流式结果发现磁场与顺铂联用后,与单纯顺铂组相比G2/M期细胞数相比升高明显,而磁场与阿霉素共同作用可将细胞阻止于G1期和G2/M期。众所周知,DNA损伤应答是细胞内一种非常保守的抵御外界及内在因素诱导的DNA损伤的机制,是由多条信号传导通路构成的网络来监测和传递损伤信号,形成应答机制例如细胞周期检验点的激活等[19]。当细胞处于周期进程中时,如果DNA的损伤且无法迅速修复时,会启动细胞周期检测点使周期进程暂停,以便使细胞有充足的时间来修复损伤[20]。我们的实验表明抗肿瘤药物联合磁场有可能是通过诱导DNA损伤,从而激活细胞周期检验点,例如G2/M期细胞的滞留,以达到抑制肿瘤细胞生长的效果。
3.3 抗肿瘤药物联合磁场应用于肿瘤治疗中的可行性
顺铂是中心以二价铂同两个氯原子和两个氨分子结合的重金属络合物,当它进入细胞后可在细胞内发生水解,氯配体被水分子取代,产生一种带正电荷的物质cis-[Pt(NH3)2(H2O)2]+2,该物质不易穿过细胞膜,因而滞留在细胞内并作用于细胞DNA上的碱基嘌呤(N7),将其取代配位水,形成cis-[Pt(NH3)2]/DNA加合物,使DNA链发生扭曲,从而抑制DNA的复制过程,引发细胞毒反应,最终导致细胞死亡[21]。阿霉素结构中的蒽醌可以嵌合到DNA中,每6个碱基对嵌入2个蒽醌环,从而使得碱基对之间的距离由原来的0.34 nm增至0.68 nm,引起DNA的裂解[22]。顺铂与阿霉素皆是广谱的抗肿瘤药物,对多种肿瘤均有抑制作用且疗效显著,但临床证实顺铂、阿霉素的使用会出现诸如骨髓抑制,肾脏、神经毒性、过敏等多种不良反应。为了提高肿瘤的治愈率,增强疗效,物理因素例如磁场与抗肿瘤药物的结合,可能成为应用于肿瘤临床治疗新的研究热点。
本研究证实离体条件下,顺铂、阿霉素分别与磁场联合作用于Hepa1-6细胞后,可以协同抑制肿瘤细胞的生长。同时也有相关在体实验报告表明,磁场能增强荷瘤动物对抗肿瘤药物的敏感性,提高动物生存期限。Ostrovskaia等发现,低强度电磁场和低浓度阿霉素分别作用小鼠在体Lewis肺癌,对肿瘤的抑制率为40%和35%,两者联用后对肿瘤抑制率可达85%[23]。Donata等发现,587 mT静磁场可以显著抑制荷瘤小鼠肿瘤的血管生成,并且使肿瘤部位微血管的通透性增强。当对小鼠使用紫杉醇进行化疗时,磁场显著地增强了紫杉醇的疗效[24]。因此,我们有理由相信抗肿瘤药物联合磁场的方法将为未来临床肿瘤的治愈提供一个全新的思路与策略。虽然目前已有许多关于抗肿瘤药物与磁场结合后显著抑制肿瘤细胞生长,成功治疗肿瘤动物模型的报道[25-26],但要将其应用于人类肿瘤临床治疗,其具体作用机制还未完全探究清楚,而且应用安全性也有待于进一步的研究与论证。因此,若将抗肿瘤药物联合磁场作为一种新的肿瘤综合治疗手段,还需对药物类型、浓度、磁感应强度、频率、治疗时间以及应用安全性等因素进行深入研究,进一步展开探索,以取得最好效果,其研究结果将有益于提高人类的健康。
[1] Johnstone TC, Park GY, Lippard SJ. Understanding and improving platinum anticancer drugs-phenanthriplatin. Anticancer Res, 2014, 34(1): 471–476.
[2] Mouawad F, Gros A, Rysman B, et al. The antitumor drug F14512 enhances cisplatin and ionizing radiation effects in head and neck squamous carcinoma cell lines. Oral Oncol, 2014, 50(2): 113–119.
[3] Tenuzzo B, Chionna A, Panzarini E, et al.Biological effects of 6 mT static magnetic fields: a comparative study in different cell types. Bioelectromagnetics, 2006, 27(7):560–577.
[4] Ghodbane S, Lahbib A, Sakly M, et al. Bioeffects of static magnetic fields: oxidative stress, genotoxic effects, and cancer studies. Biomed Res Int, 2013, (2013): 602987.
[5] Vergallo C, Piccoli C, Romano A, et al. Magnetostatic field system for uniform cell cultures exposure. PLoS ONE, 2013, 8(8): e72341.
[6] Luciana D, Luigi A. Bioeffects of moderate-intensity static magnetic fields on cell cultures. Micron, 2005, 36: 195–217.
[7] Chen WF, Qi H, Sun RG, et al. Static magnetic fields enhanced the potency of cisplatin on k562 cells. Cancer Biother Radiopharm, 2010, 25(4): 401–408.
[8] Zhuang LN, Qi H, Sun RG, et al. Real time observation on cells in different fixed conditions and living cells in buffer solution by AFM. Acta Biophys Sin, 2005, 21(5): 345–350 (in Chinese).庄乐南, 齐浩, 孙润广. 不同固定条件下细胞与活细胞的原子力显微镜实时观察. 生物物理学报, 2005, 21(5): 345–350.
[9] Fan Y, Wang L, Han X, et al. Rab25 is responsible for phosphoinositide 3-kinase/AKT‑mediated cisplatin resistance in human epithelial ovarian cancer cells. Mol Med Rep, 2014, 11(3): 2173–2178.
[10] Mittal A, Tabasum S, Singh RP. Berberine in combination with doxorubicin suppresses growth of murine melanoma B16F10 cells in culture and xenograft. Phytomedicine, 2014, 21(3): 340–347.
[11] Dini L, Panzarini E. The influence of a 6 mT static magnetic field on apoptotic cell phagocytosis depends on monocyte/macrophage differentiation. Exp Biol Med (Maywood), 2010, 235(12): 1432–1441.
[12] Ruiz-Gómez MJ, de la Peña L, Prieto-Barcia MI, et al. Influence of 1 and 25 Hz, 1.5 mT magnetic fields on antitumor drug potency in a human adenocarcinoma cell line. Bioelectromagneties, 2002, 23(8): 578–585.
[13] Sullivan K, Balin AK, Allen RG, et al. Effects of static magnetic fields on the growth of various types of human cells. Bioelectromagnetics, 2011, 32(2): 140–147.
[14] Kroupováa J, Bártová E, Fojt L, et al. Low-frequency magnetic field effect on cytoskeleton and chromatin. Bioelectrochemistry, 2007, 70: 96–100.
[15] Rosen AD, Chastney EE. Effect of long term exposure to 0.5 T static magnetic fields on growth and size of GH3 cells. Bioelectromagnetics, 2009, 30(2): 114–119.
[16] Sabo J, Mirossay L, Horovcak L, et al. Effects of static magnetic field on human leukemic cell line HL-60. Bioelectrochemistry, 2002, 56(1/2): 227–231.
[17] Teodori L, Grabarek J, Smolewski P, et al. Exposure of cells to static magnetic field accelerates loss of integrity of plasma membrane during apoptosis. Cytometry, 2002, 49(3): 113–118.
[18] Miyakoshi J. Biological responses to extremely low-frequency electromagnetic fields. J Dermatol Sci Suppl, 2006, 2(1): 23–30.
[19] Kupfer GM. Fanconi anemia: a signal transduction and DNA repair pathway. Yale J Biol Med, 2013, 86(4): 491–497.
[20] Salvador JM, Brown-Clay JD, Fornace AJ Jr. Gadd45 in stress signaling, cell cycle control, and apoptosis. Adv Exp Med Biol, 2013, 793: 1–19.
[21] Macciò A, Madeddu C. Cisplatin: an old drug with a newfound efficacy-from mechanisms of action to cytotoxicity. Expert Opin Pharmacother, 2013, 14(13): 1839–1857.
[22] Jamieson D, Boddy AV. Pharmacogenetics of genes across the doxorubicin pathway. Expert Opin Drug Metab Toxicol, 2011, 7(10): 1201–1210.
[23] Ostrovskaia LA, Budnik MI, Korman DB, et al. Antitumor effect of joint action of low intensity electromagnetic fields and ultra low doses of doxorubicin. Radiats Biol Radioecol, 2003, 43(3): 351–354.
[24] Donata G, Sven B, Sebastian S. Static magnetic fields increase tumor microvessel leakiness and improve antitumoral efficacy in combination with paclitaxel. Cancer Lett, 2014, 343(1): 107–114.
[25] Saunders R. Static magnetic fields: animal studies. Prog Biophys Mol Biol, 2005, 87(2/3): 225–239.
[26] Barazzuol L, Burnet NG, Jena R, et al. A mathematical model of brain tumour response to radiotherapy and chemotherapy considering radiobiological aspects. J Theor Biol, 2010, 262(3): 553–565.
(本文责编 陈宏宇)
Synergistic inhibitory effect of static magnetic field and antitumor drugs on Hepa1-6 cells
Lingling Xu1, Wei Guo2, Ying Liu2, Xueqing Zhang1, Juntao Yu1, Wencai Wu1, and Tiejun Zhao1
1 College of Chemistry and Life Sciences, Zhejiang Normal University, Jinhua 321004, Zhejiang, China 2 College of Life Science, Shaanxi Normal University, Xi’an 710119, Shaanxi, China
Chemotherapy as a routine method for clinical treatment of cancer has disadvantages such as significant toxicity and strong resistance. In order to improve the efficacy of the drugs and reduce the by-effects, we tried to combine static magnetic field (SMF) with cisplatin or adriamycin. The growth of Hepa1-6 cells treated with the static magnetic field (SMF) combined with cisplatin or adriamycin was significantly inhibited, as detected with MTT (3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-H-tetrazolium bromide) test. Combined treatment group cells underwent significant morphological changes as observed by HE (Hematoxylin and eosin) staining under optical microscope. Cell cycle analysis indicated that SMF increased the ratio of cells arrested in G2/M phase caused by cisplatin, and when treated with SMF combined with adriamycin, cells were almost arrested in G1 and G2/M phase. SCGE test showed that SMF can enhance the ability of cisplatin or adriamycin to promote cell DNA damage. Atomic force microscope observation found that the combination of antitumor drugs and magnetic field treatment induced larger and deeper holes on the cell membrane, and surface structure damage is serious. The combination of antitumor drugs and magnetic field technology effectively inhibits the growth of tumor cells, and reduces drug doses. The results implicate this method as potential cancer therapy.
static magnetic field (SMF), cisplatin, adriamycin, synergistic inhibitory effect
10.13345/j.cjb.140483
October 14, 2014; Accepted:December 10, 2014
National Natural Science Foundation of China (Nos. 31470262, 31200128), Science and Technology Plans of Shaanxi Province (No. 2006C234), Open Fund for a Key-key “bilolgy” Discipline of Zhejiang Province (No. KFJJ2014003).
Lingling Xu. Tel: +86-579-82291410; E-mail: xll0518@zjnu.cn
国家自然科学基金 (Nos. 31470262, 31200128),陕西省科技计划 (No. 2006C234),浙江省“重中之重”学科“生物学”2014年度开放基金 (No. KFJJ2014003) 资助。

