加热洗脱硝酸纤维膜上保存的尿蛋白质
秦伟伟,高友鹤,2
加热洗脱硝酸纤维膜上保存的尿蛋白质
秦伟伟1,高友鹤1,2
1 中国医学科学院基础医学研究所医学分子生物学国家重点实验室,北京 100005 2 北京师范大学生命科学学院生物化学系,北京 100875

秦伟伟, 高友鹤. 加热洗脱硝酸纤维膜上保存的尿蛋白质. 生物工程学报, 2015, 31(9): 1387–1392.Qin WW, Gao YH. Elution of urinary proteins preserved on nitrocellulose membrane with heating. Chin J Biotech, 2015, 31(9): 1387–1392.
用膜保存尿蛋白质对于生物标志物的研发意义重大,从保存尿蛋白质的硝酸纤维膜上洗脱蛋白质的有效性,决定着保存方法被接受的程度和应用的范围。加热洗脱蛋白质的方法,通过提高硝酸纤维膜溶解时的温度等方式;并运用SDS-PAGE和LC-MS/MS分析加热洗脱方法所制备的尿蛋白质样品,将其与强烈涡旋洗脱方法和直接丙酮沉淀方法所制备的尿蛋白质样品比较。结果显示,加热洗脱方法比强烈涡旋洗脱方法获得更多的蛋白质(<0.05),且蛋白质无降解;加热洗脱方法和直接丙酮沉淀方法制备的蛋白质样品,质谱所鉴定到蛋白质重叠率无明显差异(分别是92.6%、96.8%),蛋白质丰度CV值<20%的蛋白质占总蛋白质的比例均很高(分别是85.2%、94.4%)。加热洗脱法具有很好的技术重复性,操作更加高效、简单,有利于用膜保存尿蛋白质方法的推广应用。
尿蛋白质保存,硝酸纤维膜,蛋白质组学,生物样本保存
血液受稳态机制调节,各理化成分保持相对恒定。尿液作为血液滤过排出的废物,包含更多能够反映机体变化的信息。生物标志物的本质是变化,因此尿液是更好的寻找生物标志物的来源[1-3]。目前,据Urinary Protein Biomarker Database所收录的信息[4],尿液中一些能够反映不同疾病状态的候选标志物被报道[5-7]。尿液作为重要的生物样本,如果能将其与临床病历在疾病的每个阶段一同保存下来,那么在未来寻找生物标志物的回顾性和前瞻性研究中,特别是在大规模临床验证实验中,将起到不可估量的作用[8-11]。
传统–80 ℃冻存尿液样本的方法,高能耗且面临蛋白质降解的风险,限制了尿液样本的大规模长期保存。膜保存尿蛋白质:将尿蛋白质吸附在一张薄膜上,干燥后保存在真空袋中[12]。此方法经济、环保、占用存储空间小,干燥保存避免蛋白质降解,从而使系统全面的收集尿液样本成为可能。但是现存的从硝酸纤维膜(Nitrocellulose membrane,NC) 上洗脱蛋白质的方法并不是最优化的,需要强烈涡旋10 min使NC膜完全溶解、在干燥蛋白质沉底时膜易再次形成,这束缚了用膜保存尿蛋白质的应用[13]。本实验旨在通过提高温度来减少强烈涡旋的时间,从而进一步简化蛋白质洗脱方法。
1 材料与方法
1.1 材料
胰蛋白酶购自Promega公司。碘乙酰胺 (Iodoacetamide,IAA)、二硫苏糖醇 (Dithiothreitol,DTT购自Sigma公司。Oasis小柱购自Waters公司。硝酸纤维膜0.22 μm购自Millipore公司。其他试剂均为分析纯级别。
1.2 伦理学声明与尿液采集
收集4位健康受试者(2男2女,24–28岁) 混合尿液样本约200 mL。经中国医学科学院基础医学研究所伦理委员会评审,该研究项目的风险与预期利益的权衡是合理的,获取知情同意的程序符合伦理学原则。此研究通过伦理审查委员会审查 (项目编号:040-2014)。
1.3 硝酸纤维膜保存尿蛋白质及蛋白质的洗脱
硝酸纤维膜保存尿蛋白质操作方法参照文献[12],每张膜保存20 mL尿液。
1.3.1 加热洗脱蛋白质方法
将吸附尿蛋白质的硝酸纤维膜剪碎置于 2 mL离心管中,依次加入1.7 mL丙酮,0.2 mL 0.5% NH4HCO3;溶解:将混合物室温强烈振荡20 s,置于55 ℃干浴器60 min,且每隔20 min停止加热强烈振荡30 s;尿蛋白质沉淀:4 ℃轻摇2 h,12 000 r/min、18 ℃离心15 min,弃上清,室温放置5−10 min,晾干;重溶蛋白质:加入300 μL裂解缓冲液,吹打后超声3 min;12 000 r/min、18 ℃离心15 min,取上清,Bradford法测蛋白质浓度。详细步骤见图1A。
1.3.2 强烈涡旋洗脱蛋白质方法
强烈涡旋洗脱蛋白质方法参照文献[12],详细步骤如图1B所示。
1.4 丙酮沉淀尿蛋白质
丙酮沉淀尿蛋白质方法参照文献[14],20 mL尿液上清,加入60 mL预冷的丙酮,–20 ℃沉淀4 h。Bradford法测蛋白质浓度。
1.5 尿蛋白质酶切与LC-MS/MS分析
取200 μg尿蛋白质,按Wisniewski等[15]方法酶切,酶切后肽段用Oasis小柱除盐。除盐后肽段溶于0.1%甲酸,色谱分离 (Waters UPLC):洗脱时间60 min,色谱柱流速0.3 μL/min,洗脱梯度为5%−28%流动相B (0.1%甲酸+99.9%乙腈+10%水)。反相柱洗脱下的多肽用AB SCIEX Triple-TOF 5600进行质谱扫描。每个样品做两次技术重复。

图1 加热洗脱蛋白质方法和强烈涡旋洗脱蛋白质方法操作流程
1.6 数据分析
所有二级质谱结果用Mascot[16](Matrix Science公司,版本2.4.0) 软件进行数据库检索。所用数据库为Swissprot_human database (数据截止至2013年5月3日)。检索条件:胰酶酶切;允许最多2个漏切位点;固定修饰为半胱氨酸的脲基甲基化;母离子和子离子质量精确度均为0.05 Da。
采用Progenesis (Nonlinear公司,版本4.1) 软件对蛋白进行定量,方法参照文献[17]。选择进行定量的谱峰电荷数为+2、+3、+4;Mascot肽段评分 (Ions score) >30,假阳性率 (FDR) < 1%[18];若蛋白只有一条肽段得到鉴定,即认为该蛋白不具有定量信息。
2 结果
2.1 两种洗脱方法得到的蛋白质的量
加热洗脱蛋白质方法得到的蛋白质的量((374±15.74) μg,=3) 多于强烈涡旋洗脱方法得到的蛋白质的量 ((307±12.59) μg,=3) (<0.05)。
2.2 一维聚丙烯酰胺凝胶电泳(SDS-PAGE)
每个样品取25 μg尿蛋白质进行SDS-PAGE分析 (图2)。用加热洗脱蛋白质方法所制备的尿蛋白质样品,与强烈涡旋洗脱方法和丙酮沉淀所制备的蛋白质样品相比,涵盖了绝大部分相同条带、无明显的蛋白质降解,具有很好的重复性 (图2)。
2.3 质谱鉴定蛋白质重叠率
用加热洗脱蛋白质方法处理3张结合相同尿蛋白质的硝酸纤维膜,共鉴定了530个蛋白质 (分别鉴定到492、498和503个蛋白质),其中461个蛋白质在3个样品中均被鉴定到,蛋白质鉴定的重叠率 (重叠率=共同鉴定出的蛋白质数/平均鉴定出的蛋白质数×100%) 为92.6% (图3A);用丙酮沉淀处理3份相同的尿液,总共鉴定530个蛋白质 (分别鉴定到489、508和512个蛋白质),其中467个蛋白质在3个样品中均被鉴定到,蛋白质鉴定的重叠率为92.8% (图3B)。其中有425个蛋白质在以上两种方法处理的6个相同的样品中均被鉴定到,即两种方法鉴定蛋白质的重叠率为80% (图3C)。
2.4 质谱鉴定蛋白质丰度的变异系数
用加热洗脱蛋白质方法处理3个样品,共同鉴定到461个蛋白质,其丰度CV值的均数是9.2%,且85.2%的蛋白质丰度CV值< 20%;用丙酮沉淀方法处理3个样品,共同鉴定到467个蛋白质的丰度CV值的均数是12.6%,且94.4%的蛋白质丰度CV值<20% (图4)。

图2 三种方法制备尿蛋白质SDS-PAGE图谱
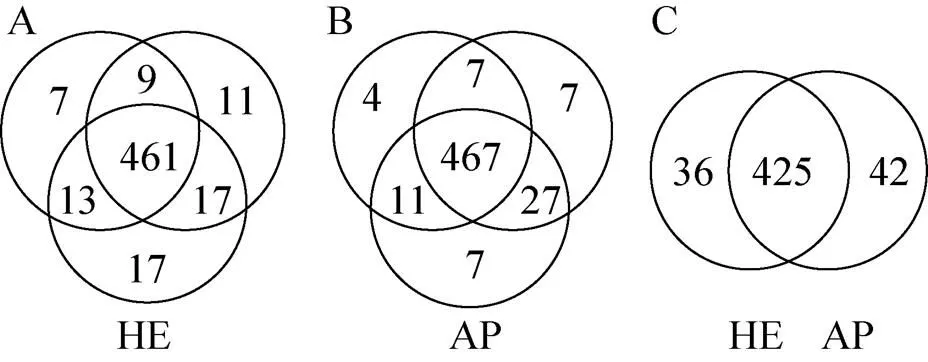
图3 加热洗脱蛋白质方法和丙酮沉淀法鉴定蛋白质重叠率
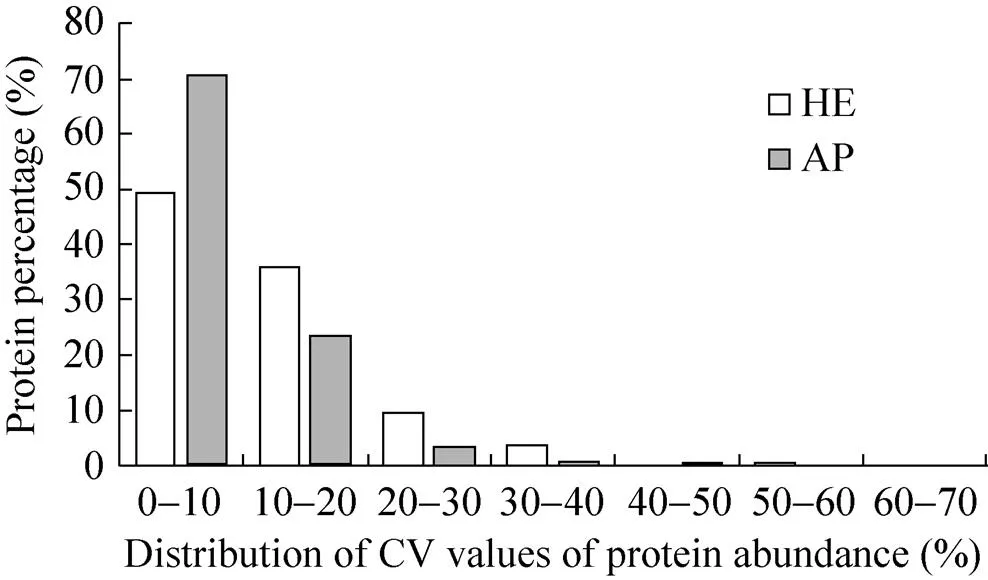
图4 加热洗脱蛋白质法和丙酮沉淀法鉴定蛋白质丰度变异系数分布
3 讨论
尿液作为寻找生物标志物的“金矿”,其保存对于生物标志物的研发意义重大,而膜上蛋白质洗脱的有效性决定着用膜保存方法被接受的程度和应用的范围。加热洗脱蛋白质方法,通过提高NC膜溶解时的温度,从而减少了强烈涡旋的时间、简化了操作过程,而且加热并没有使蛋白质降解 (图2)。尤其在处理多个样品 (≥6) 时,加热洗脱蛋白质方法在60 min可以使20−30个NC膜完全溶解,而强烈涡旋洗脱方法则需要持续强烈涡旋200−300 min (图1)。其次,在蛋白质沉淀时,不同于强烈涡旋洗脱方法将样品4 ℃静置1 h,而是置于旋转混匀仪4 ℃旋转2 h (图1),这有效地防止溶解的NC膜沉淀分层,从而在离心后能够彻底的将蛋白质沉淀分离出来,有效阻止NC膜的再次形成,提高了蛋白质的洗脱效率。
本实验着重就加热洗脱蛋白质方法的技术重复性进行评估,并将其与常用的尿蛋白质提取方法丙酮沉淀法[19-20]作了比较。尿液中蛋白质浓度低,应用丙酮沉淀法直接从尿液中提取蛋白质要消耗大量有机溶剂;膜保存尿蛋白质的洗脱只需少量的有机溶剂。用这两种方法分别处理3个同样的样品,两者质谱鉴定蛋白质的重叠率均很高且无差别。通过对每种方法共同鉴定到的蛋白质定量分析、计算蛋白质丰度的CV值并比较,本研究发现改良后蛋白质洗脱方法稍逊色于丙酮沉淀法,但其自身依旧具有很好的技术重复性,并且比强烈涡旋洗脱方法操作更加简捷,有利于用膜保存尿蛋白质方法的推广应用。
[1] Gao YH. Urine-an untapped goldmine for biomarker discovery? Sci China Life Sci, 2013, 56(12): 1145–1146.
[2] Li ML, Zhao MD, Gao YH. Changes of proteins induced by anticoagulants can be more sensitively detected in urine than in plasma. Sci China Life Sci, 2014, 57(7): 649–656.
[3] Payne SR, Serth J, Schostak M, et al. DNA methylation biomarkers of prostate cancer: confirmation of candidates and evidence urine is the most sensitive body fluid for non-invasive detection. Prostate, 2009, 69(12): 1257–1269.
[4] Shao C, Li ML, Li XD, et al. A tool for biomarker discovery in the urinary proteome: a manually curated human and animal urine protein biomarker database. Mol Cell Proteomics, 2011, 10(11): M111.010975.
[5] Smith ER, Zurakowski D, Saad A, et al. Urinary biomarkers predict brain tumor presence and response to therapy. Clin Cancer Res, 2008, 14(8): 2378–2386.
[6] Kentsis A, Shulman A, Ahmed S, et al. Urine proteomics for discovery of improved diagnostic markers of Kawasaki disease. EMBO Mol Med, 2013, 5(2): 210–220.
[7] Raimondo F, Morosi L, Corbetta S, et al. Differential protein profiling of renal cell carcinoma urinary exosomes. Mol BioSyst, 2013, 9(6): 1220–1233.
[8] Szefler SJ, Wenzel S, Brown R, et al. Asthma outcomes: biomarkers. J Allergy Clin Immunol, 2012, 129(3): S9–S23.
[9] Huang JT, Chaudhuri R, Albarbarawi O, et al. Clinical validity of plasma and urinary desmosine as biomarkers for chronic obstructive pulmonary disease. Thorax, 2012, 67(6): 502–508.
[10] Pejcic M, Stojnev S, Stefanovic V. Urinary proteomics-a tool for biomarker discovery. Renal Failure, 2010, 32(2): 259–268.
[11] Rodriguez-Suarez E, Siwy J, Zurbig P, et al. Urine as a source for clinical proteome analysis: from discovery to clinical application. Biochim Biophys Acta, 2014, 1844(5): 884–898.
[12] Jia LL, Liu XJ, Liu L, et al. Urimem, a membrane that can store urinary proteins simply and economically, makes the large-scale storage of clinical samples possible. Sci China Life Sci, 2014, 57(3): 336–339.
[13] Wang XR, Li XD, Jia LL,et al. Comparison of two urinary protein preparation methods: nitrocellulose membrane preservation and acetone precipitation. Chin J Biotech, 2014, 30(6): 982–989 (in Chinese).王小蓉, 李逊斗, 贾露露, 等. 硝酸纤维膜和丙酮沉淀尿蛋白质保存方法的比较. 生物工程学报, 2014, 30(6): 982–989.
[14] Thongboonkerd V, Mcleish K, Arthur J, et alProteomic analysis of normal human urinary proteins isolated by acetone precipitation or ultracentrifugation. Kidney Int, 2002, 62(4): 1461–1470.
[15] Wisniewski JR, Zougman A, Nagaraj N, et al. Universal sample preparation method for proteome analysis. Nat Methods, 2009, 6(5): 359–363.
[16] Perkins DN, Pappin DJC, Creasy DM, et al. Probaility-based protein identification by searching sequence databases using mass spectrometry data. Electrophoresis, 1999, 20(18): 3551–3567.
[17] Hauck S, Dietter J, Kramer R, et al. Deciphering membrane-associated molecular processes in target tissue of autoimmune uveitis by label-free quantitative mass spectrometry. Mol Cell Proteomics, 2010, 9(10): 2292–2306.
[18] Elias JE, Gygi SP. Target-decoy search strategy for increased confidence in large-scale protein identifications by mass spectrometry. Nat Methods, 2007, 4(3): 207–214.
[19] Thongboonkerd V, Chutipongtanate S, Kanlaya R. Systematic evaluation of sample preparation methods for gel-based human urinary proteomics: quantity, quality, and variability. J Proteome Res, 2006, 5(1): 183–191.
[20] Thongboonkerd V, McLeish KR, Arthur JM, et al. Proteomic analysis of normal human urinary proteins isolated by acetone precipitation or ultracentrifugation. Kidney Int, 2002, 62(4): 1461–1469.
(本文责编 陈宏宇)
Elution of urinary proteins preserved on nitrocellulose membrane with heating
Weiwei Qin1, and Youhe Gao1,2
1 National Key Laboratory of Medical Molecular Biology, Institute of Basic Medical Sciences, Chinese Academy of Medical Sciences,Beijing 100005, China 2 Department of Biochemistry, School of Life Sciences, Beijing Normal University, Beijing 100875, China
The preservation of urinary proteins on a membrane plays a vital role in biomarker research, and the efficient elution of proteins preserved on nitrocellulose membrane (NC membrane) determines the application of this method. During the heating elution procedure, we raised the temperature to reduce the intense vortexing time, and kept gentle rotating while precipitation to prevent nitrocellulose reformation. We also used SDS-PAGE and LC-MS/MS to analyze the urinary proteins prepared by heating elution procedure, intense vortexing elution procedure and acetone precipitation method. There was no degradation of proteins prepared by heating elution procedure. Compared with proteins prepared by heating elution method and acetone precipitation method, the overlapping rates of the proteins was almost the same (92.6% versus 96.8%) and the ratios of CV values (< 20%) of the proteins were both high (85.2% and 94.4%). The heating elution procedure achieved good technical reproducibility, and was much simpler and more efficient than the previous one. It can facilitate the application of the preservation of urinary proteins on membrane.
urinary proteins preservation, nitrocellulose membrane, proteomics, biological samples preservation
10.13345/j.cjb.150039
January 20, 2015; Accepted:March 23, 2015
National Basic Research Program of China (973 Program) (Nos. 2012CB517605, 2013CB530805), 111 Project (No. B08007).
Youhe Gao. Tel: +86-10-69156493; E-mail: gaoyouhe@pumc.edu.cn, gaoyouhe@bnu.edu.cn.
国家重点基础研究发展计划(973计划) (Nos. 2012CB517605, 2013CB530805),111计划 (No. B08007) 资助。
2015-05-06
http://www.cnki.net/kcms/detail/11.1998.Q.20150506.1034.003.html

