凸显主体强化引导
——以苏教版“化学反应的方向”说课为例
胡烨丽 包朝龙
凸显主体强化引导
——以苏教版“化学反应的方向”说课为例
胡烨丽1包朝龙2
(1北仑中学浙江宁波315800;2鄞州中学浙江宁波315101)
通过分析说课的基本功能及一般框架,结合“化学反应的方向”说课案例,展示说课的基本思路和方法,提出说课应凸显学生主体性,强化教师引导性。
说课;主体;引导
2014年10月22~24日,笔者有幸代表浙江省参加了在湖北武汉举行的全国高中化学说课评比并获得一等奖。现将点滴体会整理成稿,与大家交流。
说课是教师在充分备课的基础上,面对其他教师表述一节课的教学理念、课程标准、教法学法、教学流程,并阐明这一设计的科学性和可行性,以实现相互交流、共同提高[1]。本次说课评比的时间要求为10~15分钟,为避免说课内容过繁,笔者对传统的说课框架进行了适当调整,说课的教学流程设计始终围绕学生的疑问展开,凸显学生主体性,强化教师引导性。现将说课案例展示如下。
“化学反应的方向”说课案例
一、说教学思考
1.教材分析
“化学反应的方向”选自苏教版《化学反应原理》[2]专题2第二单元“化学反应的方向和限度”。本专题教学内容包括三个方面:化学反应速率、方向与限度。速率和限度在《化学2》中都有所涉及,至于方向,课标对此提出的要求为[3]:“能用焓变和熵变说明化学反应的方向”。而教材之所以在原有版本上增加了此块内容是出于对知识全面性、完整性及学生学习化学深广度的考虑,毕竟反应方向是反应限度研究的基础,确定了反应的方向后研究该反应的限度才具有现实意义。同时化学反应的方向承接专题一化学反应中的热效应,铺垫本专题下一单元化学平衡的移动,因此本节内容在《化学反应原理》模块中起到了承上启下的作用。
2.学情分析
(1)知识储备:高二学生已有一定的生活经验和化学知识,这些有助于学生对化学反应方向的认识进行概括整合。另外《化学2》和《化学反应原理》中有关化学反应热效应的内容也有助于学生从焓变的角度理解判断反应方向。
(2)学生特点:高二学生已初步具备一定的分析问题与设计方案进行科学探究的能力,能够较为顺利地完成从具体到抽象、从宏观到微观的思维转换过程。
3.教学目标
(1)知识与技能
①知道化学反应存在方向问题,能说出自发反应的含义;
②能说出熵的含义,会定性判断化学反应前后熵的变化情况,理解放热、熵增有利于反应自发进行;
③能初步利用焓变和熵变说明化学反应进行的方向。
(2)过程与方法
①由自然现象通过类比、迁移、归纳、概括等方法学习化学概念,构建新知识;
②通过已有知识及日常生活中的体验,构建化学反应方向的判据。
(3)情感态度与价值观
①通过大量实验和事实,体验熵变的意义,建立生活中自然现象与熵的联系;
②通过从现象分析到理论探究,体会事物的发展变化常受多种因素的制约。
着力突出的是过程与方法中由自然现象通过类比、迁移、归纳、概括等方法学习化学概念,构建化学反应方向的判据。
4.教学重难点
依据课程标准确立的基本要求,确定本节课的教学重点是自发反应与反应方向的判断。
根据教材所呈现的内容和学生学习的思维规律及特点,确定本节课的教学难点是自发反应的概念和对熵变的理解。
5.教法学法分析
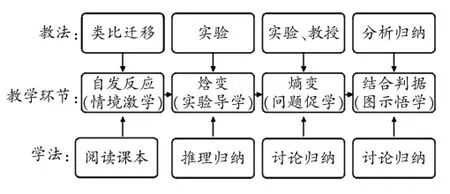
6.教学思路设计
知识线:以“自发反应的判据(即焓变与熵变的影响)”为线索,以“熵增原理”为设计的着力点,研究自发反应的特征。
方法线:以大量事实为概念支架,通过讨论法、概括归纳法、类比迁移法等常用教学方法将新的知识吸纳到原有认知框架中。
情感线:以“21世纪金属”钛的冶炼为疑点,通过课堂首尾呼应,突出化学源于生活,服务于生活。
二、说教学过程
环节一:创设情境,引入课题——化学反应的方向、自发反应
播放视频钛的用途,引出“21世纪金属”钛的冶炼。介绍科学家从发现钛元素到第一次制得纯净的钛经历了一百余年(TiO2(s)+2Cl2(g)=TiCl4(l)+O2(g)TiCl4+2Mg=2MgCl2+Ti)。原因是第一步反应在任何温度下都不发生,而其逆向反应,TiCl4与O2却能在一定温度下反应生成TiO2。通过该工业制钛的例子学生感知到化学反应具有方向性。
接着展示瀑布图片(图1)和水车灌溉图片(图2),通过对比“高水低流”的自发过程及“低水高流”需要外界做功的过程,学生不难体会自发与非自发,并通过结合生活经验列举出自然界中存在的其他自发现象。在此基础上,我引导学生通过类比、迁移等方法共同得出自发反应的概念。此概念中的“外界帮助”对学生而言是一个难点,我启发学生通过对比H2在O2中燃烧生成H2O是一个自发反应,而H2O电解产生H2和O2是一个非自发反应,帮助学生提炼出加热、点燃等条件不属于外界帮助,通电才是外界帮助。另外,结合学生熟悉的光合作用——植物只有借助光照才能将CO2与H2O合成葡萄糖,而葡萄糖在体内的氧化是一个自发反应,学生体会光照也是一种外界帮助。该环节通过生活经验迁移学习新知识,使抽象知识形象化。

图1 瀑布

图2 水车灌溉
环节二:体验活动,探究质疑——焓变对自发过程的影响
了解了自发反应的概念后,继续结合瀑布图片,提问学生水为什么会自发地从高处流向低处?学生自然能想到是能量变化对其自发过程产生了影响。以此为铺垫进入环节二焓变的学习。
通过课本“你知道吗”栏目中的四个反应,学生归纳概括得出这些自发反应的共同特点:ΔH<0反应自发。
该环节采用类比的方法从大自然角度迁移到化学反应角度,通过抽象概括等方法说明放热,反应自发。
这时,学生自然会想:吸热反应就不能自发吗?这给我安排Ba(OH)2·8H2O和NH4Cl反应的实验(图3)提供了契机,通过实验学生发现有些吸热反应也能自发,从而对ΔH<0反应才能自发的结论产生质疑。该环节采用实验教学法例举反例明确焓变仅是判断反应能否自发进行的依据之一,但不是唯一依据。即从特殊到一般进行概括时,要避免归纳的扩大化。

图3Ba(OH)2·8H2O和NH4Cl反应
环节三:师生互动,探究新知——熵变对自发过程的影响
通过实验,学生已经建立起有些吸热反应也能自发的认识,现在学生疑惑的是:什么因素促使吸热反应自发了呢?为解决学生的疑问,我将带领学生进入环节三的学习,也是本堂课第二个难点的学习,将采用四个步骤来突破此难点。
第1步:通过学生阅读课本、观察“房间变乱”“火柴掉地”的图片(图4),引导学生透过表面现象思考这些自发过程的共同之处,学生可以得出它们都是由整齐变得混乱,由有序趋向无序,这时就自然引出量度一个体系混乱度的物理量——熵。此时学生又会产生新的困惑:熵的大小如何衡量呢?我再引导学生同一体系处于有序状态时熵值较小,无序状态时熵值较大。学生自然得出:在孤立体系中,从有序到无序的过程是一个熵增的过程。

图4 房间变乱

图5 火柴掉地
第2步通过硝酸铵溶解、墨水扩散、香水香味扩散的三个小实验(图6)与学生交流互动,帮助学生进一步感知熵增是一种自发现象。

图6 硝酸铵固体溶于水墨水扩散香水香味扩散
第3步结合图片水的三态变化(图7)及碳酸氢钠固体受热分解的反应,引导学生学习熵变的判断方法,通过学生分组交流讨论,教师巡回指导,总结归纳得出以下三个结论:
a.同一物质:S(g)>S(l)>S(s),
b.产生气体和气体物质的量增加的反应:ΔS>0,
c.溶解过程、扩散过程:ΔS>0。
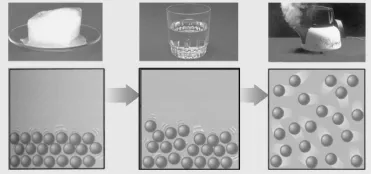
图7 水的三态变化
第4步根据所得结论,请学生判断下列自发反应的熵变情况(如H2CO3(aq)=CO2(g)+H2O(l);2NH4Cl(s)+Ba(OH)2·8H2O(s)=2NH3(g)+BaCl2(s)+10H2O(l);2K(s)+2H2O(l)=2KOH(aq)+H2(g)),使学生对熵变有进一步的理解,同时学生得出结论、汇报结果:ΔS>0反应自发。
总之,此环节从学生已有的生活经验出发,通过小实验创设问题情境,引导学生学习熵变的判断方法。这种层层递进的教学方式既符合学生的认知规律,又使课堂高潮迭起,顺利突破第二难点。
但是针对熵增反应自发的结论,学生马上会产生新的质疑:熵减的反应就不能自发了吗?我借此机会再次组织学生进行分组交流讨论,引导学生举出反例,得出化学反应也能向着熵减的方向自发进行,于是学生发现熵变也不能作为判断反应方向的唯一依据。至此学生自然得出要判断反应进行的方向,必须综合考虑体系的焓变和熵变。由此进入环节四综合判据的学习。
环节四:整合结论,呼应引课——从焓变和熵变的角度综合判断反应能否自发
1.请学生根据所学知识和已有的生活经验,分析以下反应在给定温度下能否自发进行,它们的焓变和熵变是否有利于反应自发。

变化方向ΔHΔS Zn(s)+2HCl(aq)=ZnCl2(aq)+H2(g)6CO2(g)+6H2O(l)→C6H12O6(s)+6O2(g);ΔH>0 NH3(g)+HCl(g)=NH4Cl(s);ΔH<0 CaCO3(s)=CaO(s)+CO2(g);ΔH>0
通过此题目,一方面可以检测学生是否学会了熵变的判断方法,另一方面,学生通过对此题结论的分析,总结得出以下规律:当ΔH<0,ΔS>0即两判据都有利于反应自发时,该反应恒自发。相反,当两判据都不利于反应自发时,该反应恒不自发。这时学生必然想到当判据出现一利一不利时,反应能否自发呢?面对学生的困惑,我引导学生回忆氯化铵受热分解的实验(图8),根据氯化铵在试管底部受热时自动分解产生氨气和氯化氢,而氨气和氯化氢在试管上部遇冷又重新化合形成氯化铵的两个自发反应,学生自然得出反应能否自发与体系的温度有关:对于焓增熵增的反应,高温有利于其自发,对于焓减熵减的反应,低温有利于其自发。
为使上述结论更加直观,可采用如下所示的图形表达法(图9)。
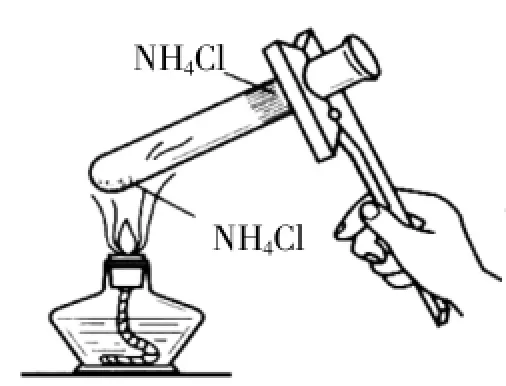
图8 氯化铵受热分解
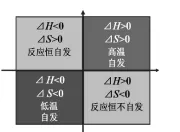
图9 焓变、熵变与自发反应的关系
以上学生从定性的角度学习了综合焓变和熵变来判断反应能否自发,这时可能会有学生提出它们之间是否存在定量的关系。考虑到《浙江省教学指导意见》[4]中对定量关系不作要求,我们鼓励有兴趣的学生在课后查阅资料作进一步探究。
2.学习了综合判据后,回顾本课引课环节——工业冶钛的第一步
TiO2(s)+2Cl2(g)=TiCl4(l)+O2(g)ΔH=161.9 kJ·mol-1ΔS=-38.4 J·mol-1·K-1,学生发现这是一个焓增熵减的恒不自发反应,但是科学家通过结合石墨与氧气的反应(2C(石墨)+O2(g)=2CO(g)Δ H=-110.5 kJ·mol-1ΔS=+89.7 J·mol-1·K-1),使得TiO2生成TiCl4的反应(TiO2(s)+2Cl2(g)+2C(石墨)=TiCl4(l)+2CO(g)Δ H=-59.2 kJ·mol-1Δ S=+141.0 J·mol-1·K-1)成了焓减熵增的恒自发反应,最终制得了钛。通过人类突破钛的冶炼,学生发现化学反应的方向可以帮助科学家设计反应,于是深深体会到化学学科的魅力与价值,感受到人类科技的进步,体会到化学源于生活,服务于生活。
以上是四个环节的教学流程。
最后为激发学生学习兴趣,拓展学生视野,布置课外探究作业二,请学生用“熵”的眼光看世界,查阅资料了解熵所涉及的其他几个领域(图10)。
板书设计
为突出重点,以简洁、清晰为原则,设计板书如下(图11)。

图10 熵涉及的若干领域
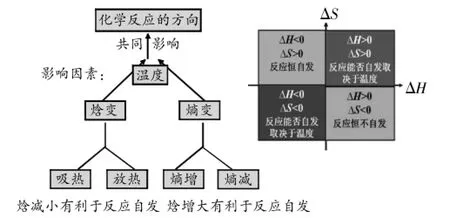
图11 板书
结语:
本次说课以科学归真,艺术求美,人文向善,技术创新的课堂教学理念为指导,在教学设计过程中充分考虑科学、艺术、人文、技术各自的教育功能。期间,在同课多轮的磨练中,笔者更深深地体会到由于课堂教学是一个受多方面条件制约的动态过程,不同的学校和班级有不同的教情和学情,不同的教学内容有不同的形式和特点,因此说课必须以生为本,从实际出发,注重差异性,体现引导的灵活性。
[1]王树志.学科教研组教研模式探究[J].中学化学教学参考,2014,(4):69
[2]王祖浩主编.普通高中课程标准实验教科书化学反应原理(必修)[M].南京:江苏教育出版社,2010:42~46
[3]中华人民共和国教育部.普通高中化学课程标准[M].北京:人民教育出版社,2003:24
[4]浙江省普通高中学科教学指导意见[M].杭州:浙江教育出版社,2012:41
1008-0546(2015)09-0005-04
:G633.8
:B
10.3969/j.issn.1008-0546.2015.09.002

