青蛤Cyclina sinensis)IRAK—4基因的克隆及其组织间的表达分析
青蛤(Cyclinasinensis)IRAK-4基因的克隆及其组织间的表达分析
杨 莹,高 珊,潘宝平*,郑津辉,高 虹
(天津师范大学生命科学学院天津市动植物抗性重点实验室,天津 300387)
摘要利用转录组测序获得了青蛤(Cyclina sinensis)白介素-1受体相关激酶-4(Interleukin-1 receptor-associated kinase 4,IRAK-4)基因的序列信息,利用巢式及荧光定量PCR克隆并分析了CsIRAK-4基因在青蛤各组织中的表达情况,进一步在鳗弧菌的胁迫下检测了CsIRAK-4基因在青蛤血淋巴中的时序表达情况。结果显示,CsIRAK-4基因的序列全长共2 687 bp,其开放阅读框长1 926 bp,共编码641个氨基酸,CsIRAK-4基因在青蛤的血淋巴、肝脏、外套膜、闭壳肌、性腺和鳃中均表达,其中在血淋巴中表达量最高,肝脏中表达量最低。青蛤在鳗弧菌胁迫下该基因的表达量在3 h即达到最大值,与对照组差异极显著(P<0.01),证明该基因所表达的产物是青蛤重要的免疫信号通路蛋白。
关键词青蛤;转录组文库;荧光定量PCR;CsIRAK-4
中图分类号S917
基金项目天津市科委应用基础与前沿技术重点项目(12JCZDJC22800;14JCZDJC34200)。
作者简介杨莹(1992-),女,天津人,硕士研究生,研究方向:分子免疫与分子系统学。*
收稿日期2015-08-05
Cloning and Expression of IRAK-4 inCyclinasinensis
YANG Ying, GAO Shan, PAN Bao-ping*et al(Tianjin Key Laboratory of Animal and Plant Resistance, College of Life Sciences, Tianjin Normal University, Tianjin 300387)
AbstractThe sequence of Interleukin-1 receptor-associated kinase 4 in Cyclina sinensis was obtained by build the transcriptome library, the expression in some organisations from Cyclina sinensis was analyzed by Nested-PCR and RT-PCR, and the expression of CsIRAK-4 in haemolymph after stimulated was studied by vibrio anguillarum. The result showed that the sequence length of CsIRAK-4 are consisted of 2 687 bp, the open reading frame are 1 926 bp and encoding 641 amino acids. The CsIRAK-4 was expressed in haemolymph, liver, coat film, closed shell, gonad and gill, and the expression level of CsIRAK-4 in its haemolymph was the highest and in the liver was the lowest. After stimulated by vibrio anguillarum, the expression level increased obviously and reached to the max at 3 h, and has a very significantly difference with the control group (P<0.01), this resulte proved that the product of the gene expressed was an important immune signaling pathways protein in Cyclina sinensis.
Key wordsCyclinasinensis; Transcriptome library; Real-time quantitative PCR; CsIRAK-4

青蛤(Cyclinasinensis)是我国重要的海产经济贝类,栖息于富于泥沙、泥浆的沿海潮汐地带,广泛分布于东海、黄海、南海等地[1]。青蛤的营养价值丰富,肉质鲜美,且其生长周期短,耐盐性好,存活率高,在离水后可较长时间生存[2-3],对于不良生存环境有较好的抵御能力[4-5]。近年来,青蛤增养殖产业的扩大及养殖环境的恶化,导致青蛤的病害连年发生,使该项产业受到严重威胁[6-8]。因此对于青蛤免疫抗病害研究具有重要的实践意义。
贝类属于非特异性免疫系统,其中Toll样受体(Toll-like receptors,TLRs)是非特异性免疫反应中一类重要的识别受体,在对抗病原物的侵染过程中起着关键作用[9-14]。白介素-1受体相关激酶(Interleukin-1 receptor-associated kinases,IRAKs)是TLRs信号通路中的重要成员之一[9,15]。其中白介素-1受体相关激酶-4(Interleukin-1 receptor-associated kinase 4,IRAK-4)是IRAKs家族中最后发现的一个成员[16-17]。IRAK-4基因与IRAKs家族中其他基因结构相似,但缺少一个C端结构域,且行使功能时需要利用其自身激酶的活性[18-19]。研究表明,IRAK-4基因与细胞免疫过程中T细胞受体的识别过程密切相关[20],这表明,先天免疫系统与适应性免疫系统之间有着错综复杂的联系,而IRAK-4基因在两者之间起着媒介作用。由此可见,IRAK-4基因在机体的免疫过程中至关重要。
目前,IRAK-4基因在脊椎动物中的相关研究较多,而在无脊椎动物中研究极少,仅在长牡蛎(Crassostreagigas)和杂色鲍(Haliotisdiversicolor)中有相关报道。在与青蛤同源性最高的杂色鲍中,IRAK-4基因在各个组织中均表达[9]。目前并未发现IRAK-4基因在青蛤中的相关研究,该研究在提高青蛤免疫能力及探索其抗病害机理方面具有重要的理论意义。
1材料与方法
1.1材料青蛤样品采集于天津大港滩涂,暂养于人工通气海水中,海水密度1.02~1.04 g/cm3,水温21~24 ℃,pH 7.0,投喂5‰小球藻。饲养7 d后,选取表面无破损,形态上无显著差异的个体[平均壳宽(19.12±0.57)mm,平均壳长(29.14±1.23)mm,平均壳高(29.52±1.47)mm)]进行试验。
1.2方法
1.2.1材料处理。将鳗弧菌(Vibrioanguillarum)菌种在2216E培养基中培养24 h,后用无菌海水离心洗脱3次,重悬菌液,将浓度调为OD600=0.4。随机分组,每次试验设置10个平行组。将鳗弧菌菌液注入至试验组青蛤体内,50 μl/只,对照组注射等量的灭菌海水。在注射前提取血淋巴、肝脏、外套膜、鳃、闭壳肌和性腺,分别在注射后3、6、12、24、48、96 h提取血淋巴。准确称取各组织50 mg,后放入液氮中冷冻备用。
1.2.2青蛤转录组文库的构建。利用TRIZOL提取青蛤各个组织的总RNA,用QIAGEN公司的Oligotex mRNA Kits试剂盒分离mRNA。采用第二代MiSeq测序仪,pair end 双端模式完成青蛤转录组测序,利用De novo RNA-seq analysis技术,综合分析相关基因功能注释和代谢途径,后通过筛选得到CsIRAK-4基因的类似序列。
1.2.3生物信息学分析。利用获得的CsIRAK-4基因类似序列设计克隆引物CsIRAK-4-S:5′-AGATGGAGGCAGGGTGAT-3′,CsIRAK-4-A:5′-TGGCAGAGGTGGCGTATT-3′,并进行克隆,与GenBank中的核酸数据库进行BLASTX比对,利用开放阅读框(open reading frame,ORF)在线分析软件分析其开放阅读框,使用Sig-nalP 3.0分析该基因的信号肽序列,利用SMART查找其结构域,ProtParam工具在线预测此序列的分子量、分子式和等电点,使用Clustal W对氨基酸序列进行同源性分析和多重比对。
1.2.4IRAK-4基因在青蛤各组织内的表达。利用TRIZOL法提取青蛤血淋巴、肝脏、外套膜、闭壳肌、鳃和性腺的总RNA,反转成cDNA,-20 ℃保存备用。以β-actin基因为内参基因,实时定量引物分别为βactin-S:5′-CACCACAACTGCCGAGAG-3′,βactin-A:5′-C-CGATAGTGATGACCTGACC-3′;CsIRAK-4-S:5′-AGATGGAGGCAGGGTGAT-3′,CsIRAK-4-A:5′-TGGCAGAGGTGGCGTATT-3′;反应在 Rotor-Gene 6000实时定量 PCR 仪上进行,扩增体系为 20 μl,反应程序:95 ℃预变性30 s,94 ℃变性5 s,56 ℃退火30 s,72 ℃ 延伸 30 s,40 个循环。采用2-ΔΔCT法进行数据处理,采用SPSS软件进行数据分析。
1.2.5在鳗弧菌刺激下青蛤IRAK-4基因在血淋巴内的时序性表达。利用TRIZOL法提取鳗弧菌侵染后各时间点血淋巴的总RNA,反转成cDNA。荧光定量PCR引物、反应体系及程序等参照“1.2.4”。采用2-ΔΔCT法进行数据处理,采用SPSS软件进行数据分析。
2结果与分析
2.1青蛤IRAK-4基因的结构CsIRAK-4基因开放阅读框长1 926 bp,共编码641个氨基酸(图1);其共有2个结构域:DEATH结构域(35~129)和S_Tkc结构域(380~638);其理论分子量为72 552.8,等电点为5.89,分子式为C3206H5069N879O1005S17,氨基酸组成中亮氨酸(Leu)最高,占9.2%。此基因在GenBank的注册号为KR732936。
2.2青蛤IRAK-4基因的分子系统学分析将CsIRAK-4基因与NCBI上已有的其他物种的IRAK-4基因进行同源性比对,使用MEGA4.1软件构建CsIRAK-4基因的系统树(图2),利用bootstrap1000个循环检验拓扑结构的置信度。结果发现,杂色鲍(Haliotisdiversicolor)、红鲍螺(Haliotisrufescens)、霸王莲花青螺(Lottiagigantea)、夏威夷短尾鱿鱼(Euprymnascolopes)与CsIRAK-4基因在同一分支,此基因与红鲍螺(Haliotisrufescens)IRAK-4基因的同源性最高,达57%。
2.3青蛤IRAK-4基因在不同组织间的表达以β-actin基因在各组织中的表达量为内参对照,利用实时荧光定量PCR分析CsIRAK-4基因在其血淋巴、肝脏、外套膜、闭壳肌、性腺和鳃6个组织中的表达情况。结果表明,CsIRAK-4基因在此6个组织中普遍表达(图3),但表达量明显不同,在血淋巴中表达量最高,与其他组织相比差异极显著(P<0.01),闭壳肌次之,肝脏中表达量最低。表明CsIRAK-4基因主要在血淋巴中表达。
2.4在鳗弧菌刺激下青蛤IRAK-4基因在血淋巴中的时序性表达以鳗弧菌侵染青蛤β-actin基因为内参基因,使用实时荧光定量PCR仪对CsIRAK-4基因在血淋巴中表达的时序性变化进行分析(图4)。结果显示,试验组在刺激后3 h的表达量达到最大值,明显高于对照组,约为对照组的17倍,并与对照组存在极显著差异(P<0.01);3 h后表达量开始下降。
3讨论
该研究通过构建青蛤转录组文库的方法获得了CsIRAK-4基因的类似序列,利用此序列设计引物并克隆,后进行测序,通过序列比对发现,该基因在进化中比较保守,与许多水生动物的IRAK-4基因具有明显的相似性。通过SMART分析其蛋白序列,发现CsIRAK-4基因共有2个结构域,分别为死亡结构域(Death Domain)和激酶结构域(S_TKc Domain),死亡结构域位于第35~129个氨基酸之间,激酶结构域位于第380~638个氨基酸之间。死亡结构域作为一种中介将死亡受体和胞浆信号相连通,在控制机体的凋亡过程中有重要作用。在IRAK基因家族中,只有IRAK-1基因、IRAK-4基因具有包含激酶结构域的功能催化位点[21],但只有IRAK-4基因在下游信号转导通路中使用其激酶活性。同时,IRAK-4基因还具有一个高度保守的赖氨酸残基,此残基位于ATP结合位点,在ATP的水解过程中起关键作用[17,22]。IRAKs在TLRs的信号转导过程中起着重要的媒介作用[20,23],因此在先天免疫过程中IRAKs极为关键。
该研究结果显示,CsIRAK-4基因在各个组织普遍表达,在血淋巴中表达量最高,闭壳肌次之,后依次为鳃、外套膜、性腺,在肝脏中表达量最低。贝类所具有的非特异性免疫体系中,血液的吞噬作用往往是抗病害的第一道防线,青蛤血液中含有大量的吞噬细胞、抗菌性物质及酶原物质,在病原物侵染过程中其免疫作用非常关键。血细胞中的CsIRAK-4基因上调最为明显,说明血淋巴作为软体动物的非特异性免疫防御的首要组织担当着机体非特异性免疫防御的重任。而鳃和外套膜在软体动物生存过程中最先接触外界环境,是软体动物抵御外界伤害的第一道防线,因此在其非特异性免疫过程中也极其重要。
CsIRAK-4所表达的产物是TLRs信号通路中重要的信号蛋白之一,当青蛤受到鳗弧菌胁迫后,其血淋巴中该基因在3 h即表达至最大值,说明病原物对TLRs免疫受体及下游 CsIRAK-4信号通路蛋白具有强烈的识别与诱导作用,可使其血液中快速合成相应的免疫信号蛋白,对抗外来胁迫物对机体自身的侵害。并且CsIRAK-4基因的表达量呈先升高后降低的趋势,证明CsIRAK-4基因参与了非特异免疫的全部过程。该试验结果为今后贝类增养殖中的病害防治提供了重要的试验数据。

注:方框为起始密码子,*表示终止密码子,单下划线部分为DEATH结构域,双下划线表示 S_Tkc 结构域。 图1 青蛤IRAK-4 基因 cDNA 序列的开放阅读框及功能域分析
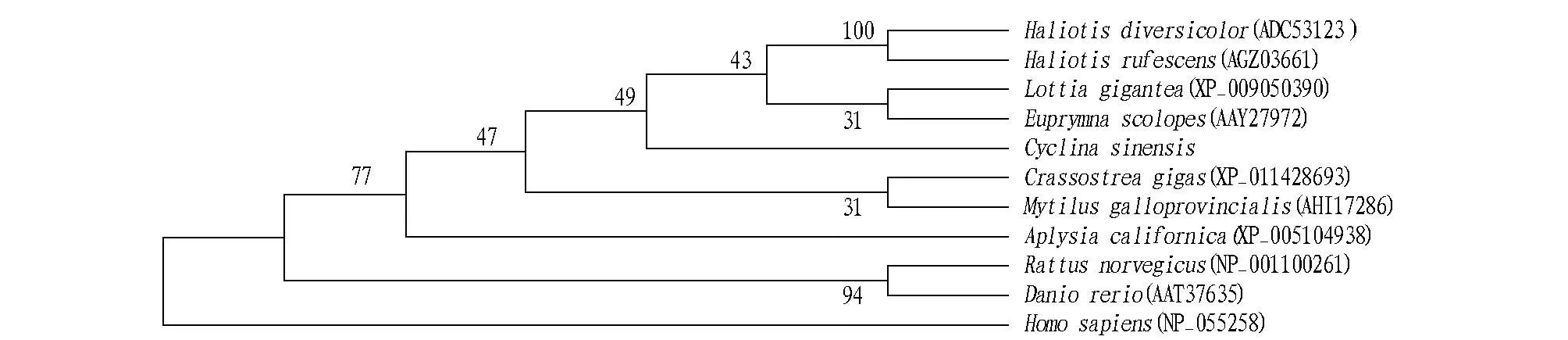
图2 CsIRAK-4基因和其他物种的IRAK-4基因氨基酸序列构建的系统树
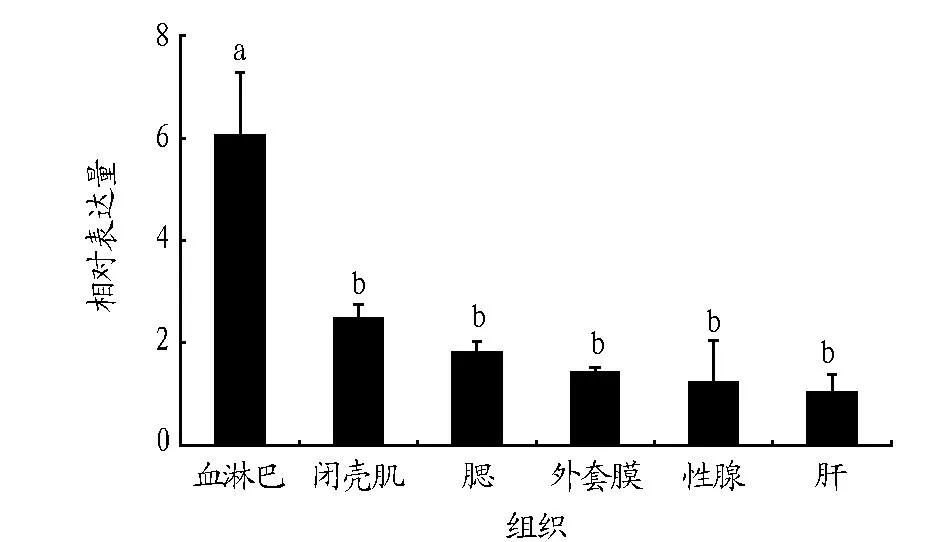
图3 CsIRAK-4基因在青蛤不同组织中的表达分布
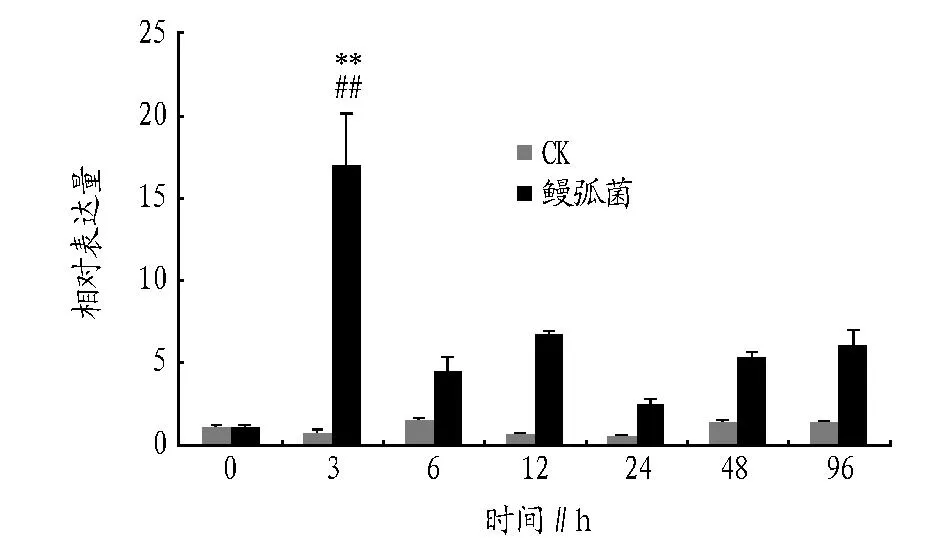
注:##代表该时间点试验组基因的表达量与注射前(0 h)相比差异极显著(P<0.01),**代表相同时间点试验组与对照组基因的表达量差异极显著(P<0.01)。 图4 鳗弧菌刺激下青蛤血淋巴中IRAK-4基因的时序性表达
参考文献
[1] YOON J M.Geographic variations and genetic distance of three geographic cyclina clam(CyclinasinensisGmelin)populations from the Yellow Sea[J].Development and reproduction,2012,16(4):315-320.
[2] 王慧珍.浙江动物志:软体动物[M].杭州:浙江科学技术出版社,1991:243-256.
[3] LIU W,MA Y,HU S,et al.Rearing Venus clam seedsCyclinesinensison a commercial scale[J]. Acquaculture,2002,211(1):109-114.
[4] WANG H Z.Zhejiang fauna[M].Molluscs articles,1991.
[5] WANG R C,WANG Z P,ZHANG J Z.Shellfish aquaculture science[M].Qingdao:Qingdao Ocean University Press,1993:208-209.
[6] 任毅鹏,高晶,潘宝平,等.青蛤(Cyclinasinensis)TLR2 基因的克隆与表达分析[J].海洋与湖沼,2014,45(5):1037-1043.
[7] 孙国铭,万夕和,刘培庭,等.通州海区滩涂青蛤死亡原因的初步分析[J].水产养殖,2004,25(2):26-27.
[8] 曹华.沿海滩涂青蛤死亡原因初探及对策[J].科学养鱼,2004(4):47-48.
[9] GE H,WANG G D,ZHANG L L,et al.Molecular cloning and expression of interleukin-1 receptor-associated kinase 4,an important mediator of Toll-like receptor signal pathway,from small abaloneHaliotisdiversicolor[J].Fish & shellfish immunology,2011,30(4/5):1138-1146.
[10] MEDZHITOV R,PRESTON-HURLBURT P,JANEWAY JR C A.A human homologue of theDrosophilaToll protein signals activation of adaptive immunity[J].Nature,1997,388(6640):394-397.
[11] ZHANG D,ZHANG G,HAYDEN M S,et al.A toll-like receptor that prevents infection by uropathogenic bacteria[J].Science,2004,303(5663):1522-1526.
[12] TAKEUCHI O,KAWAI T,SANJO H,et al.TLR6:A novel member of an expanding toll-like receptor family[J].Gene,1999,231(1/2):59-65.
[13] CHUANG T H,ULEVITCH R J.Cloning and characterization of a sub-family of human toll-like receptors:hTLR7,hTLR8 and hTLR9[J].Eur Cytokine Netw,2000,11(3):372-378.
[14] HEMMI H,TAKEUCHI O,KAWAI T,et al.A Toll-like receptor recognizes bacterial DNA[J].Nature,2000,408(6813):740-745.
[15] JANSSENS S,BEYAERT R.Functional diversity and regulation of different inter-leukin-1 receptor-associated kinase(IRAK)family members[J].Mol Cell,2003,11:293-302.
[16] GOTTIPATI S,RAO N,FUNG-LEUNG W.IRAK1:A critical signaling mediator of innate immunity[J].Cell Signal,2008,20(2):269-276
[17] LI S,STRELOW A,FONTANA E,et al.IRAK-4:a novel member of the IRAK family with the properties of an IRAK-kinase[J].Proc Natl Acad Sci USA,2002,99(8):5567-5572.
[18] EDWARDS D,TOWB P,WASSERMAN S.An activity-dependent network of inter-actions links the Rel protein Dorsal with its cytoplasmic regulators[J].Development,1997,124:38-55.
[19] TOWB P,BERGMANN A,WASSERMAN S.The protein kinase Pelle mediates feed-back regulation in theDrosophilaToll signaling pathway[J].Development,2001,128(23):4729-4736.
[20] SUZUKI N,SUZUKI S,MILLAR D,et al.A critical role for the innate immune signaling molecule IRAK-4 in T cell activation[J].Science,2006,311(5769):1927-1932.
[21] WIENS M,KORZHEV M,PEROVI -OTTSTADT S,et al.Toll-like receptors are part of the innate immune defense system of sponges(Demospongiae:Porifera)[J].Mol Biol Evol,2007,24(3):792-804.
[22] ZHENG J,KNIGHTON D,TEN EYCK L,et al.Crystal structure of the catalytic subunit of cAMP-dependent protein kinase com- plexed with magnesium-ATP and peptide inhibitor[J]. Biochemistry,1993,32(9):2154-2161.
[23] LASKER M,GAJJAR M,NAIR S.Cutting edge:Molecular structure of the IL-1R-associated kinase-4 death domain and its implications for TLR signaling[J].J Immunol,2005,175(7):4175-4179.
注:建立系统树所用的物种以及序列号为:Haliotisdiversicolor(ADC53123);Haliotisrufescens(AGZ03661);Lottiagigantea(XP_009050390);Euprymnascolopes(AAY27972);Crassostreagigas(XP_011428693);Mytilusgalloprovincialis(AHI17286);Aplysiacalifornica(XP_005104938);Rattusnorvegicus(NP_001100261);Daniorerio(AAT37635);Homosapiens(NP_055258)。

