重组人红细胞生成素对高糖诱导人肾小管上皮细胞增殖及凋亡的影响及其可能机制
陈艳霞,吴险峰,房向东,秦晓华,黄翀,涂卫平
重组人红细胞生成素对高糖诱导人肾小管上皮细胞增殖及凋亡的影响及其可能机制
陈艳霞,吴险峰,房向东△,秦晓华,黄翀,涂卫平
目的探讨重组人红细胞生成素(rhEPO)对高糖诱导的正常人肾小管上皮(HK-2)细胞增殖及凋亡的影响及其可能机制。方法将体外培养的HK-2细胞按随机数字表法分为空白对照组、高糖诱导组(高糖终浓度为30 mmol/L)、甘露醇对照组(甘露醇浓度为24.5 mmol/L)、rhEPO对照组(rhEPO终浓度为20 U/mL)、不同浓度rhEPO干预组(高糖终浓度为30 mmol/L+rhEPO终浓度分别为5、10、20 U/mL)及Rho激酶抑制剂(Y27632)组(Y27632终浓度为30 μmol/L+高糖终浓度为30 mmol/L),各组均刺激24 h。应用RT-PCR法检测各组HK-2细胞RhoA、ROCK1 mRNA的表达;MTT法测定细胞增殖,流式细胞技术分析细胞凋亡。结果高糖诱导组RhoA及ROCK1 mRNA表达较空白对照组显著升高(P<0.05),不同浓度rhEPO干预组RhoA mRNA及ROCK1 mRNA的表达较高糖诱导组显著减少(P<0.05),高糖诱导组及不同浓度rhEPO干预组RhoA mRNA与ROCK1 mRNA表达呈正相关。rhEPO可明显促进HK-2细胞增殖(P<0.05),而高糖可诱导正常人肾小管上皮细胞凋亡,加入不同浓度rhEPO或Y27632干预后,其凋亡明显受抑制(P<0.05),且在实验rhEPO浓度范围内,rhEPO促进增殖及抑制凋亡的作用呈现浓度依赖性。结论rhEPO可促进高糖诱导的HK-2细胞增殖,抑制高糖诱导的HK-2细胞凋亡,其机制可能与阻断RhoA/ROCK信号通路有关。
红细胞生成素,重组;细胞增殖;细胞凋亡;rho相关激酶类;HK-2细胞;高糖;RhoA/ROCK信号通路
糖尿病肾病(DN)是糖尿病全身微血管病变的一部分,是糖尿病的严重慢性并发症,已成为终末期肾病的重要原因。DN是多因素多基因共同作用的结果。高血糖是引起DN的始动因素,控制血糖药物可以帮助调节血糖水平从而保护肾功能,进而延缓肾衰竭进展,但不能完全阻止DN的进展。红细胞生成素(EPO)是一种分子质量为304 ku的糖蛋白激素,主要作用于骨髓红系祖细胞,抑制其凋亡,促进红细胞的生成,以维持组织氧供的需要。1985年首次应用EPO以来,EPO在临床上的应用始终局限于纠正各种贫血。近年来,逐渐发现EPO可能不仅仅有促进红细胞生成的作用[1]。有学者对EPO抗凋亡减轻肾间质纤维化方面的作用进行了研究,Wang等[2]检测EPO对马兜铃酸所诱导人肾小管上皮(HK-2)细胞凋亡指标,证实EPO可通过促进抗凋亡蛋白的表达、抑制凋亡蛋白酶的高表达,从而抑制HK-2细胞凋亡。本实验采用高糖诱导HK-2细胞模拟DN时HK-2细胞所处的高糖环境,探讨重组人红细胞生成素(rhEPO)对高糖诱导的HK-2细胞增殖及凋亡的作用及其可能机制,为延缓DN肾纤维化进展寻找新的干预靶点。
1 材料与方法
1.1 主要试剂HK-2细胞株来源于美国ATCC细胞库,rhEPO(沈阳三生),DMEM/F12培养基(美国Hyclone),高糖、甘露醇、Rho激酶抑制剂、Y27632(美国Sigma),RNA抽提试剂Trizol(美国Invitrogen),RT-PCR试剂盒(北京全式金),2×EasyTaq PCR SuperMix(北京全式金),聚合酶链反应引物由Invitrogen公司合成,MTT溶液(南京森贝伽生物科技有限公司)。
1.2 主要仪器核酸微量蛋白测定仪、PCR扩增仪、凝胶图像成像系统(美国Bio-Rad),DYPC-31DN型电泳仪(北京市六一仪器厂),流式细胞仪(美国Beckman),酶标仪(美国Thermo公司)。
1.3 HK-2细胞培养及实验分组用含10%胎牛血清的DMEM/F12培养基于37℃、5%CO2培养箱中培养HK-2细胞,正常HK-2为椭圆形或梭形,呈“鹅卵石”或“铺路石”样排列。将体外培养的HK-2细胞按随机数字表法分为空白对照组、高糖诱导组(高糖终浓度为30 mmol/L)、甘露醇对照组(甘露醇浓度为24.5 mmol/L)、rhEPO对照组(rhEPO终浓度为20 U/mL)、不同浓度rhEPO干预组(高糖终浓度为30 mmol/L+rhEPO终浓度分别为5、10、20 U/mL)及Rho激酶抑制剂(Y27632)组(Y27632终浓度为30 μmol/L+高糖终浓度为30 mmol/L),以上各组均培养24 h。实验重复3次。
1.4 RT-PCR检测用Trizol分别提取各组细胞总的RNA,检测RNA完整性后用核酸微量蛋白测定仪测定RNA的浓度。取总RNA 1.5 μg进行逆转录反应合成cDNA,取2 μL cDNA在2×EasyTaq PCR SuperMix的作用下扩增目标基因(以人β-actin为内参照),总反应体系50 μL。RhoA引物序列:正义链5′-GGCTGGACTCGGATTCGTTG-3′,反义链5′-CGTTGGGACA GAAATGCTT GAC-3′,扩增产物356 bp。ROCK1引物序列:正义链5′-TGATGGCTATTATGGACGAG-3′,反义链5′-GGAGCGTTTCCCAAGC-3′,扩增产物293bp。β-actin引物序列:正义链5′-CGGGAAATCGTGCGTGAC-3′,反义链5′-TGGAAGGTGGACAGCGAGG-3′,扩增产物434 bp。凝胶成像系统成像并使用Quantity One软件进行数据分析。
1.5 MTT法检测细胞增殖收集对数期细胞,调整细胞悬液浓度,铺板使HK-2细胞调密度1 000~10 000/孔(96孔板)。放入细胞培养箱中培养至细胞单层铺满孔底,每组设5个复孔。培养24、48、72 h后离心弃去培养液,PBS冲洗3遍,各孔加入20 μL MTT溶液(5 g/L),继续培养4 h后终止培养,弃去孔内培养液,每孔加150 μL二甲基亚砜(DMSO),置摇床上低速振荡10 mim,使孔内的结晶物充分溶解,在酶联免疫检测仪测量490 nm处各孔的OD值。
1.6 流式细胞术检测细胞凋亡按实验分组分别培养各组细胞24 h后,用不含EDTA的胰酶消化收集各组细胞。用PBS洗涤细胞2次(2 000 r/min离心5 min)收集(1~5)×105细胞。加入500 μL的Binding Buffer悬浮细胞。加入5 μL Annexin V-FITC混匀后,加入5 μL Propidium Iodide,混匀。室温、避光、反应5~15 min。在1 h内,流式细胞仪上检测细胞凋亡。
1.7 统计学方法应用SPSS 17.0统计软件处理数据,计量资料用均数±标准差表示,多组均数比较用单因素方差分析,两两比较用LSD-t法。变量间的相关性采用Pearson直线相关分析。检验水准为α=0.05。
2 结果
2.1 高糖、rhEPO对RhoA、ROCK1 mRNA表达的影响高糖诱导组RhoA及ROCK1 mRNA表达较空白对照组明显升高(P<0.05),不同浓度rhEPO干预组RhoA及ROCK1 mRNA的表达较高糖诱导组显著减少(P<0.05),且在实验rhEPO浓度范围内,呈现出rhEPO浓度的依赖性,见图1、表1。
2.2 rhEPO、Y27632对HK-2细胞增殖的影响不同浓度rhEPO作用24、48、72 h后,随着rhEPO浓度的增加及时间的延长,HK-2细胞的增殖越来越明显,与对照组相比,rhEPO对照组及不同浓度rhEPO干预组均有明显促进增殖的作用,不同rhEPO浓度均以72 h促进增殖作用最明显,表明rhEPO能时间、剂量依赖性地促进HK-2细胞增殖。空白对照组与甘露醇对照组比较差异无统计学意义,Rho激酶抑制剂组较高糖诱导组增殖明显,差异有统计学意义,见表2。
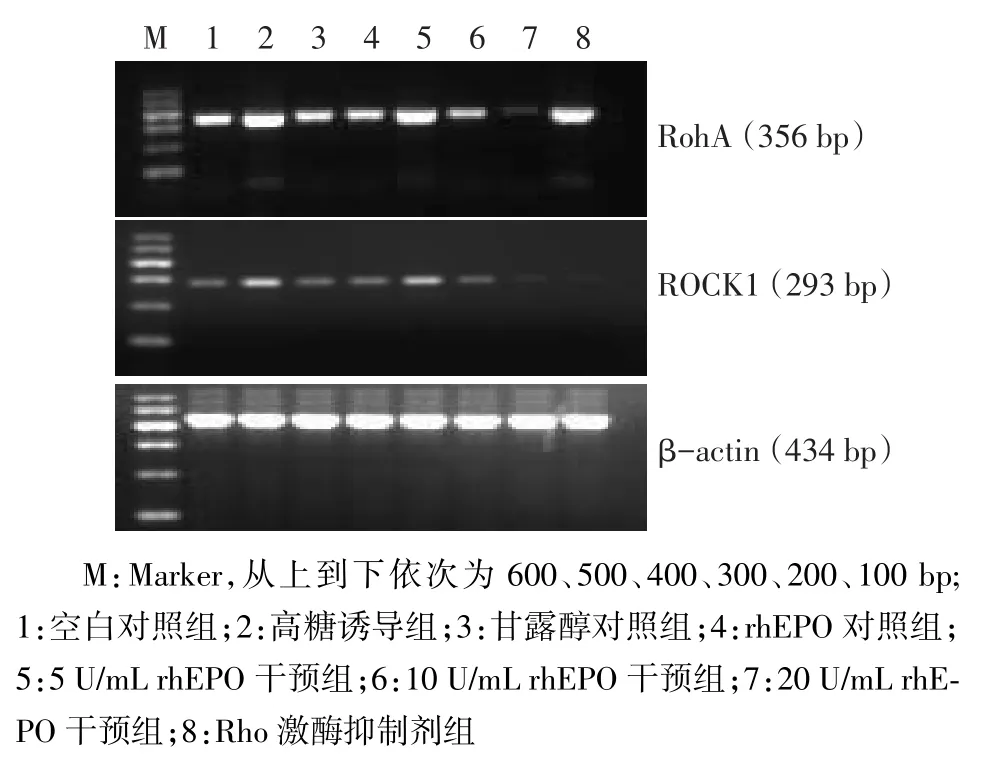
Fig.1The expression of RhoA mRNA and ROCK1 mRNA in eight groups of cells图1 各组细胞RhoA mRNA及ROCK1 mRNA的表达情况
Tab.1The expression levels of RhoA mRNA and ROCK1 mRNA in eight groups of cells表1 各组细胞RhoA mRNA及ROCK1 mRNA的表达相对水平(n=3)
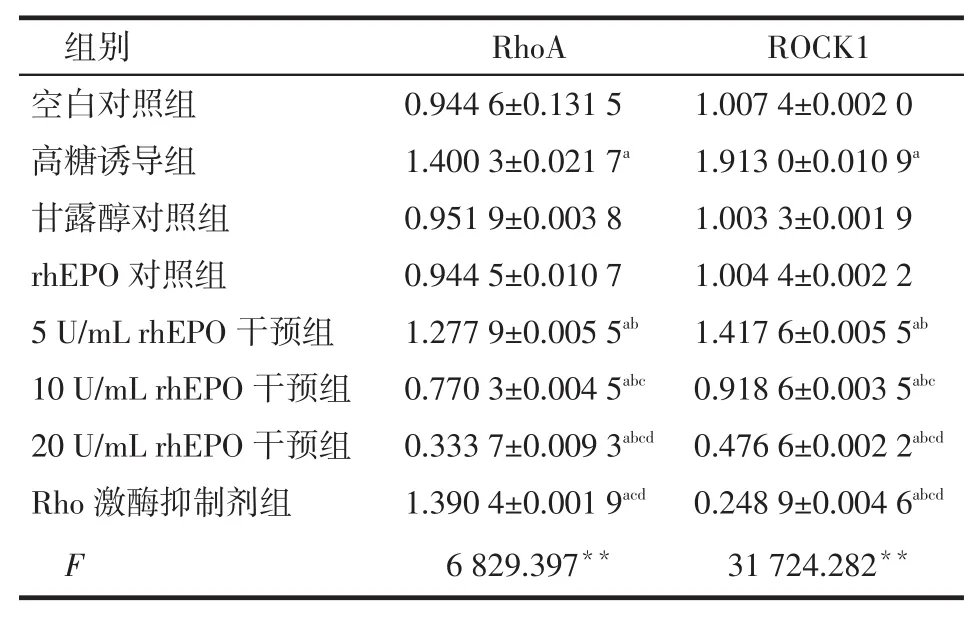
Tab.1The expression levels of RhoA mRNA and ROCK1 mRNA in eight groups of cells表1 各组细胞RhoA mRNA及ROCK1 mRNA的表达相对水平(n=3)
**P<0.01;a与空白对照组比,b与高糖诱导组比,c与5 U/mL rhEPO干预组比,d与10 U/mL rhEPO干预组比,P<0.05;表2、3同
组别空白对照组高糖诱导组甘露醇对照组rhEPO对照组5 U/mL rhEPO干预组10 U/mL rhEPO干预组20 U/mL rhEPO干预组Rho激酶抑制剂组F RhoA 0.944 6±0.131 5 1.400 3±0.021 7a 0.951 9±0.003 8 0.944 5±0.010 7 1.277 9±0.005 5ab 0.770 3±0.004 5abc 0.333 7±0.009 3abcd 1.390 4±0.001 9acd 6 829.397**ROCK1 1.007 4±0.002 0 1.913 0±0.010 9a 1.003 3±0.001 9 1.004 4±0.002 2 1.417 6±0.005 5ab 0.918 6±0.003 5abc 0.476 6±0.002 2abcd 0.248 9±0.004 6abcd 31 724.282**
Tab.2Effects of different concentrations of rhEPO on HK-2 cell proliferation表2 不同浓度的rhEPO对HK-2细胞增殖的影响(n=5,OD值

Tab.2Effects of different concentrations of rhEPO on HK-2 cell proliferation表2 不同浓度的rhEPO对HK-2细胞增殖的影响(n=5,OD值
组别空白对照组高糖诱导组甘露醇对照组rhEPO对照组5 U/mL rhEPO干预组10 U/mL rhEPO干预组20 U/mL rhEPO干预组Rho激酶抑制剂组F 24 h 1.276±0.006 0.928±0.010a 1.268±0.011 1.749±0.038a 1.586±0.012ab 1.645±0.013abcd 1.728±0.010abcd 1.463±0.007ab 871.947**48 h 1.291±0.010 0.964±0.014a 1.297±0.017 1.908±0.014a 1.744±0.012ab 1.796±0.009abcd 1.851±0.006abcd 1.658±0.010ab 2 338.355**72 h 1.304±0.010 0.972±0.005a 1.296±0.008 1.934±0.006a 1.788±0.008ab 1.824±0.006abcd 1.882±0.006abcd 1.689±0.009ab 6 809.568**
2.3 高糖、rhEPO、Y27632对HK-2细胞凋亡的影响HK-2细胞按实验分组给予相应刺激24 h后,高糖可诱导HK-2细胞的凋亡,其早期凋亡率及晚期凋亡加死亡细胞比率均较空白对照组明显升高(P<0.05),给予rhEPO及Y27632干预后,其早期凋亡率及晚期凋亡加死亡细胞比率均较高糖诱导组明显降低(P<0.05),且呈现出rhEPO剂量的依赖性,见表3、图2。
Tab.3The apoptotic rates in eight groups of cells表3 各组细胞凋亡率(n=3,%)
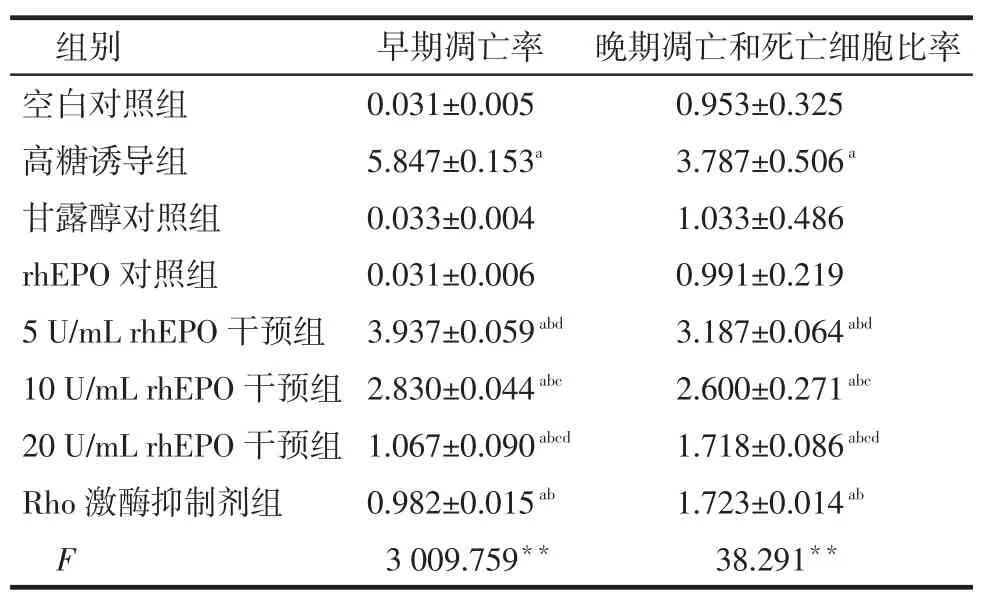
Tab.3The apoptotic rates in eight groups of cells表3 各组细胞凋亡率(n=3,%)
组别空白对照组高糖诱导组甘露醇对照组rhEPO对照组5 U/mL rhEPO干预组10 U/mL rhEPO干预组20 U/mL rhEPO干预组Rho激酶抑制剂组F早期凋亡率0.031±0.005 5.847±0.153a0.033±0.004 0.031±0.006 3.937±0.059abd2.830±0.044abc1.067±0.090abcd0.982±0.015ab3 009.759**晚期凋亡和死亡细胞比率0.953±0.325 3.787±0.506a1.033±0.486 0.991±0.219 3.187±0.064abd2.600±0.271abc1.718±0.086abcd1.723±0.014ab38.291**
2.4 相关性分析高糖诱导组,5、10、20 U/mL rhEPO干预组RhoA mRNA与ROCK1 mRNA均呈正相关(r分别为0.885、0.901、0.886、0.868,均P<0.05)。
3 讨论
肾脏肥大是DN早期的病理改变之一。血管紧张素Ⅱ(AngⅡ)可引起系膜细胞、纤维细胞、远端HK-2细胞增生,近端HK-2细胞肥大。HK-2细胞的增殖与凋亡保持动态平衡状态在肾脏的生长、发育及自身稳定状态的维持中具有非常重要的作用。高糖对体外培养HK-2细胞的增殖起到一定的抑制作用[3]。DN患者肾小管上皮细胞凋亡与坏死明显增加,抑制其凋亡一方面可以延缓DN的进展,另一方面,对促进HK-2细胞增殖也可发挥重要作用。EPO在一定浓度和时间内能刺激高糖培养的小鼠系膜细胞增殖[4]。EPO能促进体外培养的新生猪胰岛细胞的增殖分化,而对其形态和功能无影响[5]。不同浓度EPO对体外培养神经干细胞均具有促进增殖的作用,尤其以EPO浓度为50 U/mL作用明显[6]。本研究显示,不同浓度rhEPO作用高糖诱导下的HK-2细胞24、48、72 h后,随着rhEPO浓度的增加及时间的延长,HK-2细胞的增殖越来越明显,与空白对照组相比,rhEPO对照组及不同浓度rhEPO干预组均有明显促进增殖的作用,且差异均具有统计学意义,不同rhEPO浓度均以72 h促进增殖作用最明显,表明rhEPO能时间、剂量依赖性地促进HK-2细胞增殖。空白对照组与甘露醇对照组比较差异无统计学意义,Rho激酶抑制剂组较高糖诱导组增殖明显,差异有统计学意义。本研究也表明,给予不同浓度rhEPO干预高糖诱导的HK-2细胞转分化过程中,RhoA mRNA的表达与ROCK1 mRNA的表达呈正相关,推测不同浓度rhEPO促进HK-2细胞增殖可能与作用Rho/ROCK信号通路有关。虽然rhEPO促进HK-2细胞增殖具有浓度依赖性,但并不意味着浓度越高其作用越明显,王蕾等[4]发现EPO浓度为1 000 U/mL时具有明显的细胞毒性,大部分细胞出现死亡。EPO促进HK-2细胞增殖的时间依赖性是否与RhoA/ROCK信号通路有关尚需进一步研究。
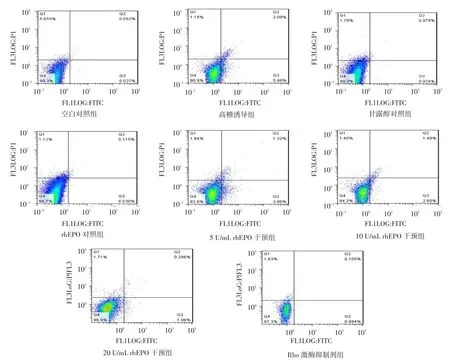
Fig.2Results of apoptosis detected by flow cytometry in eitht groups图2 各组细胞流式细胞检测凋亡图
RhoA/ROCK信号通路与细胞骨架的稳定与改变有关[7]。李峰[8]发现在白血病细胞中,RhoA/ROCK信号通路参与细胞凋亡的过程。高糖可以诱导HK-2细胞凋亡,并且与HK-2细胞损伤及蛋白尿的发生密切相关,与DN的进展及肾功能损害也存在着紧密的联系[9]。EPO可通过红细胞生成素受体(EPOR)的介导,缓解高糖诱导的氧化应激,上调bcl-2 mRNA表达,下调bax、caspase-3 mRNA表达,抑制HK-2细胞凋亡[10]。EPO可通过促进抗凋亡蛋白bcl-xl的表达、抑制凋亡蛋白酶caspase-3的过高表达,从而抑制了马兜铃诱导的HK-2细胞的凋亡[11]。ROCK1是caspase-3的底物,在组织发育或细胞凋亡过程中,caspase-3活化后能够切割ROCK1蛋白质的羧基端,使ROCK1变成活化的形式,进而通过调控细胞骨架来参与调亡时发生的细胞形态改变。另外,最近有研究发现EPO可以降低高糖诱导的大鼠肾小管细胞内的氧化应激水平,抑制肾小管细胞凋亡[10]。EPO可以减轻顺铂引起的肾损害,其机制可能与调节未折叠蛋白反应减轻HK-2细胞凋亡相关[12]。ROCK1的活性主要与RhoA活化有关。ROCK1常常以无活性的形式存在于细胞中,当活性RhoA结合在ROCK1的Rho结合区后,ROCK1通过其羧基端的变构转为活性状态。本研究表明,高糖可诱导HK-2细胞的凋亡,其早期凋亡率及晚期凋亡加死亡细胞比率均较空白对照组明显升高,给予rhEPO及Y27632干预后,其早期凋亡率及晚期凋亡加死亡细胞比率均较高糖诱导组明显较少,且呈现出rhEPO剂量的依赖性。因此,推测rhEPO可能通过调控RhoA/ROCK信号通路而参与高糖诱导HK-2细胞凋亡的过程。
目前EPO在临床的应用还是其经典的作用,即改善贫血。虽然大量体内外研究已证实EPO具有心脏、肾脏、神经等保护作用,还具有抗炎、抗凋亡及促进增殖的作用,理论上可从不同方面干预DN的进展,延缓DN向终末期肾脏病进展的速度。然而还缺乏长期、大量的临床研究证实,并且EPO在发挥脏器保护作用的同时,其潜在毒性作用如高血压、血栓、充血性心力衰竭等也限制了其在临床的使用,有待于进一步深入研究。
[1]Kadkhodaee M.Erythropoietin;bright future and new hopes for an old drug[J].J Nephropathol,2012,1(2):81-82.
[2]Wang W,Zhang J.Protective effect of erythropoietin against aristolochic acid-induced apoptosis in renal tubular epithelial cells[J]. Eur J Pharmacol,2008,588(2):135-140.
[3]Niu M,Chang M,Liu SX.The effect of high glucose in proliferation of tubular epithelial cell cultured in vitro[J].Liaoning Journal of Practical Diabetology,2003,11(2):22-24.[牛敏,常明,刘淑馨.高糖对体外培养肾小管上皮细胞增殖的影响[J].辽宁实用糖尿病杂志, 2003,11(2):22-24].
[4]Wang L,Guan GJ.Effect of rHuEPO on the proliferation and TGF-β mRNA expressions of rat mesangial cells induced by high glucose [J].Journal of Shandong University(Health Sciences),2012,50(5):65-69.[王蕾,关广聚.重组人红细胞生成素对高糖诱导的大鼠肾小球系膜细胞增殖和TGF-βmRNA的影响[J].山东大学学报(医学版),2012,50(5):65-69].
[5]He HH,Wu TH,Xiong J,et al.Effect of erythropoietin on the proliferation and apoptosis of neonatal porcine islet cells[J].Journal of Central South University(Medical Science),2010,35(11):1115-1122.[何红晖,吴天慧,熊静,等.促红细胞生成素对新生猪胰岛细胞增殖分化和凋亡的影响[J].中南大学学报,2010,35(11):1115-1122].
[6]Xue ZM,Hu M,Zhang CH,et al.Effects of different concentrations of recombinant humanerythropoietin onproliferation of neural stem cellscultured in vitro[J].Journal of Clinical Rehabilitative Tissue Engineering Research,2011,15(23):4194-4198.[薛政民,胡萌,张长海,等.不同浓度重组人促红细胞生成素对神经干细胞体外培养增殖的影响[J].中国组织工程研究与临床康复,2011,15(23): 4194-4198].
[7]Zilberman Y,Alieva NO,Miserey-Lenkei S,et al.Involvement of the Rho-mDia1 pathway in the regulation of Golgi complex architectureand dynamics[J].Mol BiolCell,2011,22(16):2900-2911.
[8]Li F.The regulation role of RhoA/ROCK1-Erk1/2-Bax signaling pathway in sodium selenite induced apoptosis in leukemia[D].Beijing:Peking Union Medical College,2012.[李峰.RhoA/ROCK1-Erk1/2-Bax信号通路在亚硒酸钠诱导白血病细胞凋亡中的调节作用[D].北京:北京协和医学院,2012].
[9]Zhang X,Zhao Y,Chu Q,et al.Zinc Modulates High Glucose-Induced Apoptosis by Suppressing Oxidative Stress in Renal Tubular Epithelial Cells[J].Biol Trace Elem Res,2014,158(2):259-267.
[10]Dang JZ,Jia RH,Tu YF,et al.Effect of erythropoietin on renal tubular cells apoptosis induced by high glucose[J].Chin Nephrol,2010,26(7): 537-541.[党建中,贾汝汉,涂亚芳,等.红细胞生成素对高糖诱导肾小管细胞凋亡的影响[J].中华肾脏病学,2010,26(7):537-541].
[11]Wang WW,Zhang JY.Protection mechanism of erythropoietin agaist the apotosis of renal tuble epithelial cells induced by aristolochic acid[J].Chin Nephrol,2007,23(9):593-600.[王巍巍,张金元.红细胞生成素对马兜铃酸诱导肾小管上皮细胞凋亡的保护机制研究[J].中华肾脏病学,2007,23(9):593-600].
[12]Kong DY,Huang ZY,Tang J,et al.Erythropoietin attenuates cisplatin-induced nephrotoxicity by regulating unfolded protein response [J].Chinese Journal of Pathophysiology,2014,30(1):133-138.[孔德阳,黄智勇,唐杰,等.促红细胞生成素通过调节未折叠蛋白反应减轻顺铂所致的肾小管上皮细胞凋亡[J].中国病理生理杂志, 2014,30(1):133-138].
(2014-07-08收稿2014-09-09修回)
(本文编辑李国琪)
Effects of erythropoietin in high glucose induced proliferation and apoptosis of human kidney proximal tubular epithelial cells and the possible mechanism
CHEN Yanxia,WU Xianfeng,FANG Xiangdong△,QIN Xiaohua,HUANG Chong,TU Weiping
Department of Nephrology,the Second Affiliated Hospital of Medical College of Nanchang University, Nanchang 330006,China△
ObjectiveTo study the effects of erythropoietin(rhEPO)in high glucose induced proliferation and apoptosis of human kidney proximal tubular epithelial(HK-2)cells,and the possible mechanism thereof.MethodsHK-2 cells cultured in vitro were divided into several groups randomly:blank control group,high glucose group,mannitol group,rhEPO control group,different concentrations of rhEPO treatment groups(5,10,20 U/mL)and Rho kinase group.The reverse transcription polymerase chain reaction(RT-PCR)was used to evaluate the mRNA levels of RhoA and ROCK after 24 hours. Tetrazolium salt method(MTT)was used to determine the cell proliferation.Cell apoptosis was detected by flow cytometry. ResultsCompared with blank control group the expression levels of RhoA and ROCK1 mRNA were significantly increased in high glucose group(P<0.05).RhoA,ROCK1 mRNA expressions significantly decreased in rhEPO group than those of high glucose group(P<0.05).There was a positive correlation between the expression levels of RhoA mRNA and ROCK1 mRNA in high glucose group and rhEPO group.MTT method showed that rhEPO significantly promoted the proliferation of HK-2 cells(P<0.05).Flow cytometry analysis showed that high glucose induced apoptosis in HK-2 cells,which was significantly inhibited in rhEPO group and Rho kinase group as compared to that of high glucose group in a concentration dependent manner(P<0.05).ConclusionrhEPO can promote HK-2 cell proliferation and inhibit apoptosis,which may be related to RhoA/ROCK signaling pathway.
erythropoietin,recombinant;cell proliferation;apoptosis;rho-associated kinases;HK-2 cells;high glucose;RhoA/ROCK signaling pathway
R692
A
10.3969/j.issn.0253-9896.2015.01.007
江西省自然科学基金(20122BAB205006)
江西省南昌大学第二附属医院肾脏内科(邮编330006)
陈艳霞(1988),女,硕士,主要从事肾脏风湿免疫研究
△通讯作者E-mail:xiangdongdang818@sina.com

