新疆和内蒙古地区油葵舌状花中全反式叶黄素含量的分析
惠伯棣,宫 平
(北京联合大学应用文理学院食品科学系,北京 100191)
新疆和内蒙古地区油葵舌状花中全反式叶黄素含量的分析
惠伯棣,宫 平
(北京联合大学应用文理学院食品科学系,北京 100191)
检测我国新疆(样品Ⅰ)和内蒙古(样品Ⅱ)地区油葵舌状花样品中的全反式叶黄素含量,以评价其作为叶黄素新资源的可能性,并为提高当地油葵产业的经济附加值提供相对含量测定的依据。结果表明:样品Ⅰ和Ⅱ全反式叶黄素含量(以样品干质量计算)分别为1.5‰和0.8‰。该油葵舌状花中的叶黄素可考虑作为叶黄素潜在的新资源。
葵花;舌状花;类胡萝卜素;叶黄素;C18-高效液相色谱;C30-高效液相色谱
葵花(Helianthus annuus L.)又称向日葵、西番菊、太阳花等,属菊科,为一年生草本植物,起源于北美,现有52 个品种[1]。该植物在我国东北、华北和西北的新疆、甘肃、宁夏、内蒙、山西、黑龙江、吉林等地被作为农作物大面积种植。尤其在我国的新疆和内蒙古地区,葵花的种植在当地的农业和产业中已经占有重要的比重。在内蒙古中东部地区,常年种植面积便有几十万亩。在新疆地区,常年种植面积已有近200万 亩。按加工用途划分,栽培葵花可作为油料作物(又称油葵)、食用作物(又称食葵)和观赏植物(又称花葵)[1-2]。油葵已经成为我国第三大油料作物。除舌状花(又称花舌)外,葵花(包括油葵和食葵)植株的全身均已被加工利用。同时,葵花全草皆可入药,花舌可祛风明目[1]。
葵花的花舌即是其头状花序外周的舌状花,以黄色、橙色多见。其中主要色素为脂溶性的类胡萝卜素类物质,主要为叶黄素类化合物。其中的叶黄素类化合物与脂肪酸酯化,以酯的形式存在[3]。叶黄素类化合物含有双羟基,以叶黄素、玉米黄素最为常见。二者互为几何异构体,其结构见图1[4-6]。目前已知叶黄素和玉米黄素均为黄斑色素。大量补充二者均可降低黄班衰退症的风险,并对视网膜有保护作用。二者都具有优秀的单线态氧淬灭能力。因此,这2 种化合物对人体健康均有着积极影响[7-10]。

图1 叶黄素(A)和玉米黄素(B)结构式Fig.1 Molecular structures of lutein (A) and zeaxanthin (B)
目前,生产天然叶黄素的主要原料是万寿菊(Tagetes erecta)的花。天然玉米黄素的理想资源是枸杞果实。作为羟基类胡萝卜素的天然资源,万寿菊与枸杞二者均为栽培作物,其生产均占用农业资源。本研究的目的是对油葵舌状花中的全反式黄色素进行定量分析。预期结果将对评价油葵舌状花中的叶黄素资源有一定的参考价值。这一努力对开发叶黄素类物质新资源和提高葵花产业的经济附加值具有现实的意义。
1 材料与方法
1.1 样品
舌状花样品Ⅰ采集自新疆伊犁-阿勒泰地区,样品Ⅱ采集自内蒙包头市固阳地区。每个样品采收地面积6 670 m2以上,品种统一,采收时间为种子收获期前15 d。干燥方法:70 ℃条件下常压干燥至质量恒定。样品最终含水量小于15%。样品采集方法设计符合统计学原理,以保障结果具有代表性。
1.2 试剂
叶黄素参比样品(C/N:0133,纯度96%,包装规格为5 mg/瓶)、(3R, 3’R)玉米黄素参比样品(C/ N:0119),纯度97%,包装规格为5 mg/瓶) 瑞士CaroNature公司;正己烷、95%乙醇、KOH和NaCl(均为分析纯) 北京化工厂;乙腈、乙酸乙酯、甲醇和甲基叔丁基醚(均为色谱纯) 美国迪马公司。
1.3 仪器与设备
Multispec-1501紫外-可见光分光光度计 日本Shimadzu公司;C18色谱柱为DiamondsTMDikma Technologies(4.6 mm×250 mm,5 μm);C30色谱柱为YMCTMCarotenoid(4.6 mm×250 mm,5 μm);高效液相色谱(high performance liquid chromatography,HPLC)仪、PU-2080 Plus流动相输送系统、UV-2075紫外检测器 日本Jasco公司。
1.4 方法
1.4.1 总类胡萝卜素萃取
将干燥的油葵舌状花用咖啡磨粉碎,过40 目筛。准确(精确至0.000 1 g)称取0.5 g粉末于研钵中,用10 mL正己烷研磨萃取。适时用滴管将上清液取出、收集。重复萃取6 次,至上清液无色。合并萃取液,定容于50 mL棕色容量瓶中。定容液直接用于C18-HPLC检测。定容液稀释10 倍后用于紫外-可见光分光光度计检测。每个样品做平行样6 份,结果取平均值。
1.4.2 皂化制备游离态叶黄素
将萃取液按1∶1体积比加入10%的KOH-乙醇溶液进行皂化。皂化条件:避光、充氮、室温、慢速磁力搅拌。反应2 h后,按1∶1体积比加入5%的NaCl溶液,缓慢摇动后静置,待出现分层后收集上相,下相用25 mL正己烷萃取2~3 次,直到无色。将上相与萃取液合并,定容于50 mL棕色容量瓶中。定容体积超出刻度时用氮气吹至刻度。定容液用于C18-HPLC、C30-HPLC检测,稀释10 倍后用于UV-VIS检测。
1.4.3 叶黄素类化合物的检测
取皂化前样品用紫外-可见光分光光度计在450 nm波长处以正己烷为参比测定样品的吸光度,根据Beer-Lambert定律,按公式(1)计算样品液中总类胡萝卜素质量:

式中:A为450nm波长处的吸光度;V为样品体积/mL;MTCA为总类胡萝卜素质量/mg。
根据样品质量(0.5 g)计算样品中总类胡萝卜素含量,以干质量计算。取皂化后样品用紫外-可见光分光光度计在450 nm波长处以正己烷为参比比色,根据式(1)计算样品中游离态总类胡萝卜素质量。根据样品质量(0.5 g)计算样品中游离态总类胡萝卜素含量,以干质量计算。
根据皂化前后结果按式(2)计算皂化损失率:

式中:L为皂化损失率/%;A前为皂化前吸光度;A后为皂化后吸光度。
C18-HPLC检测皂化前后样品中的类胡萝卜素组成。色谱条件:色谱柱为DiamonsilTMC18(4.6 mm×250 mm,5 μm);流动相A为乙腈-水(9∶1,V/V);流动相B为乙酸乙酯;梯度洗脱:20 min内,流动相B由0%上升到100%,之后5 min流动相B保持100%;检测波长450 nm,流速:1 mL/min,进样量20 μL[11-12]。根据色谱图上组分的保留时间与参比样品的比较定性叶黄素-玉米黄素组分,并根据色谱图上各组分峰面积计算叶黄素-玉米黄素组分相对含量。按式(3)计算样品中游离态叶黄素-玉米黄素组分质量:

式中:m1为样品中游离态叶黄素-玉米黄素组分质量;m2为样品中游离态总类胡萝卜素质量(紫外-可见光分光光度计检测);m3为样品中游离叶黄素-玉米黄素组分相对含量(C18-HPLC检测)。
根据样品质量(0.5 g)计算样品中游离态叶黄素-玉米黄素组分含量,以千分单位计。
比较样品皂化前后的C18-HPLC色谱图。计算皂化后消失的类胡萝卜素酯组分峰面积之和,按式(4)计算样品中总类胡萝卜素酯相对含量。

式中:M为总类胡萝卜素酯组分相对含量;A1为类胡萝卜素酯组分峰面积;A2为类胡萝卜素组分峰面积。
C30-HPLC检测皂化后叶黄素的几何异构体组成。色谱柱为YMCTMCarotenoid(4.6 mm×250 mm,5 μm);流动相A为乙腈-甲醇(3∶1,V/V);流动相B为甲基叔丁基醚;梯度洗脱:20 min内,流动相B由0%上升到55%,之后10 min流动相B保持55%;检测波长450 nm,流速:1 mL/min,进样量20 μL[4,13-17]。根据色谱图上组分的保留时间与参比样品的比较定性全反式叶黄素、玉米黄素及其几何异构体组分,并根据色谱图上全反式叶黄素、玉米黄素及其顺式异构体组分峰面积,计算全反式叶黄素组分相对含量。按式(5)计算样品中全反式叶黄素质量:

式中:m全为样品中全反式叶黄素组分含量;m0为样品中叶黄素-玉米黄素组分含量(C18-HPLC);m相对为样品中全反式叶黄素组分相对含量(C30-HPLC);根据样品质量(0.5 g)计算样品中全反式叶黄素组分含量,以千分单位计。
2 结果与分析
2.1 舌状花中总类胡萝卜素含量
皂化前每个样品在450 nm波长处测定吸光度,按式(1)计算其总类胡萝卜素含量分别为(样品Ⅰ)4.3‰和(样品Ⅱ)2.2‰。
2.2 舌状花中总游离态类胡萝卜素含量
皂化后每个样品在450 nm波长处测定吸光度按式(1)计算样品总游离态类胡萝卜素含量分别为(样品Ⅰ)2.8‰和(样品Ⅱ)1.5‰。
与皂化前样品的吸光度比较,按式(2)计算,每个样品的皂化损失率分别为35%和34%。
2.3 舌状花中总类胡萝卜素酯含量
图2为样品Ⅰ皂化前、后的C18-HPLC色谱图。皂化前样品C18-HPLC色谱图中,保留时间为8.32 min的组分为叶黄素,保留时间为11.58、17.41、18.11、18.68 min的组分在皂化后消失。其中11.58 min的组分为叶黄素单酯可能性较大,17.41、18.11、18.68 min的组分为叶黄素双酯可能性较大[3]。根据各组分峰面积,按式(4)计算其峰面积之和占总峰面积的比例,样品Ⅰ为64%,样品Ⅱ为61%。故二者的总类胡萝卜素酯含量分别为(样品Ⅰ)2.6‰和(样品Ⅱ)1.3‰。

图2 葵花舌状花正己烷萃取物皂化前(A)和皂化后(B)的C1188-HHPPLLCC图Fig.2 C18-HPLC profiles of hexane extract from the ray florets of sunflower before (A) and after (B) saponification
2.4 叶黄素-玉米黄素组分含量

图3 全反式叶黄素参比样品CC1188-HPPLLCC图Fig.3 C18-HPLC profile of all E-lutein
图3 为叶黄素参比样品C18-HPLC色谱图。皂化后样品C18-HPLC色谱图中保留时间为8.30 min的组分与叶黄素参比样品8.25 min的组分保留时间基本一致。据此,定性该组分为叶黄素-玉米黄素组分。
根据图2峰面积,计算叶黄素-玉米黄素组分的相对比例。样品Ⅰ中叶黄素-玉米黄素组分占总峰面积的60%,样品II中叶黄素-玉米黄素组分占总峰面积的62%。按式(3)计算,样品Ⅰ中叶黄素-玉米黄素组分的含量为1.7‰,样品Ⅱ中叶黄素-玉米黄素组分的含量为0.9‰。
2.5 舌状花中全反式叶黄素组分含量
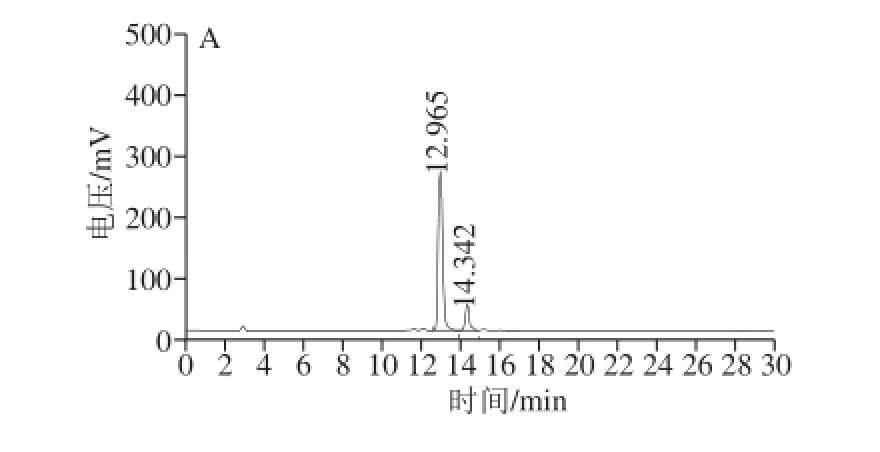
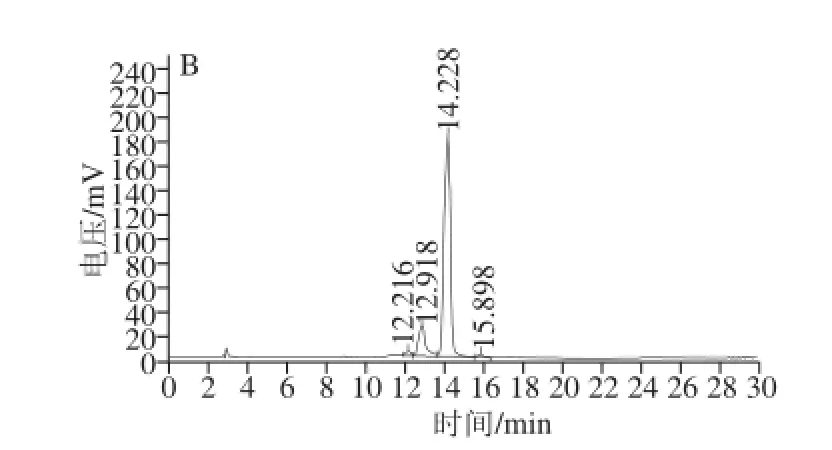
图4 全反式叶黄素(A)和玉米黄素(B)参比样品CC3300-HPPLLCC图Fig.4 C30-HPLC profiles of all E-lutein (A) and E-zeaxanthin (B)
由图4可见,保留时间为12.92 min的组分为全反式叶黄素,保留时间为14.23 min的组分为全反式玉米黄素。

图5 油料葵花正己烷提取物皂化后CC3300-HHPPLLCC图Fig.5 C30-HPLC profile of hexane extract from the ray florets of sunflower after saponification
样品Ⅰ皂化后的C30-HPLC色谱图见图5。保留时间为12.94 min的组分与全反式叶黄素参比样品中12.92 min的保留时间基本一致,故定性为全反式叶黄素。如图5所示,样品除全反式叶黄素外,还存在少量顺式叶黄素和玉米黄素组分。根据色谱图上全反式叶黄素、玉米黄素及其顺式异构体组分峰面积,计算全反式叶黄素组分相对含量,样品Ⅰ为88%,样品Ⅱ为86%。全反式玉米黄素相对含量,样品Ⅰ为8%,样品Ⅱ为9%。按式(5)计算样品中全反式叶黄素和玉米黄素组分的质量。经过对样品的检测,样品中类胡萝卜素(包括叶黄素)的含量见表1。样品中全反式叶黄素的含量为样品Ⅰ1.5‰,样品Ⅱ0.8‰;全反式玉米黄素组分的含量为样品Ⅰ0.14‰,样品Ⅱ0.081‰。这一检测结果显示:样品中玉米素组分的含量有限,不能做为玉米黄素的天然资源考虑。

表1 样品中类胡萝卜素含量Table 1 Carotenoid contents in samples‰
3 讨 论
在本研究中,样品采集的广泛性有限。因此,得到的结论仅适用于样品采集地的资源。在今后的工作中,应当在全国油葵的各主产区采集样品,使样品采集的方式和方法具有统计学意义。
结果显示:伊犁-阿勒泰地区的油葵舌状花样品中全反式叶黄素的含量较内蒙包头固阳地区的较高。其原因可能是多方面的,如环境和气候条件差异是一个重要原因。尤其是日照强度和时间以及昼夜温差的差异对油葵植株的次生代谢会产生较明显的影响。
本研究采用紫外-可见光分光光度计检测值为基础的方法,HPLC检测只提供各组分的相对比例。与直接用参比样品在C30柱上做外标定量的方法相比,这种方法可最大限度地消除皂化、C30色谱柱保留等因素对检测结果造成的影响。这种方法已在世界各国的国标方法中采用。
仅就本研究中采集样品而言,与万寿菊花中的叶黄素资源相比,其产地的油葵舌状花中的叶黄素含量是有限的。因此,只有在资源量相当丰富,而且成本很低的条件下,二者产地的油葵舌状花中的叶黄素才能被考虑成为叶黄素的新资源。
[1] 江苏新医学院. 中药大辞典: 上册[M]. 上海: 上海科学技术出版社,2000: 931-932.
[2] 谭丽萍, 曲文祥, 张玮. 内蒙古中东部食用向日葵品种的生态类型分布规律和利用价值[J]. 内蒙古农业科技, 2009(6): 81-82.
[3] 惠伯棣, 唐粉芳, 裴凌鹏, 等. 万寿菊干花中叶黄素的实验室制备[J].食品科学, 2006, 27(6): 157-160.
[4] 惠伯棣, 李京, 裴凌鹏. 应用C30-HPLC分离与鉴定食品中全反式叶黄素和玉米黄素[J]. 食品科学, 2009, 30(9): 151-154.
[5] 张蕊, 蔡靳, 惠伯棣, 等. 一种枸杞中玉米黄素检测的方法[J]. 中国食品添加剂, 2013(2): 239-245.
[6] 蔡靳, 惠伯棣, 蒋继志. 玉米黄素及在食品中的应用研究进展[J]. 中国食品添加剂, 2012(3): 200-207.
[7] 翟艳丽, 惠伯棣, 宫平, 等. 游离态叶黄素和玉米黄素体外单线态氧淬灭率比较[J]. 食品科学, 2014, 35(7): 77-80. doi:10.7506/spkx1002-6630-201407016.
[8] 廖萍泰, 惠伯棣, 裴凌鹏, 等. 叶黄素的体外抗氧化功能[J]. 食品与发酵工业, 2005, 31(4): 46-49.
[9] 翟艳丽, 惠伯棣, 蔡靳, 等. 类胡萝卜素与癌症风险相关性的研究[J]. 食品科学, 2013, 34(13): 307-313. doi: 10.7506/spkx1002-6630-201313065.
[10] 惠伯棣, 裴凌鹏, 李京, 等. 万寿菊花中叶黄素及其酯体外淬灭单线态氧能力的比较[J]. 中国药学杂志, 2006, 41(18): 1385-1387.
[11] 惠伯棣, 欧阳清波, 曾悦. 植物食品中类胡萝卜素的高压液相色谱检测[J]. 中国食品添加剂, 2002(5): 72-82.
[12] 丁靖, 惠伯棣. 食物中类胡萝卜素的HPLC分析[J]. 中国食品添加剂,2010(4): 256-267.
[13] 张艳, 惠伯棣, 裴凌鹏, 等. C30柱分离万寿菊花中的叶黄素类化合物初探[J]. 食品科学, 2006, 27(11): 424-428.
[14] LI Dajing, XIAO Yadong, ZHANG Zhongyuan, et al. Analysis of (all-E)-lutein and its (Z)-isomers during illumination in a model system[J]. Journal of Pharmaceutical and Biomedical Analysis, 2014, 100: 33-39.
[15] KAO T H, CHENA C J, CHEN B H. Carotenoid composition in Rhinacanthus nasutus (L.) Kurz as determined by HPLC-MS and affected by freeze-drying and hot-air-drying[J]. Analyst, 2011, 136:3194-3202.
[16] KAO T H, LOH C H, STEPHEN I B, et al. Determination of carotenoids in Taraxacum formosanum by HPLC-DAD-APCI-MS and preparation by column chromatography[J]. Journal of Pharmaceutical and Biomedical Analysis, 2012, 66: 144-149.
[17] LIU H L, CHEN B H, KAO T H, et al. Carotenoids composition in Scutellaria barbata D. Don as detected by high performance liquid chromatography-diode array detection-mass spectrometry-atmospheric pressure chemical ionization[J]. Journal of Functional Foods, 2014, 8:100-110.
Quantification of the Content of all E-lutein from the Ray Florets of Oil Sunflower in Xinjiang and Inner Mongolia
HUI Bodi, GONG Ping
(Department of Food Science, College of Applied Arts and Science, Beijing Union University, Beijing 100191, China)
This study aimed to determine the content of all E-lutein in the ray fl orets of oil sunfl ower cultured in Xinjiang (Sample Ⅰ) and Inner Mongolia (Sample Ⅱ), China for assessing its potential exploitation as a novel source of lutein. This effort may also form a solid base for increasing the industrial benefi ts of sunfl ower. In practice, the assessment was performed from determination by ultraviolet and visible (UV-VIS) spectroscopy while C18- and C30-high performance liquid chromatography (HPLC) were applied to measure the relative amount of all E-lutein. Data from this assessment suggested that the amounts of all E-lutein in samples Ⅰ and Ⅱ were 1.5‰ and 0.8‰, respectively. The ray fl orets of oil sunfl ower, a plentiful resource, can be considered as a potential source of lutein.
sunfl ower; ray fl oret; carotenoid; lutein; C18-HPLC; C30-HPLC
TS201.2
A
1002-6630(2015)16-0220-04
10.7506/spkx1002-6630-201516041
2014-11-01
惠伯棣(1959—),男,教授,博士,研究方向为类胡萝卜素化学与生物化学。E-mail:bodi_hui@buu.edu.cn

