乳腺实性乳头状癌的临床病理特征
罗华荣,徐铖,郑海红,翁寿向,甘梅富(温州医科大学附属台州医院 病理科,浙江 台州 317000)
·临 床 经 验·
乳腺实性乳头状癌的临床病理特征
罗华荣,徐铖,郑海红,翁寿向,甘梅富
(温州医科大学附属台州医院 病理科,浙江 台州 317000)
目的:探讨乳腺实性乳头状癌(SPC)的临床病理特征。方法:收集18例SPC患者资料,总结其临床和病理特征,选用雌激素受体(ER)、孕激素受体(PR)、人表皮生长因子受体-2(CerbB-2)、增殖标记(Ki-67)、细胞角蛋白5/6(CK5/6)、细胞角蛋白14(CK14)、肌上皮标记(P63)、突触素(Syn)和嗜铬素A(CgA)等抗体行免疫组织化学染色,并用荧光原位杂交法行人表皮生长因子受体-2(HER-2)基因检测。结果:肿瘤主要表现为中心性的乳腺肿块或乳头溢血。镜下肿瘤由边界清楚的膨胀性生长的结节构成,结节内可见纤细的纤维血管轴心。55.6%伴有黏液分泌,16.7%伴有浸润性癌。免疫组织化学染色显示瘤细胞ER、PR呈强阳性,CerbB-2大部分呈阴性,仅4例CerbB-2(1+)。肿瘤细胞均不表达CK5/6、CK14及P63,9例肿瘤细胞巢周围显示完整的肌上皮围绕,5例显示肌上皮部分缺失,4例完全缺失。Syn阳性率为72.2%,CgA阳性率为55.6%,Ki-67增殖指数平均为8.5%。3例伴浸润的SPC均无HER-2基因扩增。17例腋窝淋巴结清扫或前哨淋巴结活检中仅1例见癌转移。获得随访的17例(占94.4%)患者均未见肿瘤复发或转移。结论:乳腺SPC是一种少见的乳腺癌,好发于老年女性,具有独特的组织学形态和免疫表型。多项临床病理特征及随访资料显示SPC具有惰性的生物学行为和良好的预后。
乳腺肿瘤;实性乳头状癌;病理;免疫组织化学
乳腺乳头状病变的良恶性判断历来是病理诊断中的难点,在日常工作中极易造成误诊。2012年第4版乳腺肿瘤WHO分类中首次将实性乳头状癌(solidpapillary carcinoma,SPC)列为乳腺乳头状病变中的一个独立类型[1]。SPC是一种少见的乳腺肿瘤,其 分子遗传学特征及生物学行为等尚未被充分认识。本研究对18例SPC临床病理资料进行回顾性分析,结合近年来乳腺乳头状病变的最新研究成果,就其临床病理特点、鉴别诊断和预后进行探讨。
1 材料和方法
1.1 一般资料 收集浙江省台州医院病理科2010 年6月-2014年6月间诊断为乳腺实性乳头状癌的常规外检病例,按照2012年乳腺肿瘤WHO分类中描述的实性乳头状癌组织形态学标准,由2位乳腺专科病理医师读片确认,最终共获得18例临床病理资料。18例SPC患者均为女性,占我院同期收治乳腺癌患者(共1 638例)的1.1%。发病年龄42~82岁(平均62.6岁,中位66岁)。其中3例伴浸润,平均年龄为61.7岁,低于原位癌患者(为62.8岁)。临床首发症状表现为乳腺肿块14例,乳头溢血4例。病程从10 d~1年不等,均未出现类癌综合征。18例患者均无乳腺癌家族史,1例患者既往有结肠癌伴直肠多发性息肉病,1例术后15个月发现结肠癌,术后证实为结肠原发腺癌。本组10例原位SPC术后行单纯内分泌治疗,3例伴浸润的SPC行内分泌治疗加放化疗(具体剂量不详)。18例可查阅资料中共获得17例(占94.4%)随访。随访时间1~47个月,平均22.6个月,17例患者均无瘤生存,未见肿瘤复发或转移。见表1。
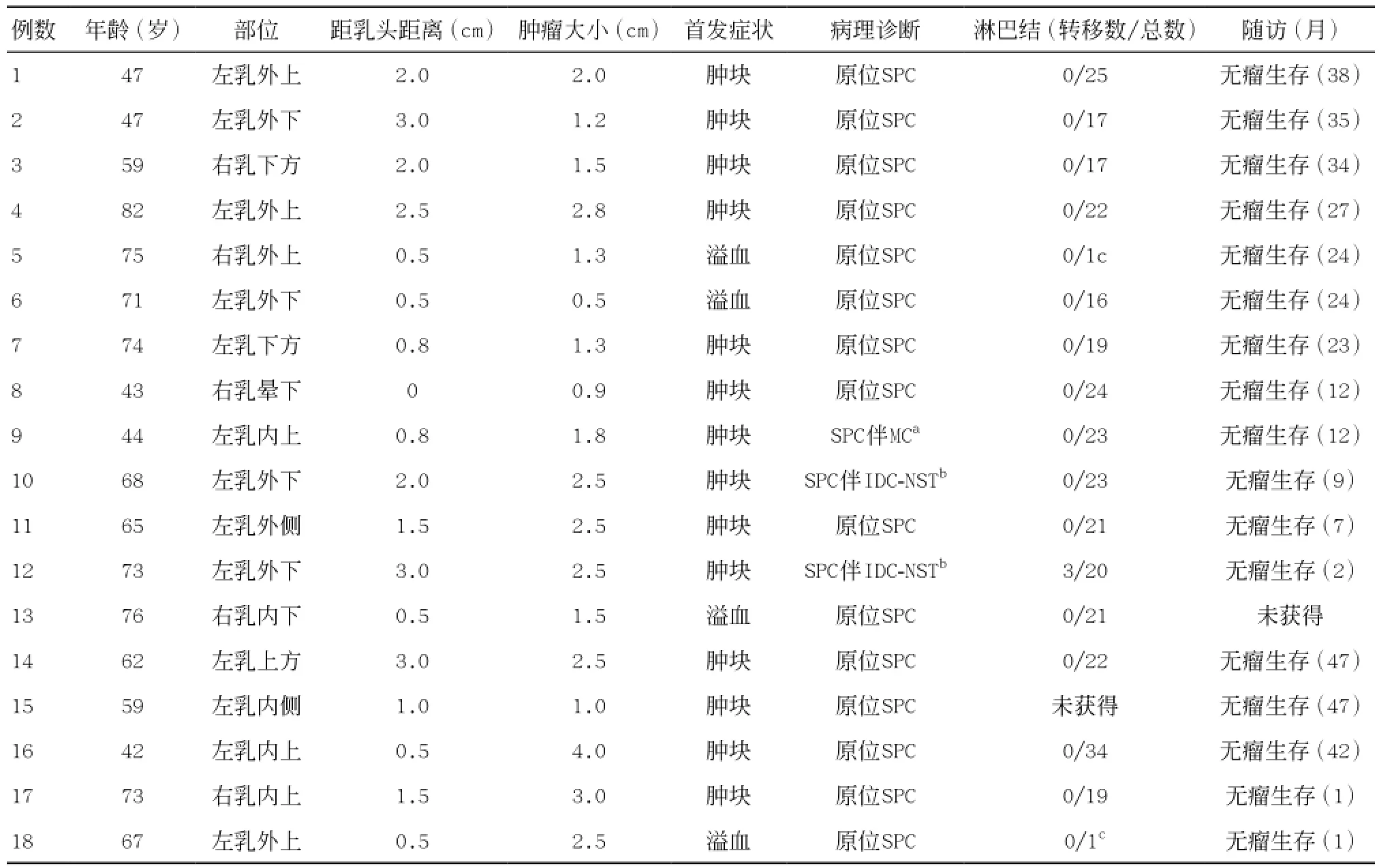
表1 18例乳腺实性乳头状癌临床病理资料
1.2 常规染色和免疫组织化学 所有标本均经4%中性甲醛溶液固定、石蜡包埋、厚4 μ m连续切片,作HE染色和免疫组织化学染色,光镜观察。免疫组织化学采用EnVision两步法,高温高压抗原修复,DAB显色。所用一抗:雌激素受体(ER)(SP1)、孕激 素受体(PR)(SP2)、细胞角蛋白(CK14)(LL002)、肌 上皮标记(P63)(4A4)、突触素(Syn)(SP11)购自福 州迈新公司,人表皮生长因子受体-2(CerbB-2)、细 胞角蛋白(CK5/6)(D5/16B4)、嗜铬素A(CgA)(DAKA3)、增殖标记(Ki-67)(GM001)购自Dako公司;所用EnVision检测试剂盒和DAB显色试剂盒均购自Dako 公司。
1.3 荧光原位杂交 HER-2基因检测采用荧光原位杂交(FISH)法。石蜡标本厚4 μ m切片,常规脱蜡、蛋白酶消化处理后,将10 μ L变性的DNA探针混合物与样本杂交,37 ℃湿盒中孵育14~18 h,洗涤封片后荧光显微镜下观察。HER-2探针杂交荧光信号为红色,17号染色体着丝粒(CERP17)信号为绿色,计数并计算两者比值(HER2/CEP17)。比值<2.0为HER-2基因无扩增;比值≥2.0为HER-2基因有扩增;比值<2但平均HER-2基因拷贝数≥6.0也提示HER-2基因有扩增。
2 结果
2.1 大体检查 18例SPC患者中13例行乳腺改良根治术,2例行乳腺单纯切除术加前哨淋巴结活检术,2例行保乳术加腋窝淋巴结清扫术,1例行保乳术。病变位于乳头附近0~3.0 cm乳腺组织中,平均距乳头1.4 cm。肿瘤直径从0.5~4.0 cm不等,平均2.0 cm。大部分呈实性结节状,切面灰白灰黄,质韧,边界清楚。其中2例切面见囊腔,1例伴出血。
2.2 组织学观察 光镜下肿瘤由多个边界清楚的富于细胞的结节构成,细胞排列紧密,呈膨胀性生长(见图1)。结节内可见纤细的纤维血管轴心,轴心周围细胞多呈栅栏状排列或围绕血管形成假菊形团样结构(见图2),缺少明显的乳头状或筛状结构。部分结节内可见偏心性的不规则扩张的腔隙,内衬立方或柱状上皮,腔内见红细胞或粉染无结构物。瘤细胞形态均一,大多呈多角形或梭形,类似于良性普通型导管增生。细胞质中等量,细颗粒状,部分胞质内可见黏液。细胞核圆形或卵圆形,染色质细而淡染,轻~中度异型,核分裂象少见,其中16例核分裂象<5/10 HPF,2例核分裂象6~10/10 HPF。10例(占55.6%)伴有多少不等的细胞内外黏液。其中2例见含有细胞内黏液的印戒样细胞;8例见细胞外黏液,大部分位于肿瘤细胞巢之间,部分黏液进入间质形成黏液湖(见图3)。本组共15例(占83.3%)为原位SPC,其中1例伴小叶癌化;共3例(占16.7%)伴浸润,其中2例为非特殊型浸润性乳腺癌,1例为黏液癌。行腋窝淋巴结清扫或前哨淋巴结活检共17例,其中14例原位癌患者(包括12例腋窝淋巴结清扫和2例前哨淋巴结活检)均无淋巴结转移,3例伴浸润SPC中有1例淋巴结见癌转移。
2.3 免疫表型 ①激素受体及CerbB-2:除2例不表达PR外,所有病例均表现为>50%的肿瘤细胞核ER、PR强阳性(见图4);14例CerbB-2(0),4例CerbB-2(1+)。②肌上皮标记:所有肿瘤细胞均不表达CK5/6、CK14及P63,部分纤维血管轴心周围可见少数肌上皮表达;9例肿瘤细胞巢周围显示完整的肌上皮围绕,5例显示肌上皮部分缺失,4例完全缺失。③神经内分泌标记:Syn阳性13例(见图5),阴性5例,阳性率为72.2%;CgA阳性10例,阴性8例,阳性率为55.6%;表达Syn或CgA者共14例(占77.8%),两者均阴性4例。④增殖指数:Ki-67增殖指数为2%~30%,平均为8.5%。
2.4 HER-2基因检测 3例伴浸润的SPC做了HER-2基因FISH检测。结果显示HER2/CEP17比值均<2.0,且肿瘤细胞平均HER-2基因拷贝数<6.0,表明3例SPC均无HER-2基因扩增(见图6)。
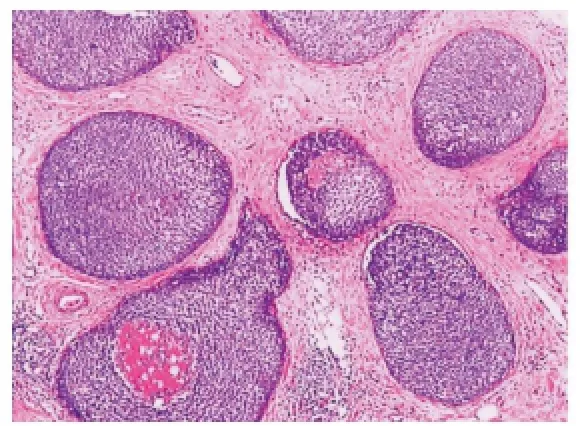
图1 肿瘤由多个边界清楚的富于细胞的结节构成,呈膨胀性生长(HE,×40)
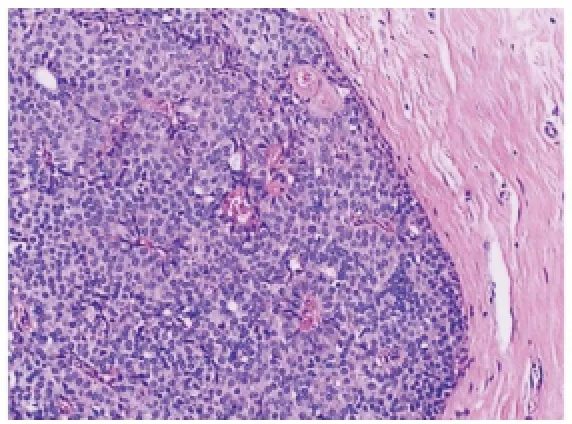
图2 结节中央可见纤细的纤维血管轴心,轴心周围细胞呈栅栏状排列或围绕血管形成假菊形团样结构(HE,×100)

图3 肿瘤细胞之间有黏液分泌,形成黏液湖(HE,×100)
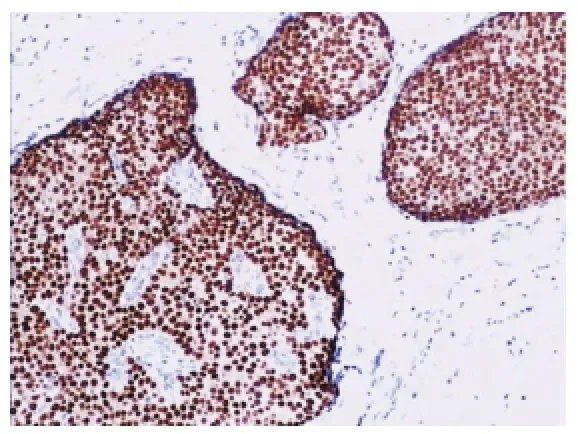
图4 肿瘤细胞ER呈强阳性(EnVision,×100)
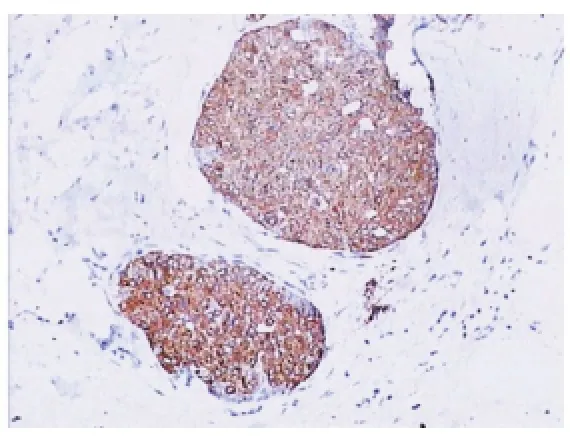
图5 肿瘤细胞Syn呈弥漫阳性(EnVision,×100)
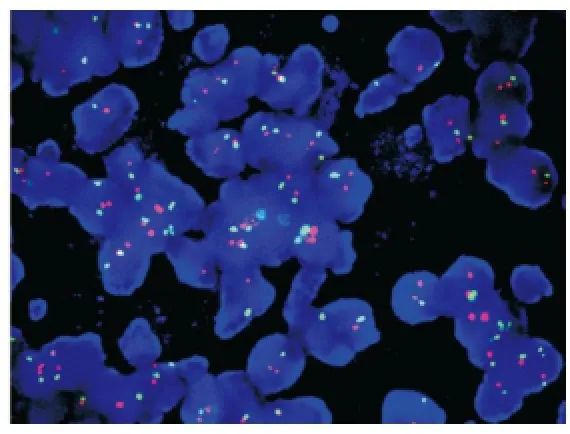
图6 荧光原位杂交示HER-2基因无扩增(FISH,×1 000)
3 讨论
乳腺SPC是一种少见的乳腺癌类型,占乳腺癌的比率小于1%[2]。20世纪80年代曾被称为“神经内分泌型导管内癌”。Rosen等[3]在AFIP乳腺分册中首次将其称为乳头状癌实体变型。1995年Maluf等[4]首先提出了实性乳头状癌的命名。2003年WHO乳腺肿瘤分类将SPC列为“导管内乳头状癌的实体变型”,2012年乳腺肿瘤WHO分类中首次将其定义为独立的疾病,归于乳头状病变中,分为原位SPC和SPC伴浸润。SPC具有显著的病理学特征:肿瘤呈膨胀性生长、具有纤维血管轴心、常伴有黏液分泌和神经内分泌分化[1]。
SPC好发于老年女性,本组18例发病年龄最高82岁,平均62.6岁,中位66岁,这与Nassar等[5]的报道一致,高于文献[6] 报道的乳腺恶性肿瘤的平均发病年龄。伴浸润的SPC平均发病年龄(为61.7岁)略低于原位癌患者(为62.8岁)。患者多以体检发现肿块为主,乳头溢血是突出的临床表现,占所有病例的22.2%(4/18),与文献[7] 报道相符。
本组大体观察肿瘤紧邻乳头,左右侧及各象限乳腺发病率无明显差异。肿瘤大部分表现为界限清楚的结节,切面灰白灰黄,部分区呈囊性或伴出血,以致呈暗红色,质韧偏软,如伴有浸润,通常质地较硬。
组织学上SPC表现为致密排列、富于细胞的膨胀性生长的结节,结节内可见纤细的纤维血管轴心,伴有不同程度的玻璃样变。肿瘤细胞常伴有神经内分泌分化及黏液分泌,但两者均不是诊断所必需[4]。 本组77.8%伴神经内分泌分化,55.6%伴有细胞内外黏液。SPC可以伴有浸润,以伴神经内分泌分化的癌和黏液癌最常见,也可以是非特殊型浸润性乳腺癌和浸润性小叶癌,此时病理诊断应体现浸润癌的范围和具体类型。当肿瘤细胞巢边缘光滑,形似非浸润性,但免疫组织化学染色显示周围肌上皮完全消失时,判断肿瘤是否为浸润是困难的。有观点认为,这是一种具有惰性生物学行为和良好预后的浸润性癌的特殊类型[2]。WHO工作组认为如果浸润不明确,应视为原位癌。只有当不规则的上皮岛形成锯齿状或地图样的轮廓,以及存在促纤维增生间质时才考虑为浸润性[1]。本组3例SPC伴浸润,其中2例为非特殊型浸润性乳腺癌,1例为黏液癌。多项研究[8-9]已经证实,SPC是黏液癌的前驱病变之一,肿瘤细胞 的外翻、黏液外溢及黏液湖形成是SPC转化为黏液癌的关键步骤。
SPC的肿瘤细胞不表达CK5/6和CK14等基底型角蛋白。CK5/6、CK14、P63显示肿瘤性结节周围有连续完整或灶性的肌上皮围绕,部分情况下肌上皮可完全消失。神经内分泌标记如Syn和CgA等的表达有助于SPC的诊断,但并非诊断所必需。ER、PR通常呈强阳性,而CerbB-2呈阴性或弱阳性,FISH检测显示HER-2基因无扩增,Ki-67增殖指数通常较低。基因表达谱分析已经证实SPC属于管腔表型,在转录水平与B型黏液癌相似[10]。显微芯片比较基因组杂交分析显示,与级别相应的ER阳性的非特殊类型浸润性癌相比,SPC具有较低的基因拷贝数量改变和较高的PIK3CA突变频率[11-12]。Duprez等[12]的研究表明,SPC大多具有低级别的组织学分级和较低的P53表达率。这些都提示SPC具有惰性的生物学行为。
需要与SPC鉴别的病变有:①导管内乳头状癌:2012版乳腺肿瘤WHO分类把SPC从导管内乳头状癌的亚型中分出,作为乳头状肿瘤的一种特殊类型。SPC与导管内乳头状癌都属于乳腺乳头状病变,具有相似的形态学特点,两者都由单一的细胞组成,缺少肌上皮细胞,其结构和细胞学特征大多符合低核级癌。但两者又有着本质的区别,导管内乳头状癌为原位癌,通常具有纤细的分枝状乳头,也可形成微乳头及筛状结构;而SPC可分为原位癌和浸润性癌,肿瘤呈实性膨胀性生长,可见纤细的纤维血管间隔,而无明显的乳头出现,且常伴有细胞内或细胞外黏液,免疫组织化学染色显示神经内分泌标记阳性,这些都可以与导管内乳头状癌鉴别。②导管内乳头状瘤:尤其是外周型导管内乳头状瘤,瘤细胞通常累及终末导管小叶单位,形成结节状肿瘤轮廓,与SPC相似,两者均可见到纤维血管轴心。但前者可见宽大钝圆的乳头结构,且免疫组织化学染色显示血管轴心周围有较多肌上皮围绕,肿瘤细胞可以表达CK5/6和CK14,这些都与SPC不同。③旺炽型普通型导管增生:增生的上皮细胞可以呈实性生长,细胞核卵圆形,流水样或合体样排列,与SPC相似。但前者上皮细胞间混杂肌上皮细胞,缺乏SPC肿瘤细胞的均一性和黏液分泌,且上皮细胞表达CK5/6和CK14,而不表达神经内分泌标记,这些都可以和SPC相鉴别。
SPC的治疗原则是外科手术的完整切除[7]。Sprague等[13]认为保乳手术联合放疗及他莫昔芬治疗原位癌能够达到与乳腺切除术相同的无瘤生存时间。单纯原位SPC完整切除后尚无腋窝淋巴结转移和局部复发的报道[4-5]。伴有浸润的SPC可发生淋巴结转移,仅有少数术后局部复发的报道[5],其治疗和预后依赖于浸润性癌的成分。Nassar等[5]报道的1例伴有印戒样细胞特征的SPC术后10年死于“转移性印戒细胞癌”。有研究表明,与其他具有相同分级和分期的乳腺癌相比,伴浸润的SPC具有更长的无瘤生存时间[12]。本组获得随访的17例患者随访至今均无瘤生存,未见肿瘤复发或转移,表明SPC具有良好的预后。
[1] Lakhani SR,Ellis LO,Schnitt SJ,et al.WHO classification of tumors of the breast[M] .Lyon: IARC Press,2012: 108-109.
[2] Rakha EA,Gandhi N,Climent F,et al.Encapsulated pap-illary carcinoma of the breast: an invasive tumor with excel-lent prognosis[J] .Am J Surg Pathol,2011,35(8): 1093-1103.
[3] Rosen PP,Oberman HA.Tumors of the mammary gland (Atlas of tumor pathology)[M] .3rd Series,Washington DC: AFIP,1994: 158-160.
[4] Maluf HM,Koerner FC.Solid papillary carcinoma of the breast.A form of intraductal carcinoma with endocrine dif-ferentiation frequently associated with mucinous carcinoma [J] .Am J Surg Pathol,1995,19(11): 1237-1244.
[5] Nassar H,Qureshi H,Adsay NV,et al.Clinicopathologic analysis of solid papillary carcinoma of the breast and asso-ciated invasive carcinomas[J] .Am J Surg Pathol,2006,30 (4): 501-507.
[6] 卢星梅,鲍方,姬秀焕,等.乳腺恶性肿瘤的病理类型和年龄分布比较分析[J] .温州医学院学报,2012,42(4): 350-353.
[7] Saremian J,Rosa M.Solid papillary carcinoma of the breast: a pathologically and clinically distinct breast tumor[J] .Arch Pathol Lab Med,2012,136(10): 1308-1311.
[8] Kryvenko ON,Chitale DA,Yoon J,et al.Precursor lesions of mucinous carcinoma of the breast: analysis of 130 cases [J] .Am J Surg Pathol,2013,37(7): 1076-1084.
[9] Oh EJ,Koo JS,Kim JY,et al.Correlation between solid papillary carcinoma and associated invasive carcinoma ac-cording to expression of WT1 and several MUCs[J] .Pathol Res Pract,2014,210(12): 953-958.
[10] Weigelt B,Geyer FC,Horlings HM,et al.Mucinous and neuroendocrine breast carcinomas are transcriptionally dis-tinct from invasive ductal carcinomas of no special type[J] .Mod Pathol,2009,22(11): 1401-1414.
[11] Piscuoglio S,Ng CK,Martelotto LG,et al.Integrative ge-nomic and transcriptomic characterization of papillary carci-nomas of the breast[J] .Mol Oncol,2014,8(8): 1588-1602.
[12] Duprez R,Wilkerson PM,Lacroix-Triki M,et al.Immuno-phenotypic and genomic characterization of papillary carci-nomas of the breast[J] .J Pathol,2012,226(3): 427-441.
[13] Sprague BL,McLaughlin V,Hampton JM,et al.Disease-free survival by treatment after a DCIS diagnosis in a pop-ulation-based cohort study[J] .Breast Cancer Res Treat,2013,141(1): 145-154.
(本文编辑:胡苗苗)
Clinicopathological features of solid papillary carcinoma of the breast
LUO Huarong,XU Cheng,ZHENG Haihong,WENG Shouxiang,GAN Meifu.
Department of Pathology,Taizhou Hospital Affiliated to Wenzhou Medical University,Taizhou,317000
Objective:To investigate the clinicopathological features of solid papillary carcinoma (SPC) of the breast.Methods:A study was performed to analyse the clinical and pathological manifestations in 18 cases of SPC.Immunohistochemical staining for ER,PR,CerbB-2,Ki-67,CK5/6,CK14,P63,Syn and CgA was performed.And the expression of HER-2 gene amplification was detected by fluorescence in situ hybridization.Results:All the tumors presented as a palpable,centrally located mass or as bloody nipple discharge.Histologically,the tumor was comprised of multiple circumscribed expansile nodules with delicate fibrovascular cores.55.6% of these tumors had extracellular or intracellular mucin and 16.7% was associated with invasive carcinoma.Immunohistochemically,all tumor cells were strongly positive for ER and PR.CerbB-2 was negative in the most cases except for 4 cases with weak expression.All cases were negative for CK5/6,CK14 and P63 in the cellular nodules.Peripheral myoepithelium was complete in 9 cases,discontinued in 5 cases and loss in 4 cases.The positive expression rates of Syn and CgA were 72.2% and 55.6%,respectively.The average positive rate of Ki-67 in tumor cells was 8.5%.None of 3 cases with invasion had HER-2 gene amplification.One of 17 cases with axillary lymph node dissection or sentinel lymph node biopsy had axillary lymph node metastasis at operative time.And none of 17 patients (94.4%) followed up had tumor recurrence and metastasis.Conclusion:SPC is a rare breast cancer,predominantly found in elderly females,with distinctive histological morphology and immunophenotype.Clinicopathological features and follow-up data suggest that SPC often carries an indolent clinical behavior and favorable prognosis.
breast neoplasms; solid papillary carcinoma; pathology; immunohistochemistry
R737.9
B
10.3969/j.issn.2095-9400.2015.05.011
2014-08-07
罗华荣(1980-),男,浙江台州人,主治医师。

