一种简单的毛细管色谱柱电加热装置的制作方法及其在液相色谱-质谱联用系统中的应用
金祖耀, 吕雅瑶, 周珊珊, 郝斐然, 付 斌,应万涛, 钱小红, 张养军*
(1. 安徽医科大学,安徽 合肥230032;2. 蛋白质组学国家重点实验室,北京蛋白质组研究中心,军事医学科学院放射与辐射医学研究所,北京102206)
随着蛋白质组学研究的深入,毛细管高效液相色谱-质谱联用技术已经成为蛋白质、蛋白质组定性鉴定和定量分析的常用分析方法[1]。由于生物样品中蛋白质种类繁多、动态范围宽,难于实现蛋白质组的深度覆盖,特别是难于实现低丰度蛋白质的定性鉴定和定量分析,而与疾病相关的蛋白质标志物通常丰度较低,因此发展高灵敏度和高通量的液相色谱-质谱联用方法显得非常迫切。降低生物样品复杂程度最有效的方法之一是采用高效液相色谱法对其进行分离,但如果不能有效分离,排除基质的干扰,定量结果将会受到很大的影响,产生“压缩效应”。因此建立高效的液相色谱分离技术对蛋白质组的定性和定量尤为重要[2,3]。
目前,为了实现对复杂生物样品的高效分离,采用更长的毛细管色谱柱[4,5]或更小粒径的颗粒填料[6-8],如亚2 μm 反相色谱填料,已经成为解决这些问题的重要手段之一。但是,使用更长的毛细管色谱柱或装填更小粒径的颗粒填料,会造成色谱柱的柱压显著升高,这是制约其应用的瓶颈问题。虽然现在已有的商品化超高效微升和纳升级毛细管色谱仪可以提供很高的流动相输出压力,有效地解决毛细管色谱柱柱压高的问题,但在超高压色谱柱条件下运行时,毛细管色谱仪的不同连接部位常常出现漏液现象,因而造成分析进程中断,样品浪费。因此,如何降低毛细管色谱柱的反向柱压,就成为目前毛细管高效液相色谱-质谱联用技术用于蛋白质、蛋白质组定性鉴定和定量分析的主要问题之一。
为了有效解决采用长毛细管色谱柱或装填更小颗粒填料时反向柱压太高的问题,提高色谱柱的使用温度是一种可行的手段。温度升高,流动相的黏度降低,不仅降低了溶质在流动相和固定相之间的传质阻力,提高色谱柱分离的柱效,而且系统的压力会随着温度的升高而降低[9,10]。早在20 世纪80 年代后期,高温液相色谱技术就得到研究人员的高度重视[11]。1987 年,Warren[12]验证了温度对反相液相色谱柱柱效的影响。1988 年,Horvath 等[13]通过对高效液相色谱分离过程中溶质输运特征的理论分析,认为提高色谱柱的柱温是提高其分离能力的有效途径之一。Yan 等[14]在研究高温快速分离时,考察了系统压力随着温度的变化情况,证实随着温度的升高,系统压力逐渐降低。Yang 等[15]探讨了温度对塔板高度的影响,并且建立了温度与塔板高度的数学关系。成洪达等[16]就温度对高效液相色谱分离性能的影响进行了全面的总结。2011 年,Rogeberg等[17]将C18-硅胶杂化整体柱用于蛋白质酶解液的液相色谱分离时,考察了温度对分离效率的影响。实验将温度从20 ℃升到120 ℃,发现硅胶整体柱可以通过升高温度来提高分离效率。以上研究工作都表明一定范围内提高色谱柱温度有利于提高色谱柱的分离性能。
对于电喷雾离子源质谱,电喷雾离子源外的毛细管色谱柱可采用毛细管色谱仪自带的柱温箱实现加热。为了减小毛细管色谱柱的柱后效应,提高色谱分离度和电喷雾离子源的雾化效率,在大多数液相色谱-质谱联用系统的电喷雾离子源内,选用并安装带直喷头的毛细管色谱柱(直喷毛细管色谱柱),并通过联通件(如四通、三通或二通等)将其余色谱系统和高压电极连接。但由此带来的问题是不易实现对直喷毛细管色谱柱的加热。虽然也有带加热套并已经商品化的直喷毛细管色谱柱,但都是一次性的,不能重复使用,使其使用成本显著升高。基于此,我们发展了一种简单的毛细管色谱柱电加热装置的制作方法,可方便在电喷雾源内实现对毛细管色谱柱的加热。所研发的电加热装置制作简单,价格低廉,操作方便,适用于毛细管高效液相色谱(cHPLC)与不同类型电喷雾源质谱联用时毛细管色谱柱的加热,在基于液相色谱-质谱联用技术的蛋白质和蛋白质组研究和应用中有广阔的应用前景。
1 实验部分
1.1 仪器、试剂与材料
毛细管高效液相色谱-电喷雾-线性离子阱质谱仪(HPLC-ESI-LTQ MS,美国Thermo Fisher Scientific 公司);RIGOL L-3000 高效液相色谱仪(北京普源精电科技有限公司);Eksigent nanoLC-2D 高效液相色谱仪(美国AB SCIEX 公司);真空冰冻干燥机(SC100A Speedvac Plus,美国Thermo Savant公司);Sartorius BP211d 分析天平(瑞士Sartorius公司);高速离心机(美国Thermo Fisher Scientific公司);JY-II 超声波细胞粉碎机(宁波新芝生物科技股份有限公司);C18 zip tip 脱盐柱、超滤管(10 kDa)和Milli2QA10 型纯水仪(美国Millipore 公司);可调直流电源(EPS 301,Amersham Pharmacia Biotech 公司);直径为0.1 mm,电阻为200 Ω的镍(20%)铬(80%)合金电阻丝(上海靓凡电器有限公司);内径为530 μm、外径为690 μm 和内径为1.1 mm、外径为2.6 mm 的毛细管(郑州英诺高科有限公司);15 cm×75 μm 的直喷头空管柱(美国New Objective 公司);直径为3 μm,孔径为10 nm的C18 填料(北京金欧亚公司)。
酵母细胞由清华大学戴俊彪实验室赠送;尿素(urea)购于Affymetnx 公司;Tris-HCl(1 mol/L,pH 8.0)、去垢剂NP-40 购于United States Biochemical 公司;乙二胺四乙酸二钠(EDTA 钠盐)购于国药集团化学试剂有限公司;蛋白酶抑制剂购于罗氏公司;二硫苏糖醇(DTT)、碘乙酰胺(IAA)、碳酸氢铵、乙腈(ACN)购于美国Sigma 公司;测序级胰蛋白酶购于美国Promega 公司;牛血清白蛋白(BSA)购于北京迪拜尔生物技术有限公司;实验用水为超纯水,经Millipore 纯水系统纯化,电阻率达到18.2 MΩ·cm。
1.2 实验方法
1.2.1 毛细管色谱柱电加热装置的制作方法
为了实现对实验中使用的15 cm×75 μm 直喷毛细管色谱柱进行加热,我们选取内径为530 μm、外径为690 μm 的毛细管(内径大于毛细管色谱柱),在其外表面缠绕直径为0.1 mm 的镍铬电阻丝,然后在缠绕电阻丝毛细管的外表面套上内径1.1 mm、外径为2.6 mm 的毛细管,用绝缘胶布固定毛细管两端并留出一定长度的电阻丝。通过两根连接线分别将电阻丝的两端与可调直流电源的正、负极连接,在24 V 安全电压条件下采用调节电流方式调节电加热管的温度,进而提高毛细管色谱柱的温度。
1.2.2 样品前处理
酵母蛋白质的提取及酶切方法如下。将酵母细胞在14 000 g 下离心5 min 后弃上清液,加入裂解液NETN(0.5% (v/v)NP-40,100 mmol/L NaCl,20 mmol/L Tris-HCl,1 mmol/L EDTA 钠盐)及蛋白酶抑制剂进行超声破碎,破碎后于14 000 g 下离心20 min 后取上清液,分装到孔径为10 kDa 的超滤管中,在14 000 g 下离心15 min。加入8 mol/L尿素,在14 000 g 下离心15 min(重复一次)。再加入50 mmol/L NH4HCO3,在14 000 g 下离心15 min(重 复 二 次)。离 心 后 加 入 50 mmol/L NH4HCO3,再加入DTT(终浓度10 mmol/L),37℃水浴中孵育4 h。再加入IAA (终浓度50 mmol/L),避光反应1 h 后按照酶与蛋白质的质量比为1 ∶50 加入胰蛋白酶,在37 ℃下酶切18 h。酶切后在14 000 g 下离心15 min,将所得溶液干燥后用流动相A(含2% 乙腈和0.1% 甲酸(FA)的水溶液)重溶,终浓度为1 μg/μL。
BSA 的酶切方法如下。BSA 用50 mmol/L NH4HCO3溶解,终浓度1 μg/μL。加入DTT(终浓度10 mmol/L),37 ℃水浴中孵育4 h。再加入IAA(终浓度50 mmol/L),避光反应1 h。然后按照酶与蛋白质质量比为1 ∶50 加入胰蛋白酶,在37 ℃下酶切18 h,脱盐,干燥后用流动相A 重溶,终浓度为1 μg/μL。
1.2.3 RIGOL 液相色谱分析条件
将Agela Venusil XBP C18 (L)色谱柱(250 mm×4.6 mm,5 μm,15 nm)安装在RIGOL L-3000 液相色谱仪上。检测波长为214 nm,流速为0.7 mL/min;流动相A 是含2% ACN 和0.1% FA 的水溶液,流动相B是含98% ACN 和0.1% FA 的水溶液。洗脱梯度为:0~5 min,5%B ~8%B;5 ~26 min,8% B ~18% B;26~40 min,18%B ~32%B;40 ~42 min,32% B ~95%B;42 ~47 min,95% B;47 ~49 min,95% B ~5%B;49 ~55 min,5% B。
1.2.4 cHPLC-MS/MS 分析条件
毛细管液相色谱仪为Eksigent nanoLC-2D,毛细管反相色谱柱为实验室自行制备,配直喷头空管柱(15 cm×75 μm),C18 填料粒径为3 μm,孔径为10 nm,分离流速为300 nL/min,样品上样体积为5 μL。流动相A 和流动相B 与1.2.3 节相同。短洗脱梯度为:0 ~5 min,5% B ~8% B;5 ~30 min,8%B ~40% B;30 ~35 min,40% B ~95% B;35 ~40 min,95% B;40 ~42 min,95% B ~5% B;42 ~52 min,5% B。长洗脱梯度为:0 ~5 min,5% B ~8%B;5 ~91 min,8% B ~40% B;91 ~110 min,40%B ~95% B;110 ~120 min,95% B;120 ~125 min,95% B ~5% B;125 ~135 min,5% B。质谱条件:选用正离子模式采集数据,质谱扫描范围为m/z 400.0 ~1 600.0,采集时间分别设为52 min 和135 min。在采用数据依赖(DDA)模式进行串联质谱分析时,选取一级质谱中10 个信号最强的离子进行二级质谱分析,其碰撞能量设为35 eV,采用动态排除(dynamic exclusion)功能,排除时间为30 s。
1.2.5 数据库搜索
将质谱采集后产生的raw 文件通过Thermo Proteome Discoverer(1.3.0.339 版本)内置的Mascot 数据检索软件进行检索。参数设置:母离子质量偏差(precursor tolerance)为0.5 Da;碎片离子质量偏差(fragment tolerance)为0.8 Da;肽段的假阳性率(FDR)为1%;蛋白质酶解选用胰蛋白酶,选择2 个漏切位点;固定修饰设置为半胱氨酸的烷基化修饰;可变修饰设置为甲硫氨酸氧化修饰;蛋白质数据库分别为牛血清白蛋白数据库(2014 年12 月30 日从http://www.ncbi.nlm.nih.gov/protein/?term =bsa下载)和酵母蛋白质数据库(1 741 650 个蛋白质,2014 年12 月26 日从http://www. ncbi. nlm. nih.gov/protein/?term=yeast 下载)。
2 结果与讨论
2.1 色谱柱温度对柱压和柱效的影响
当温度升高时,流动相黏度降低,从而降低色谱柱的柱压。另外,由van Deemter 方程H=A+B/u+Cu(H 为理论塔板高度,u 为流动相线速度,A 为径向扩散系数,B 为纵向扩散系数,C 为传质阻力系数)可知,流动相的黏度降低会使流动相和溶质分子扩散增强,既加快了流动相和分析物分子的混合,也增加溶质的传质速度,进而增加溶质与固定相作用的概率,从而提高了色谱柱的柱效。尽管从van Deemter 方程可以得到这些结论,但温度对色谱柱柱压和柱效的影响程度目前没有确切的数据。为了考察色谱柱的温度升高时柱压降低和柱效增加的程度,我们首先在带有易于控制温度的柱温箱的RIGOL L-3000 液相色谱仪上,考察了BSA 酶切肽段混合物在分析型色谱柱上分离时,温度对其柱压和柱效的影响。分别选定不同温度下不进样以及上样量为10 μg BSA 酶切肽段进行色谱实验。如图1所示,当柱温从25 ℃升高到70 ℃时,色谱柱反向压力从8.27×106Pa 降低到4.48×106Pa,降低了46%。我们统计不同柱温下分离10 μg BSA 酶切肽段混合物时的峰容量,由表1 可以看出,当柱温从25 ℃升高到70 ℃时,其峰容量从63 个色谱峰上升到71 个色谱峰,增加了8 个色谱峰。在一定范围内,柱效随着柱温升高而增加。该实验结果表明升高色谱柱的温度可显著降低柱压,柱效也略有提高。
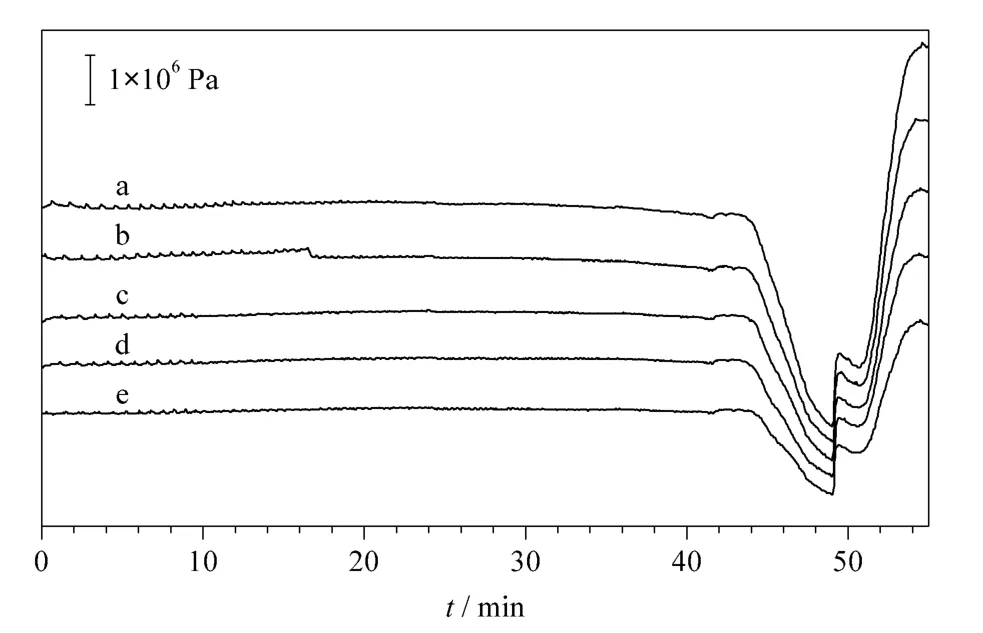
图1 不同温度下空白的柱压随时间的变化Fig.1 Change of the column pressure of a blank sample over time at different temperatures
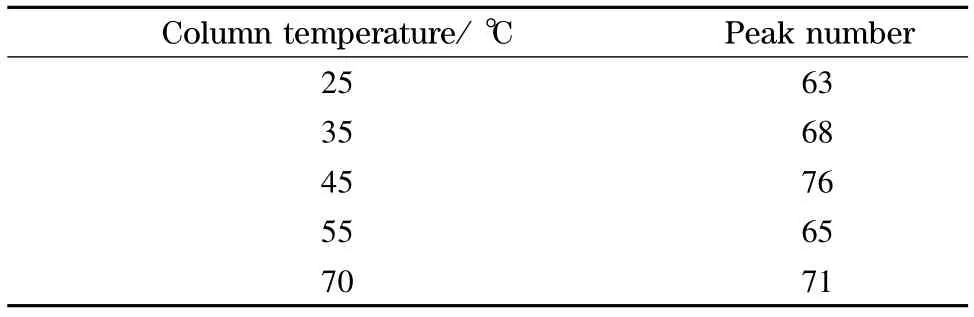
表1 不同柱温下分离10 μg BSA 酶切肽段混合物时的峰容量Table 1 Peak capacity of 10 μg BSA digestion separated at different column temperatures
2.2 毛细管色谱柱电加热装置的制作及应用
基于上述色谱柱温度对柱压及柱效影响程度的考察结果,我们发展了一种简单的毛细管色谱柱电加热装置制作方法,并将该装置与质谱仪、毛细管色谱仪进行连接,构成液相色谱-质谱联用系统。如图2 所示,毛细管内部温度不易测定,但根据焦耳定律,在电阻恒定的条件下,电流越大产生的热量越大;时间越长产生的热量越多。在对毛细管色谱柱加热过程中,流动相会带走产生的部分热量,达到一定的平衡。因此,在可调直流电源的输出小于或等于24 V 的情况下,通过改变输出电流来调节内部毛细管的温度,以达到降低毛细管色谱柱柱压和增加柱效的目的。
2.3 毛细管色谱柱电加热装置的性能评价
为了测定毛细管色谱柱温度升高时对柱压及柱效的影响程度,我们采用实验室装填的带喷头的毛细管色谱柱进行实验。在电加热装置上分别施加0、60、80、100、120、140 和160 mA 电流,对牛血清白蛋白酶切肽段混合物进行HPLC-ESI-LTQ MS 分析,并重复实验一次。
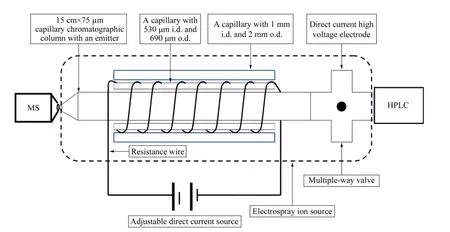
图2 毛细管色谱柱电加热装置及与质谱联用示意图Fig.2 Schematic diagram of an electric heating apparatus for heating capillary chromatographic columns coupled to mass spectrometry
当电加热装置上施加不同电流分离BSA 酶切肽段混合物时,色谱柱柱压随电流的变化如图3 所示。可以看出,电流从0 mA 升高至160 mA 时,柱压从1.24×107Pa 下降到4.83×106Pa,降低幅度接近61%。
对电加热装置施加100 mA 电流,重复分离BSA 酶切肽段混合物,考察该电加热装置的重复性,基峰色谱图如图4 所示。由分离结果看出色谱保留时间基本一致,表明我们制作的电加热装置性能稳定。我们将施加不同电流条件下的两次实验结果进行统计,基峰色谱图中的色谱峰宽取平均值(Wh),根据公式Pc=1+[(2.35/4)(t/Wh)]算出峰容量。其中Pc为峰容量,t 为有效梯度的时间,Wh为峰宽的平均值。由表2 可以看出,当电流从0 mA升高到100 mA 时,BSA 酶切肽段混合物的峰容量从51 个色谱峰上升到68 个色谱峰,增加了17 个色谱峰;而当电流增加到160 mA 时峰容量下降到25个色谱峰,表明在一定电流范围内柱效随着柱温升高而提高。
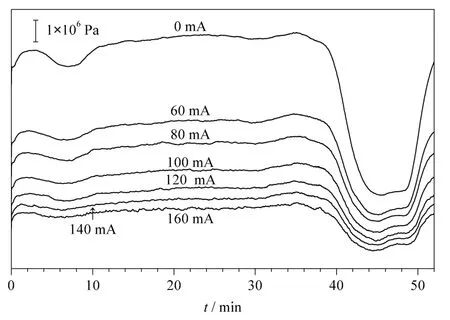
图3 在电加热装置上施加不同电流时毛细管色谱柱分离BSA 酶切肽段混合物时柱压的变化曲线Fig.3 Chromatographic column back pressure curves when separating BSA digestions on a capillary chromatographic column heated by the electric heating apparatus at different electric currents
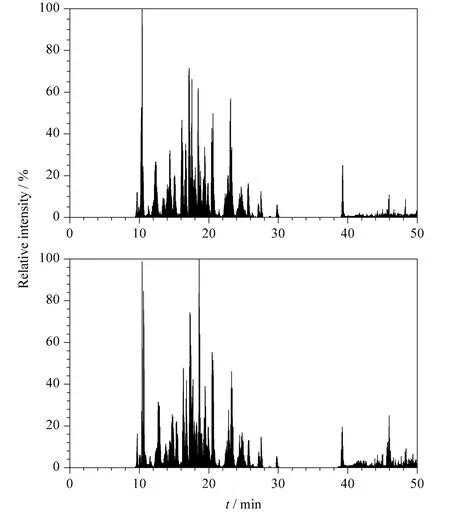
图4 电加热装置上施加100 mA 电流时重复分离BSA酶切肽段混合物的基峰色谱图Fig.4 Base peak chromatograms of BSA digestion repeatedly separated with the electric heating apparatus at electric current of 100 mA
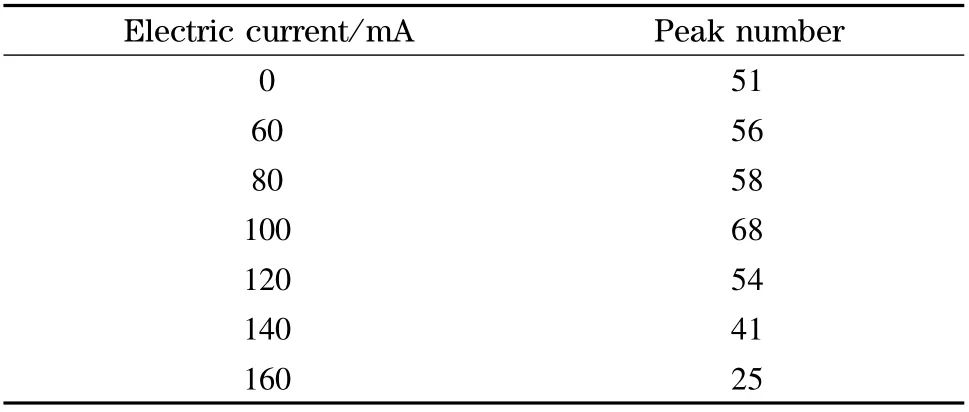
表2 不同电流下分离BSA 酶切肽段混合物的色谱峰容量Table 2 Peak capacity of BSA digestion separated at different electric currents
将所得质谱数据经过Mascot 搜库后,对不同电流下分离鉴定BSA 酶切肽段混合物时的肽段数及覆盖率进行统计,将两次实验结果取平均值后做折线图,结果如图5 所示。电流从0 mA 升到100 mA 电流的过程中,肽段数基本维持在44 个左右,覆盖率从72% 增加到90%;当电流增加到140 mA时,肽段数略有下降;而当电流增加到160 mA 时肽段数下降到20 个,覆盖率降低到34%。另外,我们提取了部分电流(0 mA、100 mA、160 mA)时的基峰色谱图,如图6 所示。当加上电流,即加热后色谱峰的出峰时间有所提前;但当电流增加到160 mA 时,色谱峰过度分散且信号强度降低。这可能是流动相因温度过高气化所致,因此,分离时应选择最佳柱温,即最佳电流。
综上可以看出,在BSA 酶切肽段混合物进行LC-ESI-MS/MS 分析时,利用毛细管色谱柱电加热装置可以有效地降低柱压,选择最佳电流可在一定程度上提高柱效。
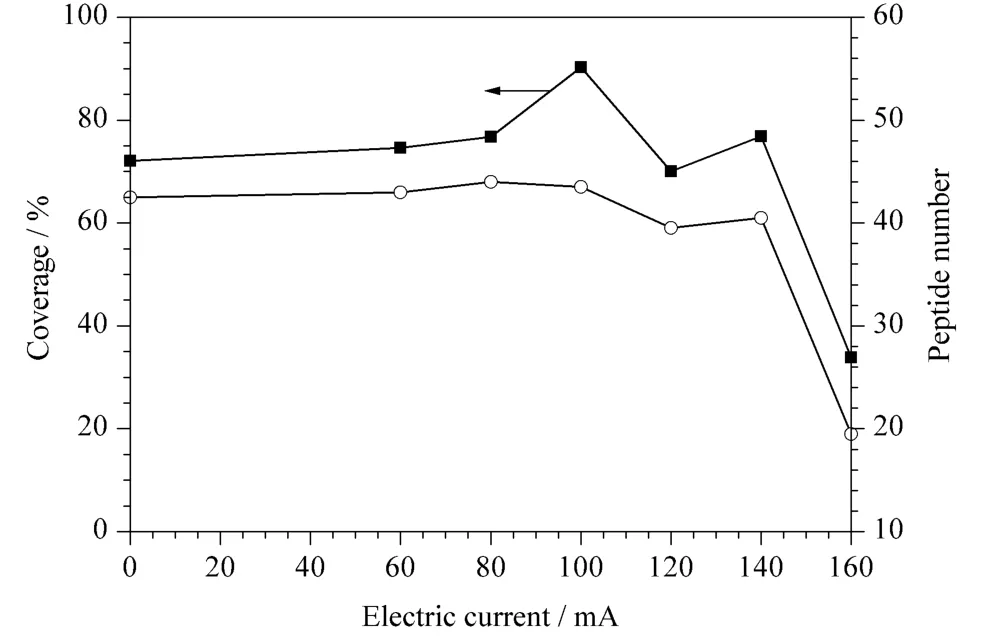
图5 电加热装置施加不同电流时鉴定的BSA 酶切肽段混合物中的肽段数及覆盖率Fig.5 Peptide number and coverage of BSA digestion with the electric heating apparatus at different electric currents
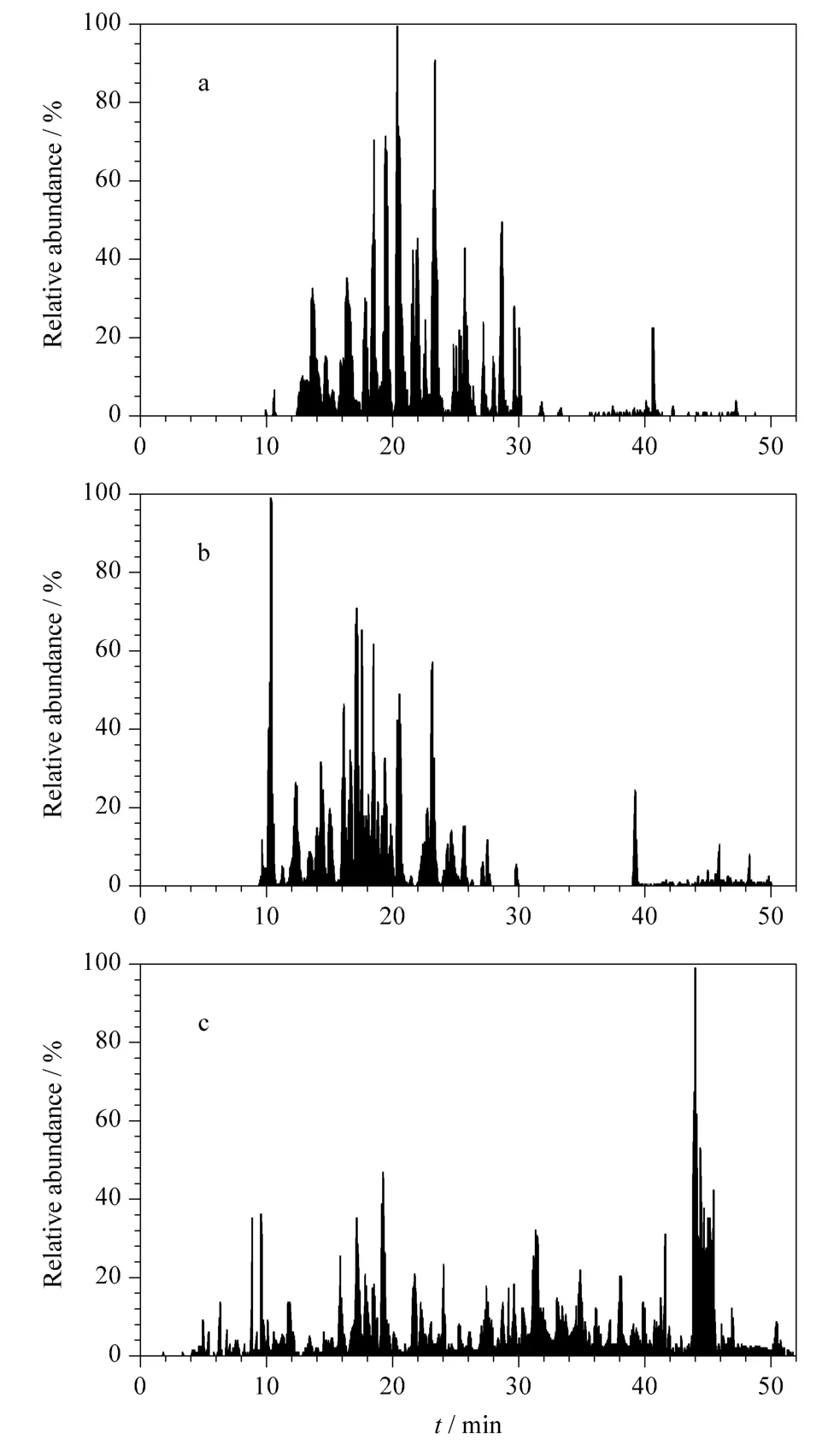
图6 电加热装置分别施加电流(a)0 mA、(b)100 mA 和(c)160 mA 时分离BSA 酶切肽段混合物的基峰色谱图Fig.6 Base peak chromatograms of BSA digestion separated with the electric heating apparatus at electric currents (a)0 mA,(b)100 mA and (c)160 mA
2.4 复杂样本分析中的应用
为了对毛细管电加热装置的性能进行进一步的评价,我们将其应用到酵母蛋白质组表达谱的分析中。将酵母细胞提取的蛋白质酶切后,直接在装有毛细管电加热管的cHPLC-MS/MS 仪器上进行分析,电流分别设置为0 mA 和100 mA,实验重复一次。图7 是对电加热装置施加100 mA 电流分离酵母蛋白质酶切肽段混合物时两次重复实验的基峰色谱图,由分离结果看出色谱保留时间基本一致,表明我们制作的电加热装置具有稳定的性能。
电流为0 mA 和100 mA 条件下分离酵母蛋白酶切肽段混合物时,柱压随时间变化曲线如图8 所示。可以看出,在0 mA 电流条件下,柱压约为1.38×107Pa;在100 mA 电流条件下,柱压约为6.90×106Pa,降低了50%。
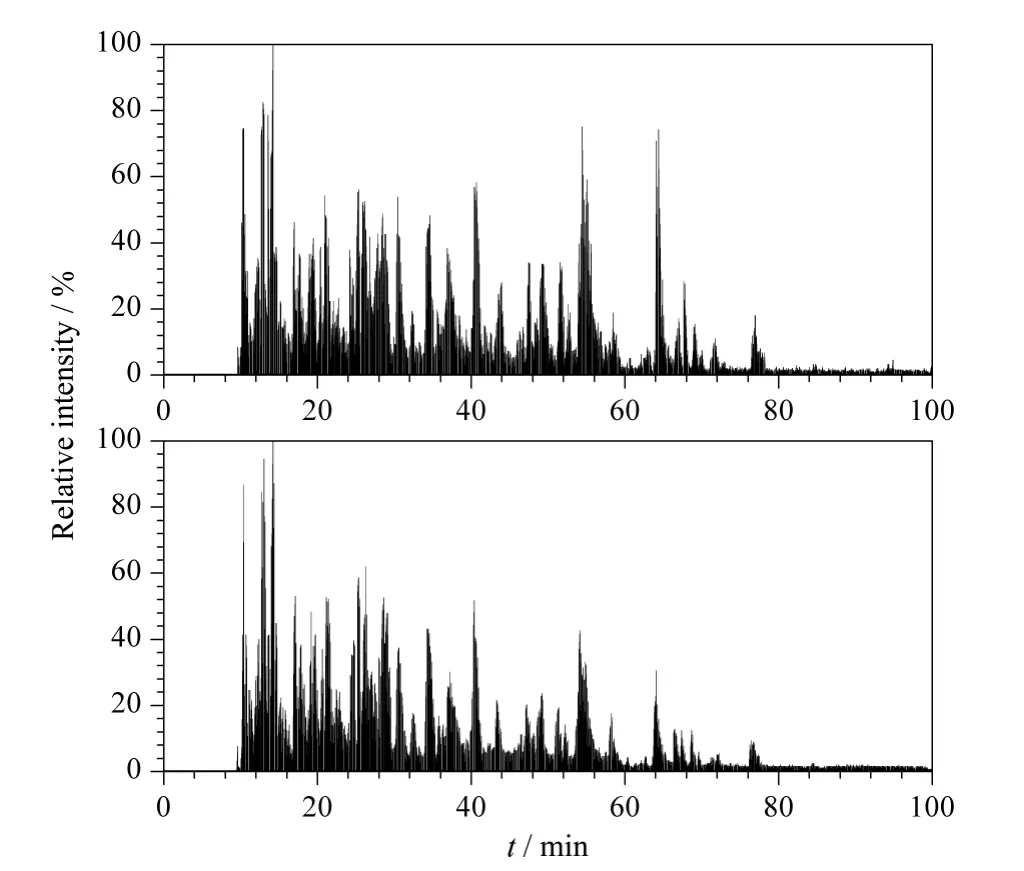
图7 电加热装置上施加100 mA 电流时重复分离酵母酶切肽段混合物的基峰色谱图Fig.7 Base peak chromatograms of yeast digestion repeatedly separated with the electric heating apparatus at electric current of 100 mA
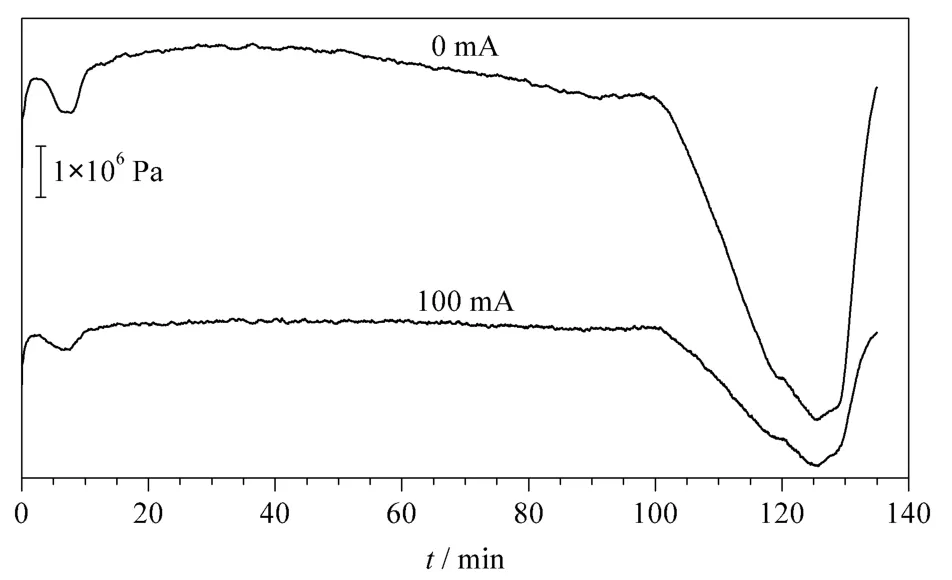
图8 电加热装置分别施加0 mA 和100 mA 电流时酵母酶切肽段混合物分离的柱压随时间变化的曲线Fig.8 Chromatographic column back pressure curves to time for separating yeast digestion with the electric heating apparatus at the electric currents 0 mA and 100 mA
我们提取了0 mA 及100 mA 电流下酵母蛋白质酶切混合物分离的基峰色谱图(见图9),将两次实验结果所得基峰色谱图中的色谱峰峰宽进行统计,根据上述相同方法计算峰容量,当电流从0 mA升高到100 mA 时,峰容量从63 个色谱峰上升到81个色谱峰,增加了18 个色谱峰,表明增加加热电流(即柱温)可使柱效略有增加。
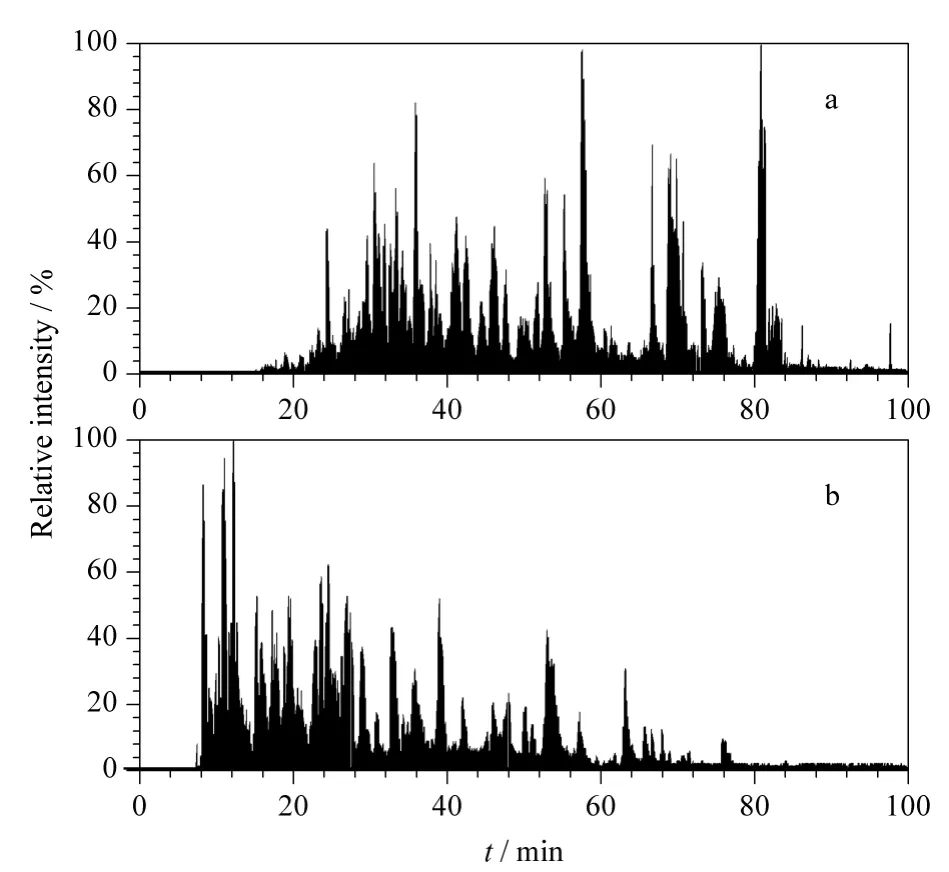
图9 电加热装置分别施加(a)0 mA 和(b)100 mA 电流时分离酵母酶切肽段混合物的基峰色谱图Fig.9 Base peak chromatograms of yeast digestion separated with the electric heating apparatus at the electric currents (a)0 mA and(b)100 mA
由图9 还可看出,电流为100 mA 时,色谱峰保留时间提前,与分离BSA 肽段混合物时的结果一致。将所得质谱数据进行Mascot 搜库,两次实验所得结果取均值,结果如图10 所示。由图10 可以看出,施加电流后从酵母蛋白酶切肽段混合物中鉴定到的蛋白质数量从145 个增加到154 个,肽段数量从292 个增加到310 个。无论是蛋白数还是肽段数皆有所增加,这与标准蛋白质分离时的趋势相同,进一步证实了毛细管色谱柱电加热装置对柱压的降低和柱效的提高有一定作用。这些结果表明,我们发展的毛细管色谱柱电加热装置制作方法,可为液相色谱-质谱联用系统的电喷雾离子源内直喷毛细管色谱柱加热提供一种简单、可靠的装置,为选择使用更小粒径的色谱颗粒填料提供了一种降低柱压的有效手段。
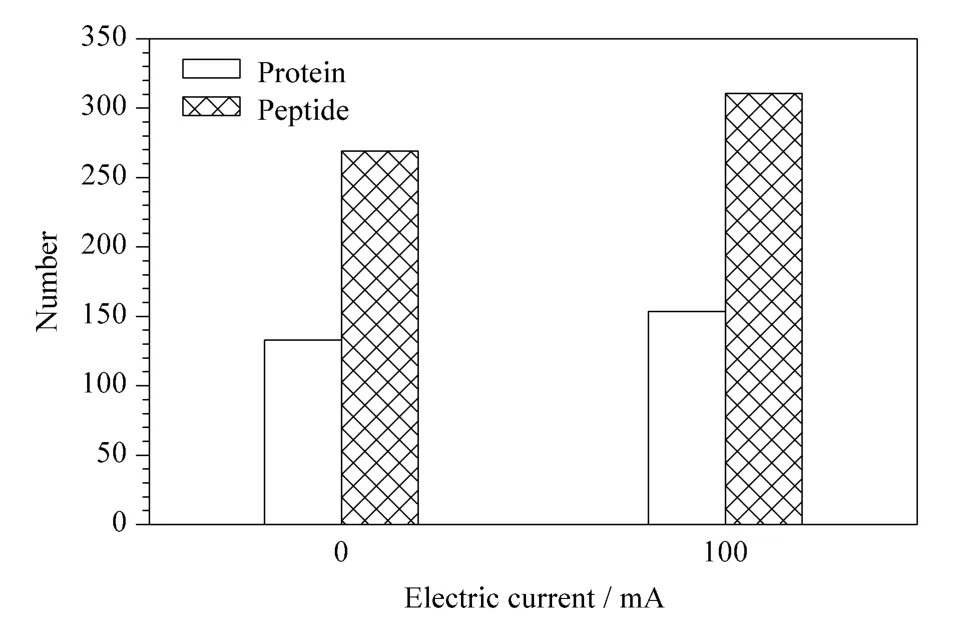
图10 电加热装置施加不同电流时酵母酶切肽段混合物的鉴定结果Fig.10 Identification of the yeast digestion with the electric heating apparatus at different electric currents
3 结论
本文发展了一种简单的毛细管色谱柱电加热装置的制作方法,并将基于该方法制作的毛细管色谱柱电加热装置与cHPLC-MS/MS 联用,分别用于牛血清白蛋白酶切肽段混合物和酵母蛋白酶切肽段混合物的分离,从柱压和柱效两方面来对该装置进行了性能评价。实验结果表明,无论对简单的还是复杂的生物样本,毛细管柱电加热管与小粒径填料的毛细管柱联用在100 mA 电流下分离酶切肽段,其柱压比不加电流分离时降低50% 左右,而且柱效也相应地有所增加。这为我们发展和选择在低柱压条件下的更小颗粒填料毛细管色谱柱奠定了基础。
[1] Aebersold R,Mann M. Nature,2003,422(6928):198
[2] Lenz C,Urlaub H. Expert Rev Proteomics,2014,11(4):409
[3] Huuang J F,Wang F J,Ye M L,et al. J Chromatogr A,2014,1372C:1
[4] Zhou F,Lu Y,Ficarro S B,et al. Nat Commun,2013,4:2171
[5] Wang H,Yang Y,Li Y,et al. J Proteome Res,2015,14(2):829
[6] Bruns S,Frabklin E G,Grinias J P,et al. J Chromatogr A,2013,1318:189
[7] DOrazio G,Rocco A,Fanali S. J Chromatogr A,2012,1228:213
[8] Burgess M W,Keshishian H,Mani D R,et al. Mol Cell Proteomics,2014,13(4):1137
[9] Scott Kephart T,Dasgupta P K. Talanta,2002,56(6):977
[10] Fu Y,Chen N W. China Measurement Technology (富玉,陈能武. 中国测试技术),2007,33(3):36
[11] Liu G H. Natural Gas Chemical Industry (刘光会. 天然气化工),2000,25(6):46
[12] Warren F V. Anal Chem,1988,60(24):2821
[13] Anita F D,Horvath C. J Chromatogr,1988,435(1):1
[14] Yan B,Zhao J. Anal Chem,2000,72(6):1253
[15] Yang Y. Anal Chim Acta,2006,558(1/2):7
[16] Cheng H D,Xing Z F,Li T,et al. Fujian Analysis & Testing (成洪达,邢占芬,李彤,等. 福建分析测试),2009,18(1):16
[17] Rogeterg M,Wilson S R,Malerod H,et al. J Chromatogr A,2011,1218(41):7281

