纳米甘薯渣纤维素对糖尿病大鼠血糖及血脂水平的影响
陆红佳,游玉明,刘金枝,张 晶,李本姣,刘 雄,*
(1.西南大学食品科学学院,重庆 400715;2.重庆文理学院林学与生命科学学院,重庆 402160)
纳米甘薯渣纤维素对糖尿病大鼠血糖及血脂水平的影响
陆红佳1,2,游玉明1,2,刘金枝1,张 晶1,李本姣1,刘 雄1,*
(1.西南大学食品科学学院,重庆 400715;2.重庆文理学院林学与生命科学学院,重庆 402160)
目的:探讨纳米甘薯渣纤维素对糖尿病大鼠血糖及血脂的影响。方法:选用40 只雄性Sprague-Dawley(SD)大鼠随机分组为5 组,其中1 组大鼠喂食基础饲料作为空白组,另外4 组采用链脲佐菌素(streptozotocin,STZ)诱导大鼠建立糖尿病模型,分为模型对照组(MC组)、普通甘薯渣纤维素组(OC组)、微晶甘薯渣纤维素组(MCC组)和纳米甘薯渣纤维素组(CNC组),实验期28 d,测定大鼠体质量、采食量、空腹血糖、糖化血清蛋白、血清胰岛素、肝糖原及血脂水平等指标。结果:模型对照组大鼠的采食量,空腹血糖、糖化血清蛋白、血脂水平均显著高于空白组(P<0.05),体质量、胰岛素和肝糖原含量明显下降(P<0.05),说明造模成功,糖尿病大鼠表现出相应的症状。喂食不同粒度甘薯渣纤维素的糖尿病大鼠,其体质量、血清胰岛素和肝糖原水平有所增加,而空腹血糖、糖化血清蛋白、血脂水平等都有所下降,其中喂食纳米甘薯纤维素的糖尿病大鼠指标变化具有显著性差异(P<0.05)。结论:从甘薯渣纤维素粒度分析,可以看出随着甘薯渣纤维素粒度的减小,其对糖尿病大鼠血糖血脂的调节作用愈加明显,其中纳米甘薯渣纤维素具有较好的调节血糖血脂水平的作用。
纳米甘薯渣纤维素;糖尿病大鼠;糖化血清蛋白;胰岛素;血脂
糖尿病(diabetes mellitus,DM)是一种多病因的代谢疾病,表现为慢性高血糖症状,伴随因胰岛素分泌或作用缺陷引起的糖、脂肪和蛋白质代谢紊乱。糖尿病在临床上以高血糖为主要特点,出现多尿、多饮、多食、消瘦等典型症状,即“三多一少”,糖尿病血糖水平一旦控制不好,会引发多种并发症,导致肾、眼、足等器官的衰竭病变,且无法治愈[1]。糖尿病是一种需要终身治疗的慢性疾病,目前开发研制并使用的治疗糖尿病的药物包括胰岛素制剂和口服降血糖药[2]。这些药物作用直接、见效快,但易出现低血糖症和胃肠道不适等副作用。有研究表明,通过合理膳食能够有效调节血糖水平,预防由于糖尿病导致的高脂血症疾病的发生[3-4]。
流行病学调查发现饮食过于精细导致的纤维摄入不足是导致糖尿病发生的主要原因之一,研究表明,膳食纤维具有降血糖、降血脂、预防癌症等诸多生理功能[5-7]。膳食纤维对胆汁酸、胆固醇变异原和葡萄糖等有机化合物具有较好的吸收作用,能够有效地控制葡萄糖的吸收速率,抑制总胆固醇水平的升高,降低胆酸及其盐类的合成与吸收,进而起到预防糖尿病、冠状动脉硬化、心脑血管疾病以及胆结石等功效[8]。高膳食纤维饮食能够有效控制餐后血糖水平的升高、改善糖耐量,同时控制脂类代谢紊乱的发生[9-10]。研究表明,膳食纤维的这些生理活性与其物理化学特性相关联,膳食纤维的粒度越小,则其比表面积越大,持水力、膨胀性和黏度也相应增大,生理功能的发挥越显著[11-13]。
纳米纤维素(nanocrystal cellulose,NCC)是由天然纤维素或微晶纤维素经强酸降解而制得。它不但具有纤维素的基本结构与性能,还具有纳米颗粒的特性,如巨大的比表面积、超强的吸附能力和较高的反应活性,因此导致其性质与普通纤维素的性质有很大差异[14]。目前国内外对于纳米纤维素的研究较少,主要集中在纳米纤维素的微观结构、结晶结构和热稳定性方面[15-16]。膳食纤维经超细化后,成为一种高活性膳食纤维,其持水力、结合水力、膨胀力和离子交换能力等显著提高,比表面积剧增,口感变细腻,可溶性成分含量提高,生物活性强度增大[17-19]。研究表明,随着甘薯渣纤维素粒度的减小,其理化特性有所提高,并且具有一定的降血脂功效[20]。膳食纤维也具有一定的降血糖作用。本研究以纳米甘薯渣纤维素为原料,研究其对糖尿病大鼠血糖及血脂水平的影响,同时与普通甘薯渣纤维素和微晶甘薯渣纤维素进行对比,分析纤维素粒度大小与血糖及血脂调节作用的相关性。
1 材料与方法
1.1 动物、材料与试剂
Sprague-Dawley(SD)成年雄性大鼠,体质量约180~200 g,由重庆滕鑫比尔实验动物销售有限公司提供,动物许可证号:SCXK(渝)2012-0006。
基础饲料 重庆滕鑫比尔实验动物销售有限公司;甘薯渣 四川光友薯业有限公司;甘薯渣纤维素、微晶甘薯渣纤维素、纳米甘薯渣纤维素 实验室自行制备[21]。
链脲佐菌素(streptozotocin,STZ) 美国Sigma公司;糖化血清蛋白测定试剂盒、总胆固醇(total cholesterol,TC)测定试剂盒、甘油三酯(triglyceride,TG)测定试剂盒、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)测定试剂盒、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)测定试剂盒 上海北海生物技术工程有限公司;大鼠胰岛素酶联免疫吸附(enzyme-linked immunosorbent assay,ELISA)试剂盒 南京建成生物工程研究所;氯仿、甲醇、氯化钠、无水乙醇等均为分析纯。
1.2 仪器与设备
JA2003A型电子天平 上海精天电子仪器有限公司;WH-1型微型旋涡混合仪 上海沪西分析仪器厂;HITACHI-7020型全自动生化分析仪 日本株式会社日立高新技术;MILLIPORE实验室纯水系统 美国Millipore公司;血糖仪 三诺安稳血糖测试仪;低温离心机 德国Sigma公司;ES-315型高压蒸汽灭菌锅 日本Kagoshima Seisakusyo公司;iMark酶标仪 美国Bio-Rad公司。
1.3 方法
1.3.1 糖尿病大鼠模型的建立
体质量为180~200 g的SD成年雄性大鼠40 只,每只单笼饲养在不锈钢大鼠笼中,室温(25±1)℃,12 h明暗轮换(8:00—20:00)。适应性喂养1 周后,按大鼠体质量随机分为5 组,任选1 组作为空白组(CON组),喂食基础饲料,其余4 组禁食不禁水12 h,用0.1 mmol/L的柠檬酸-柠檬酸钠缓冲溶液(pH 4.2)配制2 mg/mL的STZ溶液(STZ易升华,须在冰浴条件下配制,并现用现配)。然后,每只大鼠按60 mg/kg的剂量空腹注射新配好的STZ溶液,建立1型糖尿病模型,注射完毕后所有大鼠自由饮食,待稳定性饲养3 d后于尾部取血,测定其空腹血糖值,将空腹血糖值>11.1 mmol/L的大鼠确定为糖尿病大鼠,未达标者追加注射1 次STZ[22]。将造模成功糖尿病大鼠随机分为4 组:模型对照组(MC组)、普通甘薯渣纤维素组(OC组)、微晶甘薯渣纤维素组(MCC组)和纳米甘薯渣纤维素组(CNC组)。每组大鼠的饲料配方见表1,实验期间各组大鼠每天均自由摄食及饮水,每天记录大鼠采食量、称量大鼠体质量,每两周测定一次各组大鼠的空腹血糖值,实验周期为4 周。

表1 各组大鼠饲料配方Table 1 Formulations of the experimental dietsg/kg
1.3.2 样品采集
实验期最后1 d断粮12 h,19:00—21:00乙醚麻醉各组大鼠后,断头处死,从颈部取血,血液收集在装有抗凝剂的采血管中,4 000 r/min、4 ℃离心15 min[23],将分离出的血清分装在1.5 mL离心管中并贮存在-20 ℃冰箱中待分析。收集完血清后,肝脏经冰冷的生理盐水灌流1 min后将其摘除,在冰冷的生理盐水中吸取表面的水分后,用吸湿纸除去表面水滴,称取0.10 g(精确到0.01 g)肝脏,用铝箔纸包好装入样品袋,放入-20 ℃冰箱保存,用于肝糖原含量的测定。
1.3.3 指标测定
1.3.3.1 空腹血糖值的测定
采用血糖仪测定大鼠的空腹血糖值:分别在第2周和第4周时将大鼠禁食12 h,尾部取血,滴在血糖试条的反应端,用血糖仪测定大鼠的空腹血糖值。
1.3.3.2 糖化血清蛋白含量的测定
测定原理:血清葡萄糖能与白蛋白及其他血清蛋白分子N末端的氨基发生非酶促糖化反应,形成高分子酮胺结构。此酮胺结构能够在碱性环境中与硝基四氮唑蓝(nitrotetrazolium blue chloride,NBT)发生还原反应,生成甲瓒,并以二甲基甲酰胺(dimethylformamide,DMF)为标准参照物进行比色反应。
取大鼠离心后的血清,按试剂盒说明书方法采用果糖胺法测定血清中的糖化血清蛋白含量。
1.3.3.3 血清胰岛素含量的测定
测定原理:采用ELISA双抗体一步夹心法。往预先包被胰岛素抗体的包被微孔中,依次加入标本、标准品、辣根过氧化物酶(horse reddish peroxidase,HRP)标记的检测抗体,经过温育并彻底洗涤。用底物四甲基联苯胺(tetramethylbenzidine,TMB)显色,TMB在过氧化物酶的催化下转化成蓝色,并在酸的作用下最终转化成黄色。颜色的深浅和样品中的胰岛素含量成正相关。用酶标仪在450 nm波长处测定吸光度,即可计算出样品中的胰岛素含量。
取大鼠离心后的血清,按试剂盒说明书方法测定血清胰岛素含量。
1.3.3.4 肝糖原含量的测定
测定原理:糖原在浓碱溶液中较稳定,故将肝组织先置于浓碱中加热,破坏蛋白质及其他成分,肝糖原得以保留,然后加乙醇至终体积分数为60%,使之沉淀析出并除去小分子有机物质,以免后者在浓硫酸中炭化影响生色。糖原在浓硫酸中可先水解生成葡萄糖,然后进一步脱水生成糠醛衍生物。后者和蒽酮作用,形成蓝绿色化合物,与经过相同法处理的葡萄糖标准溶液比色,即可计算出样品中的糖原含量。
按试剂盒说明书方法,精确称取大鼠肝脏100 mg,按照每1 mg样品与3 μL碱液混合的比例加入试管,沸水浴20 min,流水冷却后得到肝糖原水解液,将肝糖原水解液配制为质量分数1%的检测液,同时配制空白液与标准液,混匀后沸水浴5 min,待其冷却后,于620 nm波长处比色,计算糖原含量。
1.3.3.5 血脂水平的测定
血清中TC、TG、HDL-C、LDL-C含量的测定均按照试剂盒说明书方法进行,用全自动生化分析仪定量。
1.4 数据处理
实验数据经Excel初步统计后用SPSS 17.0软件进行显著性分析。实验结果以±s表示,采用单因素方差分析确定组间的差异性,P<0.05被认为有显著差异。
2 结果与分析
2.1 纳米甘薯渣纤维素对糖尿病大鼠体质量的影响

表2 纳米甘薯渣纤维素对糖尿病大鼠体质量的影响(x±s,n=8)Table 2 Effects of cellulose nanocrystals on body weight in diabetic rats (x±s,n= 8) g
空腹注射STZ的大鼠正常饲喂6 d后,测定其空腹血糖值,将空腹血糖值大于11.1 mmol/L的大鼠视为糖尿病模型大鼠,它们均具有多食、多饮和多尿等糖尿病典型症状,同时出现活动量减少、毛色泛黄并失去光泽等现象。由表2可知,在实验刚开始,各组大鼠体质量基本保持一致。实验期间空白组(CON组)大鼠体质量逐渐增加,由于造模成功,糖尿病组大鼠的体质量明显下降,而在喂食不同粒度甘薯渣纤维素2 周后,大鼠体质量没有明显变化,但随着饲喂时间的延长,呈现出明显的增加趋势。从第4周各组大鼠体质量的变化来看,与空白组相比,糖尿病组大鼠体质量显著降低;而糖尿病组中,与模型对照组(MC组)相比,喂食不同粒度甘薯渣纤维素组的糖尿病大鼠体质量增加,其中喂食纳米甘薯渣纤维素(CNC组)的糖尿病大鼠体质量增加具有统计学意义(P<0.05)。在第2周时,与空白组相比,糖尿病组大鼠的体质量都有不同程度下降,且均显著低于空白组。4 周后,糖尿病组大鼠体质量略微有所增加,与模型对照组相比,纳米甘薯渣纤维素组糖尿病大鼠的体质量增加具有统计学意义(P<0.05)。因此,从体质量的变化看,喂食纳米甘薯渣纤维素具有缓解糖尿病大鼠体质量下降的作用。
2.2 纳米甘薯渣纤维素对糖尿病大鼠采食量的影响

图1 纳米甘薯渣纤维素对糖尿病大鼠采食量的影响(x±s,n =8)Fig.1 Effects of cellulose nanocrystals on food intake in diabetic rats (x±s,n= 8)
由图1可知,与空白组相比,糖尿病组大鼠的采食量显著升高(P<0.05),这说明造模成功,糖尿病的最主要症状就是多食,可以明显看出糖尿病组大鼠的采食量是空白组大鼠采食量的两倍左右。在糖尿病组中,与模型对照组相比,不同粒度甘薯渣纤维素组的大鼠采食量均有所降低,随着纤维素粒度的减小,大鼠的采食量呈下降趋势,但均未达到显著性水平(P>0.05)。以上结果说明喂食不同粒度的甘薯渣纤维素对糖尿病大鼠采食量没有显著影响。
2.3 纳米甘薯渣纤维素对糖尿病大鼠空腹血糖值的影响
由图2可知,空白组大鼠的空腹血糖值在饲喂期间一直维持在正常范围内(4~6 mmol/L),而糖尿病组大鼠的空腹血糖值则大于11 mmol/L,这说明造模成功且比较稳定。与模型对照组相比,在第2周时,喂食不同粒度甘薯渣纤维素的糖尿病大鼠的空腹血糖值均有不同程度的降低,其中纳米甘薯渣纤维素组(CNC组)糖尿病大鼠的空腹血糖值显著降低(P<0.05);在第4周时,喂食不同粒度甘薯渣纤维素的糖尿病大鼠的空腹血糖值比第2周时又有所下降,与模型对照组相比,喂食纳米甘薯渣纤维素的糖尿病大鼠的空腹血糖值的降低具有统计学意义(P<0.05),这说明喂食纳米甘薯渣纤维素有助于降低糖尿病大鼠的空腹血糖值。

图2 纳米甘薯渣纤维素对糖尿病大鼠空腹血糖值的影响(x±s,n =8)Fig.2 Effects of cellulose nanocrystals on fasting plasma glucose in diabetic rats (x±s,n= 8)
2.4 纳米甘薯渣纤维素对糖尿病大鼠糖化血清蛋白水平的影响
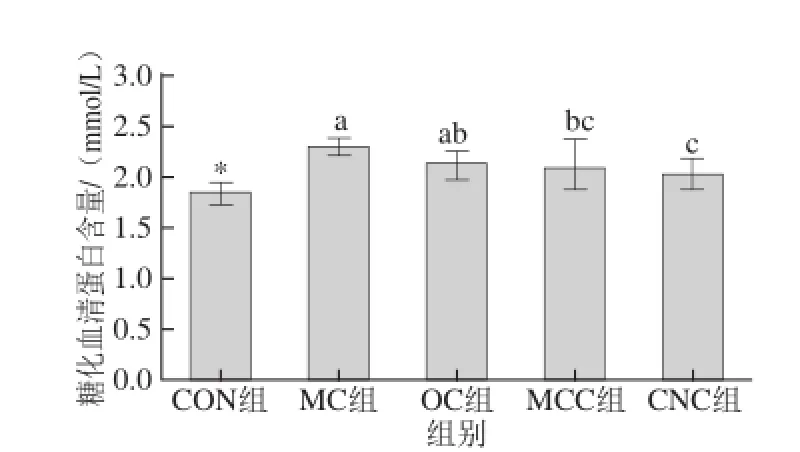
图3 纳米甘薯渣纤维素对糖尿病大鼠糖化血清蛋白含量的影响(x±s,n=8)Fig.3 Effects of cellulose nanocrystals on glycosylated serum protein in diabetic rats(x±s,n= 8)
由图3可知,与空白组相比,糖尿病组大鼠的糖化血清蛋白含量显著增加(P<0.05)。糖尿病组之间比较,可以看出喂食不同粒度的甘薯渣纤维素使得糖尿病大鼠的糖化血清蛋白含量有所下降;与模型对照组(MC组)相比,喂食微晶甘薯渣纤维素(MCC组)和纳米甘薯渣纤维素(CNC组)的糖尿病大鼠的糖化血清蛋白含量分别下降了0.20 mmol/L和0.28 mmol/L,而喂食纳米甘薯渣纤维素的糖尿病大鼠的糖化血清蛋白含量低于微晶甘薯渣纤维素组,这说明甘薯渣纤维素的粒度越小,其降低糖尿病大鼠糖化血清蛋白含量的作用越明显。
2.5 纳米甘薯渣纤维素对糖尿病大鼠血清胰岛素水平的影响
胰岛素是体内唯一同时促进糖原、脂肪、蛋白质合成的激素,它通过抑制脂肪组织内的激素敏感性脂肪酶,可减缓脂肪动员的速率。血液中的胰岛素只有在与肝脏肌肉和脂肪组织细胞表面的胰岛素受体结合后,才能发挥作用。胰岛素缺乏可造成脂肪代谢紊乱,脂肪贮存减少、分解加强,血脂水平升高,久之可引起动脉硬化[24]。由图4可知,与空白组相比,模型对照组(MC组)大鼠血清胰岛素含量显著降低(P<0.05)。由于糖尿病大鼠的胰岛受到破坏,导致其胰岛素分泌能力下降。糖尿病组大鼠中,喂食不同粒度甘薯渣纤维素后,糖尿病大鼠的血清胰岛素含量有所升高,其中纳米甘薯渣纤维素组(CNC组)糖尿病大鼠血清胰岛素含量的增加具有统计学意义(P<0.05)。
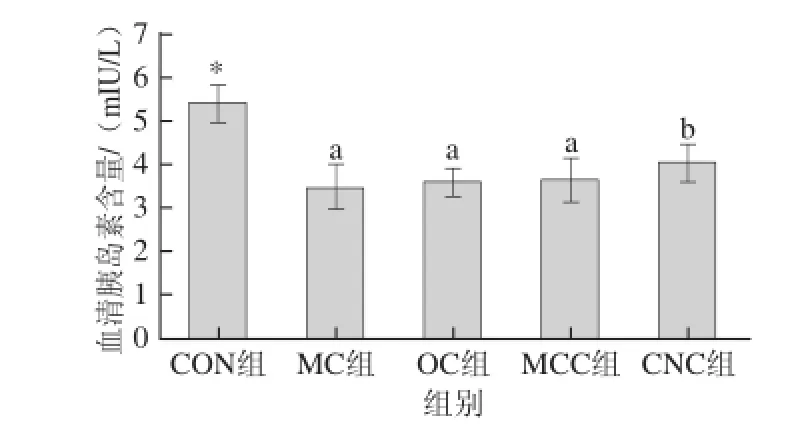
图4 纳米甘薯渣纤维素对糖尿病大鼠血清胰岛素含量的影响(x±s,n=8)Fig.4 Effects of cellulose nanocrystals on serum insulin in diabetic rats(x±s,n= 8)
2.6 纳米甘薯渣纤维素对糖尿病大鼠肝糖原含量的影响
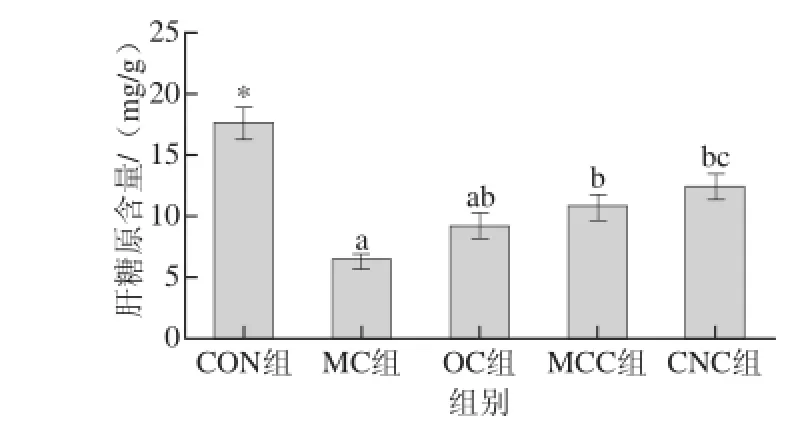
图5 纳米甘薯渣纤维素对糖尿病大鼠肝糖原含量的影响Fig.5 Effects of cellulose nanocrystals on liver glycogen in diabetic rats
由图5可知,空白组(CON组)大鼠的肝糖原水平处于较高的正常水平,而在糖尿病组大鼠中,对照组糖尿病大鼠的肝糖原水平最低,且与其他各组均有显著差异(P<0.05),说明糖尿病大鼠的糖原代谢机制被破坏,代谢发生紊乱。本研究中,喂食不同粒度甘薯渣纤维素组的糖尿病大鼠肝糖原水平与模型对照组(MC组)相比有所升高,其中微晶甘薯渣纤维素组(MCC组)和纳米甘薯渣纤维素组(CNC组)糖尿病大鼠肝糖原水平升高具有统计学意义(P<0.05)。这说明喂食纳米甘薯渣纤维素能够增加糖尿病大鼠糖原的合成,使肝糖原的水平增加。
2.7 纳米甘薯渣纤维素对糖尿病大鼠血脂水平的影响
由表3可知,模型对照组大鼠血清中TC、TG和 LDL-C浓度均显著高于空白组(P<0.05),而HDL-C浓度显著低于空白组(P<0.05),这主要是由于糖尿病导致大鼠体内糖代谢紊乱,而体内脂肪代谢与糖代谢有着密切的关系,从而出现非营养过剩导致的高血脂现象。糖尿病组中,与模型对照组(MC组)相比,喂食不同粒度甘薯渣纤维素后,大鼠血中的TC、TG 和LDL-C浓度都呈下降趋势,其中普通甘薯渣纤维素组(OC组)大鼠的血脂水平都未达到显著水平,而纳米甘薯渣纤维素组(CNC组)大鼠的血脂水平均达到了显著水平(P<0.05);而不同粒度的甘薯渣纤维素对于大鼠血清HDL-C浓度均没有显著性影响,只有升高的趋势,这种趋势随着甘薯渣纤维素粒度的减小而升高。以上结果表明,纳米甘薯渣纤维素对糖尿病大鼠的血脂水平具有一定的调节作用。
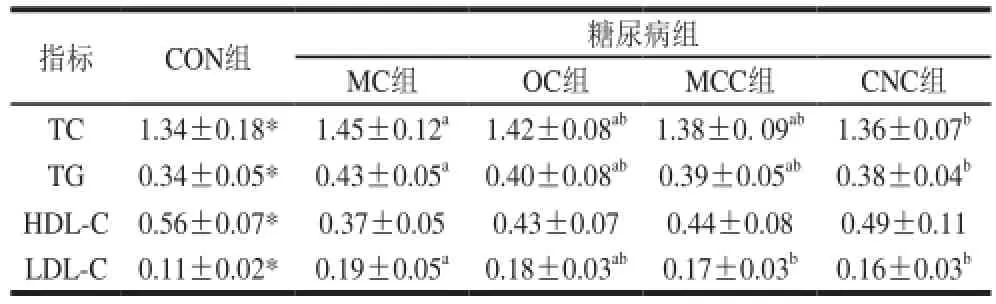
表3 纳米甘薯渣纤维素对糖尿病大鼠血脂水平的影响(x±s,n=8)Table 3 Effects of cellulose nanocrystals on serum lipids in diabetic rats (x±s,n= 8)mmol/L
3 讨 论
膳食习惯与糖尿病密切相关,膳食营养对于防治糖尿病也具有重要意义。药物控制糖尿病虽然具有显著的疗效,但会对胃肠道、肝、肾及心脏具有一定的副作用,通过饮食治疗,不但可以避免用药过度、减轻经济负担,更重要的是可以减少对机体的不良反应[25]。膳食纤维有助于降低餐后血糖水平,维持餐后血糖值的稳定,避免血糖水平的剧烈波动,服用膳食纤维能够有效预防糖尿病[26]。
通过研究纳米甘薯渣纤维素对糖尿病大鼠血糖及血脂水平的影响,可以看出通过添加一定量不同粒度的甘薯渣纤维素,能使糖尿病大鼠的体质量略有增加,其中添加纳米甘薯渣纤维素的糖尿病大鼠体质量增加具有统计学意义(P<0.05);而采食量有所下降,但无统计学意义,主要是由于纤维素具有一定溶胀及不消化性,会产生饱腹感,所以喂食不同粒度的甘薯渣纤维素,大鼠的采食量略微下降,同时随着纤维素粒度的减小,其溶胀性增强,饱腹感也随之增加,故而使得大鼠的采食量呈下降趋势;添加不同粒度的甘薯渣纤维素使得糖尿病大鼠的空腹血糖值和糖化血清蛋白含量下降,血清胰岛素含量增加。糖尿病发生后,由于胰岛素分泌不足或细胞对胰岛素作用不敏感,使葡萄糖进入肌肉细胞受阻,造成葡萄糖利用率减少,血糖值升高。膳食纤维可提高外周组织对胰岛素的敏感性,改善胰岛素抵抗,降低血糖水平[27];同时添加不同粒度甘薯渣纤维素也增加了大鼠肝糖原的含量,研究表明糖原是体内葡萄糖的重要储存形式,肝脏糖原异生和肝脏合成肝糖原是血糖的重要来源和去路。在肝脏内,糖原可被直接被分解或发生糖异生作用,肝糖原合成减少或者分解增加可以引起血糖水平的升高,肝糖原含量的减少与糖尿病发展密切相关[28]。糖原合成过程中,糖原合成酶磷酸化激活,导致糖原生成,但是糖尿病患者中缺乏这一活化作用,膳食纤维可增加糖原的合成,使肝糖原含量上升[29];而不同粒度甘薯渣纤维素的添加使大鼠血清TC、TG和LDL-C含量下降,血清HDL-C含量增加,表明机体内脂肪代谢与糖代谢有着紧密的内在联系,当机体需要能量供给时,肝糖原分解和异生作用产生的葡萄糖与脂肪组织降解产生的游离脂肪酸共同成为能量的来源。同时,糖类利用率的减少使脂肪组织的分解产物成为能量的主要来源。血液中游离脂肪酸的大量存在使得肌肉细胞对葡萄糖的消耗利用度更差,形成糖尿病的恶性循环。因此,血脂水平的调控对糖尿病的治疗也具有重要作用[30]。
膳食中添加甘薯渣纤维素有缓解糖尿病症状的作用,有助于控制糖尿病大鼠的体质量,调节血糖及血脂水平。分析对比不同甘薯渣纤维素粒度可看出,纳米甘薯渣纤维素显著增加了糖尿病大鼠的血清胰岛素和肝糖原的含量(P<0.05),同时显著降低了糖尿病大鼠的空腹血糖值、糖化血清蛋白含量,以及血清TC、TG和LDL-C含量(P<0.05)。主要由于随着纤维素粒度的减小,其持水力、溶胀性、持油性和离子交换能力等显著提高,比表面积剧增,理化特性显著增加[21],因此,纳米甘薯渣纤维素的调节作用更明显。膳食纤维饮食对糖尿病病情控制十分有效,但由于糖尿病本身发病原因及发病机制的复杂性,膳食纤维及其粒度大小对糖尿病控制作用的机理尚不明确,尚需要进一步探讨,同时,研究开发糖尿病纤维食品将真正体现出糖尿病饮食治疗的医学价值,对推动糖尿病饮食治疗的发展意义重大。
[1] 康继宏, 宁光, 吴家睿, 等. 中国糖尿病防治研究的现状和挑战[J].转化医学研究: 电子版, 2012, 2(3): 1-24.
[2] 吴素芳, 王建忠, 丛亚丽. 糖尿病药物治疗的新进展[J]. 中国医刊, 2002, 37(9): 55.
[3] MELLO V D, LAAKSONEN D E. Dietary fibers: current trends and health benefits in the metabolic syndrome and type 2 diabetes[J]. Arquivos Brasileiros de Endocrinologia & Metabologia, 2009, 53(5): 509-518.
[4] KALKWARF H J, BELL R C, KHOURY J C, et al. Dietary fiber intakes and insulin requirements in pregnant women with type 1 diabetes[J]. Journal of the American Dietetic Association, 2001, 101(3): 305-310.
[5] GIACCO R, CLEMENTE G, RICCARDI G. Dietary fibre in treatment of diabetes: myth or reality?[J]. Digestive and Liver Disease, 2002, 34(Suppl 2): 140-144.
[6] LECUMBERRI E, GOYA L, MATEOS R, et al. A diet rich in dietary fiber from cocoa improves lipid profile and reduces malondialdehyde in hypercholesterolemic rats[J]. Nutrition, 2007, 23(4): 332-341.
[7] PETERS U, SINHA R, CHATTERJEE N, et al. Dietary fibre and colorectal adenoma in a colorectal cancer early detection programme[J]. Lancet, 2003, 361: 1491-1495.
[8] 章瑜. 膳食纤维对Ⅱ型糖尿病大鼠的血糖影响及机理研究[D]. 南昌: 南昌大学, 2011: 12-14.
[9] WEICKERT M O, MÖHLIG M, SCHÖFL C, et al. Cereal fiber improves whole-body insulin sensitivity in overweight and obese women[J]. Diabetes Care, 2006, 29(4): 775-780.
[10] LU Z X, WALKER K Z, MUIR J G, et al. Arabinoxylan fiber, a byproduct of wheat flour processing, reduces the postprandial glucose response in normoglycemic subjects[J]. American Journal of Clinical Nutrition, 2000, 71(5): 1123-1128.
[11] 陈钢, 刘韬, 熊春红, 等. 瞬时高压对荷叶膳食纤维物理性质的影响[J].食品科学, 2006, 27(12): 246-248.
[12] CHAU C F, WANG Y T, WEN Y L. Different micronization methods significantly improve the functionality of carrot insoluble fibre[J]. Food Chemistry, 2007, 100(4): 1402-1408.
[13] 郑慧, 王敏, 于智峰, 等. 超微粉碎对苦荞麸功能特性的影响[J]. 农业工程学报, 2007, 23(12): 258-262.
[14] LU P, HSIEH Y L. Preparation and properties of cellulose nanocrystals: rods, spheres, and network[J]. Carbohydrate Polymers, 2010, 82(2): 329-336.
[15] ROSA M F, MEDEIROS E S, MALMONGE J A, et al. Cellulose nanowhiskers from coconut husk fibers: effect of preparation conditions on their thermal and morphological behavior[J]. Carbohydrate Polymers, 2010, 81(1): 83-92.
[16] ZULUAGA R, PUTAUX J L, CRUZ J, et al. Cellulose microfibrils from banana rachis: effect of alkaline treatments on structural and morphological features[J]. Carbohydrate Polymers, 2009, 76(1): 51-59.
[17] de ESCALADA PLA M F, PONCE N M, STORTZ C A, et al. Composition and functional properties of enriched fiber products obtained from pumpkin (Cucurbita moschata Duchesne ex Poiret)[J]. LWT-Food Science and Technology, 2007, 40(7): 1176-1185.
[18] RAGHAVENDRA S N, RASTOGI N K, RAGHAVARAO K, et al. Dietary fiber from coconut residue: effects of different treatments and particle size on the hydration properties[J]. European Food Research and Technology, 2004, 218(6): 563-567.
[19] 梅新, 木泰华, 陈学玲, 等. 超微粉碎对甘薯膳食纤维成分及物化特性影响[J]. 中国粮油学报, 2014, 29(2): 76-81.
[20] 桂余, 陆红佳, 张端莉, 等. 甘薯渣纤维素粒度对去势大鼠血脂降低效果的影响[J]. 食品科学, 2014, 35(5): 218-222. doi: 10.7506/ spkx1002-6630-201405043.
[21] LU Hongjia, GUI Yu, ZHENG Longhui, et al. Morphological, crystalline, thermal and physicochemical properties of cellulose nanocrystals obtained from sweet potato residue[J]. Food Research International, 2013, 50(1): 121-128.
[22] 徐叔云, 卡如濂, 陈修. 药理实验方法学[M]. 北京: 人民卫生出版社, 1995: 1277-1278.
[23] LIU Xiong, OGAWA H, KISHIDA T, et al. The effect of highamylose cornstarch on lipid metabolism in OVX rats is affected by fructose feeding[J]. Journal of Nutritional Biochemistry, 2010, 21(2): 89-97.
[24] 梁峻. 糖尿病调治养护手册[M]. 北京: 中医古籍出版社, 2008: 3-4.
[25] WEICKERT M O, PFEIFFER A F H. Metabolic effects of dietary fiber consumption and prevention of diabetes[J]. Journal of Nutrition, 2008, 138(3): 439-442.
[26] CHANDALIA M, GARG A, LUTJOHANN D, et al. Beneficial effects of high dietary fiber intake in patients with type 2 diabetes mellitus[J]. New England Journal of Medicine, 2000, 342(19): 1392-1398.
[27] LUSTIG R H. Diabetes and dietary fibre: directive or distraction?[J]. Clinical & Experimental Ophthalmology, 2012, 40(3): 230-231.
[28] KRSSAK M, BREHM A, BERNROIDER E, et al. Alterations in postprandial hepatic glycogen metabolism in type 2 diabetes[J]. Diabetes, 2004, 53(12): 3048-3056.
[29] BOBY R G, LEELAMMA S. Blackgram fiber (Phaseolus mungo): mechanism of hypoglycemic action[J]. Plant Foods for Human Nutrition, 2003, 58(1): 7-13.
[30] BENNION L J, GRUNDY S M. Effects of diabetes mellitus on cholesterol metabolism in man[J]. New England Journal of Medicine, 1977, 296(24): 1365-1371.
Effects of Cellulose Nanocrystals from Sweet Potato Residues on the Levels of Blood Glucose and Serum Lipid in Diabetic Rats
LU Hongjia1,2, YOU Yuming1,2, LIU Jinzhi1, ZHANG Jing1, LI Benjiao1, LIU Xiong1,*
(1. College of Food Science, Southwest University, Chongqing 400715, China; 2. College of Forestry and Life Science, Chongqing University of Arts and Sciences, Chongqing 402160, China)
Objective: To investigate the effects of cellulose nanocrystals from sweet potato residues on the levels of blood glucose and serum lipid in diabetic rats. Methods: Forty mature male SD rats were divided into five groups. One group was fed with a basal diet as control group (CON). The other four groups were subjected to intraperitoneal injection of streptozotocin (STZ) to establish diabetic rat models. The rats were fed with the basal diet and dietary fiber, assigned into model control (MC), ordinary cellulose (OC), microcrystalline cellulose (MCC) and cellulose nanocrystals (CNC) groups. All rats were sacrificed after 28 days of feeding to assay body weight, food intake, fasting plasma glucose, glycosylated serum protein, serum insulin, liver glycogen, and serum lipids. Results: Compared with the control group, food intake, fasting plasma glucose, glycosylated serum protein, and serum lipids in the model control were significantly higher (P < 0.05); however body weight, insulin and hepatic glycogen significantly declined (P < 0.05). The results suggested the diabetic model was successfully established and the diabetic rats showed corresponding symptoms. Feeding sweet potato fibers with different granularities to diabetic rats could result in an increase in body weight and the levels of serum insulin and glycogen and a decrease in fasting glucose, glycosylated serum protein and blood lipids. In contrast, feeding cellulose nanocrystals caused significant changes in all these parameters (P < 0.05). Conclusion: The hypoglycemic and hypolipidemic effects of sweet potato residue fiber were more obvious with decreasing granularity. Therefore, cellulose nanocrystals from sweet potato residues can effectively regulate the levels of blood glucose and serum lipid.
cellulose nanocrystals from sweet potato residues; diabetic rats; glycosylated serum protein; insulin; serum lipid
TS201.4
A
1002-6630(2015)21-0227-06
10.7506/spkx1002-6630-201521042
2014-12-18
中央高校基本科研业务费专项资金项目(XDJK2014D017)
陆红佳(1986—),女,博士研究生,研究方向为食品化学与营养学。E-mail:aaluhongjia@163.com
*通信作者:刘雄(1970—),男,教授,博士,研究方向为碳水化合物功能与利用,食品营养学。E-mail:liuxiong848@hotmail.com

